- 2.56 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
弱电解质
的电离平衡和溶液的酸碱性
[
考试标准
]
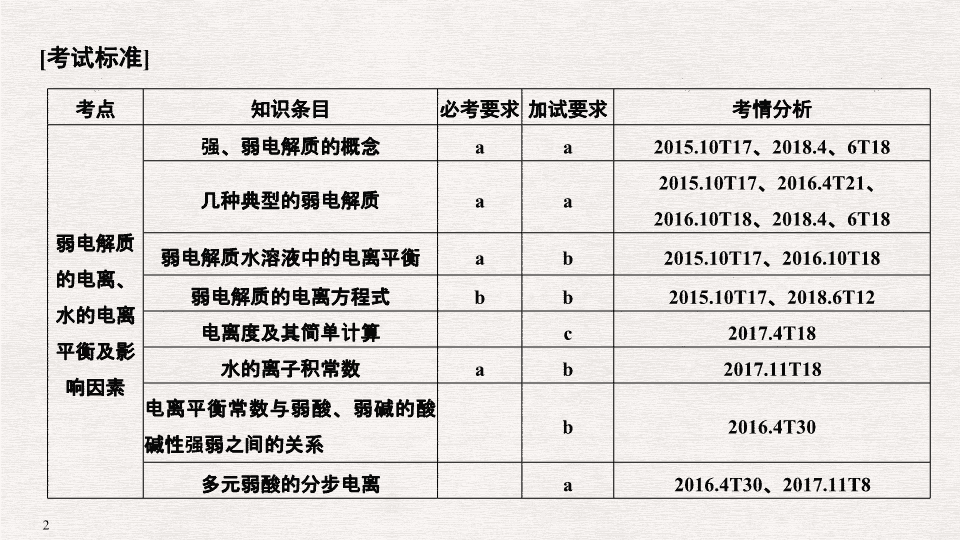
考点
知识条目
必考要求
加试要求
考情分析
弱电解质的电离、水的电离平衡及影响因素
强、弱电解质的概念
a
a
2015.10T17
、
2018.4
、
6T18
几种典型的弱电解质
a
a
2015.10T17
、
2016.4T21
、
2016.10T18
、
2018.4
、
6T18
弱电解质水溶液中的电离平衡
a
b
2015.10T17
、
2016.10T18
弱电解质的电离方程式
b
b
2015.10T17
、
2018.6T12
电离度及其简单计算
c
2017.4T18
水的离子积常数
a
b
2017.11T18
电离平衡常数与弱酸、弱碱的酸碱性强弱之间的关系
b
2016.4T30
多元弱酸的分步电离
a
2016.4T30
、
2017.11T8
溶液的酸碱性及
pH
的有关计算
溶液的酸碱性与溶液中
c
(
H
+
)、
c
(
OH
-
)的关系
a
a
2015.10T17
、
2018.4
、
6T18
pH
的概念,
pH
与溶液酸碱性的关系
a
a
2016.4T21
、
2016.10T18
、
2017.4T18
、
2017.11T18
、
2018.4
、
6T18
pH
的简单计算
b
c
测定溶液酸碱性的方法,用
pH
试纸、
pH
计测定溶液的
pH
a
b
2016.10T18
、
2017.4T23
考点一:强电解质、弱电解质
1.
(
2018·
宁波高三适应性测试)
常温下,关于等体积、等
pH
的稀盐酸和稀醋酸溶液,下列说法正确的是( )
A.
两溶液中
c
(
OH
-
):盐酸
<
醋酸
B.
醋酸溶液中
c
(
H
+
)=
c
(
CH
3
COO
-
)
C.
中和同浓度
NaOH
溶液的能力:盐酸
<
醋酸
D.
分别用水稀释相同倍数后,两溶液
pH
仍相等
答案
C
考点二:电离方程式
2.
(
2016·
浙江余姚中学高二下期中)
下列电离方程式中,错误的是( )
解析
HI
为强电解质,
HI
在水溶液中完全电离,电离方程式为:
HI===H
+
+
I
-
,错误。
答案
C
考点三:外界条件对电离平衡的影响
3.
(
2016·
浙江省宁波市九所重点校高二期末)
已知某温度下
CH
3
COOH
和
NH
3
·H
2
O
的电离常数相等,现向
10 mL
浓度为
0.1 mol·L
-
1
的
CH
3
COOH
溶液中滴加相同浓度的氨水,在滴加过程中
( )
答案
D
考点四:电离平衡常数
4.
(
2018·
余姚中学高三模拟)
常温下
,
K
a
(
HCOOH
)=
1.77
×
10
-
4
,
K
a
(
CH
3
COOH
)=
1.75
×
10
-
5
,
K
b
(
NH
3
·H
2
O
)=
1.76
×
10
-
5
,下列说法正确的是( )
A.
浓度均为
0.1 mol·L
-
1
的
HCOONa
和
NH
4
Cl
溶液中阳离子的物质的量浓度之和:前者大于后者
B.
用相同浓度的
NaOH
溶液分别滴定等体积
pH
均为
3
的
HCOOH
和
CH
3
COOH
溶液至终点,消耗
NaOH
溶液的体积相等
C.0.2 mol·L
-
1
HCOOH
与
0.1 mol·L
-
1
NaOH
等体积混合后的溶液中:
c
(
HCOO
-
)+
c
(
OH
-
)=
c
(
HCOOH
)+
c
(
H
+
)
D.0.2 mol·L
-
1
CH
3
COONa
与
0.1 mol·L
-
1
盐酸等体积混合后的溶液中(
pH<7
):
c
(
CH
3
COOH
)
>
c
(
Cl
-
)
>
c
(
CH
3
COO
-
)
>
c
(
H
+
)
答案
A
考点五:强弱电解质的判断
5.
(
2018·
嘉兴一中高三)
下列事实中,能说明
MOH
是弱碱的有( )
①
0.1 mol/L MOH
溶液可以使酚酞试液变红
②
0.1 mol/L MCl
溶液呈酸性
③
同条件下
0.1 mol/L MOH
溶液的导电性比
0.1 mol/L NaOH
溶液弱
④
等体积的
0.1 mol/L MOH
溶液与
0.1 mol/L HCl
溶液恰好完全反应
A.
①②③
B.
②③
C.
②④
D.
③④
解析
①
0.1 mol/L MOH
可以使酚酞试液变红,说明
MOH
溶液呈碱性,而不能说明
MOH
的电离程度,不能证明
MOH
是弱电解质,错误;
②
0.1 mol/L
的
MCl
溶液呈酸性,说明
MCl
为强酸弱碱盐,
M
+
离子水解而导致溶液呈酸性,则
MOH
为弱电解质,正确;
③
0.1 mol/L MOH
溶液的导电性比
0.1 mol/L NaOH
溶液弱,说明
MOH
溶液中离子浓度较小,
MOH
部分电离,正确;
④
等体积的
0.1 mol/L MOH
溶液与
0.1 mol/L HCl
溶液恰好完全反应,无论是强碱还是弱碱,都恰好完全反应,错误;选
B
。
答案
B
考点六:强、弱电解质的比较
6.
(
2018·
浙江十校联盟)
下列说法不正确的是( )
A.
一定条件下某溶液
pH
=
6.5
,可能呈中性
B.
室温下某酸
HA pH
=
2.0
的溶液
10 mL
,加水稀释至
100 mL
时,
pH
=
3.0
则
HA
为强酸
C.
醋酸溶液与
NaOH
溶液反应后,若溶液中
c
(
Na
+
)=
c
(
CH
3
COO
-
),则溶液呈中性
D.
等体积、
pH
相等的氨水和
NaOH
溶液中和盐酸能力相同
答案
D
答案
A
考点八:水电离产生
c
(
H
+
)或
c
(
OH
-
)计算
8.
(
2018·
浙江省杭州第十四中学)
在不同温度下,水溶液中
c
(
H
+
)与
c
(
OH
-
)关系如图所示。下列说法不正确的是( )
答案
B
考点九:
pH
计算
9.
(
2016·
湖州市高一期末)
常温下有体积为
V
1
mL
、
pH
为
m
的稀硫酸和体积为
V
2
mL
、
pH
为
n
的
NaOH
溶液混合后:
答案 (
1
)酸 大于 (
2
)
1
0.1
10
m
+
n
-
14
大于
易错点一 不能正确认识强、弱电解质的导电能力
1.
误认为强电解质溶液的导电性一定强于弱电解质溶液。其实不一定,因为溶液的导电性强弱取决于溶液中离子的浓度及离子所带电荷数的多少,与电解质的强弱无必然关系,只有当强、弱电解质等浓度时,强电解质溶液离子浓度大,导电性才强于弱电解质溶液。
2.
误认为某化合物的水溶液能导电,则这种化合物一定是电解质。
NH
3
、
CO
2
的水溶液可以导电是因为
NH
3
、
CO
2
与水反应生成了
NH
3
·H
2
O
、
H
2
CO
3
,
NH
3
·H
2
O
、
H
2
CO
3
发生电离而导电,故
NH
3
、
CO
2
是非电解质。
[
易错训练
1]
(
2017·
温州十校)
如图表示在常温下
CH
3
COOH
溶液中加水时溶液的导电性变化,下列叙述不正确的是( )
A.a
点:
c
(
H
+
)>
c
(
CH
3
COO
-
)>
c
(
OH
-
)
B.b
点:
c
(
H
+
)=
c
(
CH
3
COO
-
)+
c
(
OH
-
)
C.
已知常温下,物质的量浓度相等的
CH
3
COONa
与
CH
3
COOH
混合液的
pH
<
7
,在此溶液中继续加
CH
3
COONa
至
pH
=
7
,则此时溶液中存在:
c
(
Na
+
)=
c
(
CH
3
COO
-
)>
c
(
CH
3
COOH
)>
c
(
H
+
)=
c
(
OH
-
)
D.CH
3
COOH
溶液的
pH
:
a
>
b
答案
D
[
易错训练
2]
(
2018·
浙江暨阳联谊学校)
25
℃
时,向
1 L 0.1 mol·L
-
1
NaA
溶液中,不断通入
HCl
气体后,
c
(
A
-
)与
c
(
HA
)的变化趋势如图所示(假设通入的
HCl
气体被溶液完全吸收,且不考虑溶液体积的变化),下列说法不正确的是( )
A.
通入
HCl
气体过程中水的电离程度不断减小
B.M
点:
n
(
H
+
)-
n
(
OH
-
)=(
a
-
0.05
)
mol
C.
随着
HCl
的通入,
[
c
(
HA
)
·
c
(
OH
)
-
] /
c
(
A
-
)不断增大
D.
当
n
(
HCl
)=
0.1 mol
时,
c
(
H
+
)>
c
(
Na
+
)-
c
(
HA
)
答案
C
易错点三
pH
试纸使用的误区
1.
使用
pH
试纸测溶液
pH
时,若先用蒸馏水润湿,测量结果不一定偏小。若先用蒸馏水润湿,相当于将待测液稀释了,若待测液为碱性溶液,则所测结果偏小;若待测液为酸性溶液,则所测结果偏大;若待测液为中性溶液,则所测结果没有误差。
2.
溶液的
pH
可以用
pH
试纸测定(精确到整数,且只有在
1
~
14
的范围内),也可以用
pH
计(精确到
0.1
)测定。
[
易错训练
3]
(
2016·
浙江省嘉兴一中高二下期末)
用
pH
试纸测定溶液
pH
的正确操作是( )
A.
将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
B.
将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
C.
将一小块试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D.
将一小块试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
解析
pH
试纸在使用前不能用蒸馏水润湿,也不能直接放到待测液中去测定,故
B
、
C
、
D
均错。
答案
A
易错点四 不能正确判断溶液的酸碱性
1.
误认为溶液的酸碱性取决于
pH
。如
pH
=
7
的溶液在温度不同时,可能是酸性或碱性,也可能是中性。
2.
误认为酸碱恰好中和时溶液一定显中性。如强酸和弱碱恰好中和溶液显酸性,强碱和弱酸恰好中和溶液显碱性,强酸和强碱恰好中和溶液显中性。
[
易错训练
4]
(
2018·
绍兴高三适应性测试)
下列说法正确的是( )
A.
c
(
H
+
)=
c
(
OH
-
)的溶液不一定呈中性
B.
在相同温度下,
pH
相等的氨水和
NaOH
溶液,
n
(
OH
-
)相等
C.
体积相等、
pH
相等的
CH
3
COOH
和盐酸与
Zn
反应,
开始时盐酸放出
H
2
快
D.0.1 mol/L HF
溶液的
pH
=
2
,中和相同体积、相同浓度的
HF
和盐酸,消耗的
NaOH
相等
解析
A.
c
(
H
+
)=
c
(
OH
-
)的溶液一定呈中性,故
A
错;
B.
在相同温度下,
pH
相等的氨水和
NaOH
溶液,
c
(
OH
-
)相等,故
B
错;
C.
体积相等、
pH
相等的
CH
3
COOH
和盐酸与
Zn
反应,开始时二者放出
H
2
速率相等,故
C
错;
D.0.1 mol/L HF
溶液的
pH
=
2
,说明
HF
为弱酸,但中和相同体积、相同浓度的
HF
和盐酸,消耗的
NaOH
的量相等,故
D
对。
答案
D