- 259.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学试卷
第I卷(选择题)
一、单选题(每小题3分,共48分)
1.已知:(1)Zn(s)+O2(g)=== ZnO(s),ΔH=-348.3 kJ·mol-1,
(2)2Ag(s)+O2(g)=== Ag2O(s),ΔH= -31.0 kJ·mol-1,
则Zn(s)+ Ag2O(s) === ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-379.3 kJ·mol-1 B.-317.3 kJ·mol-1
C.-332.8 kJ·mol-1 D.317.3 kJ·mol-1
2.在某一化学反应中,反应物A的浓度在10 s内从0.8 mol / L变为0.2 mol / L,则在这10 s内A的化学反应速率为( )
A.0.02 mol / L B.0.02 mol / (L·s)
C.0.06 mol / L D.0.06 mol / (L·s)
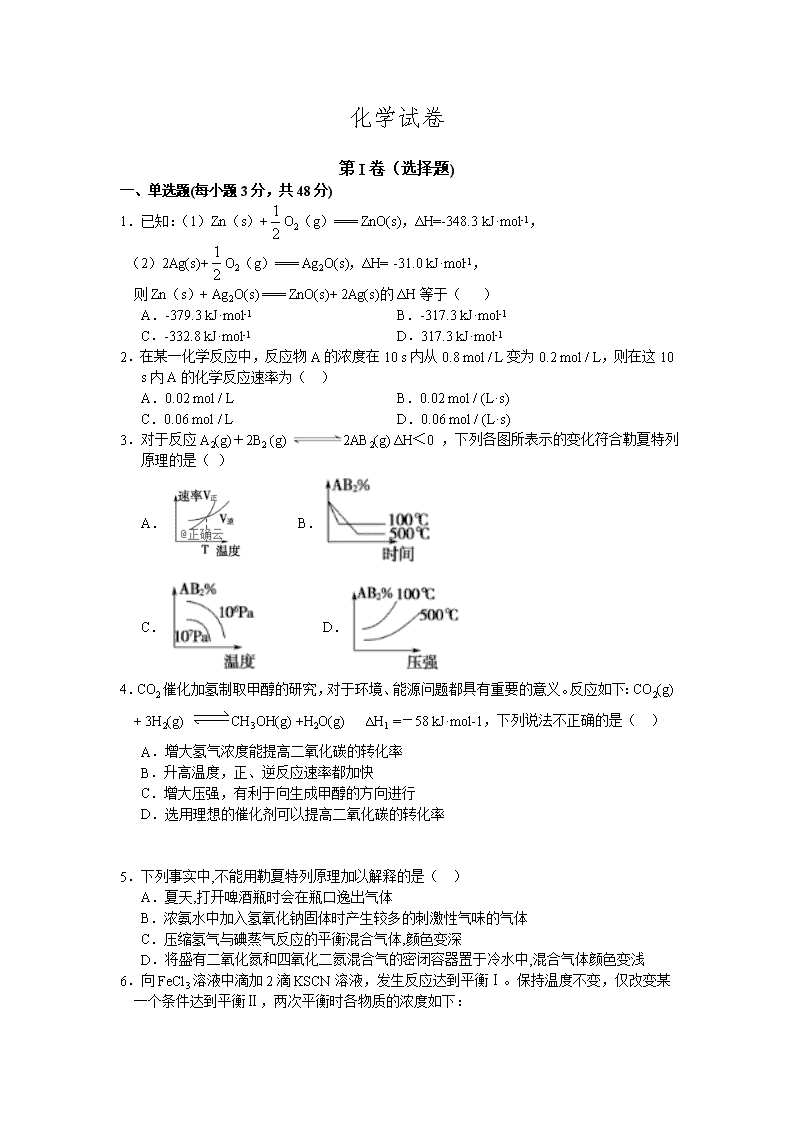
3.对于反应A2(g)+2B2 (g) 2AB2(g) ΔH<0 ,下列各图所表示的变化符合勒夏特列原理的是( )
A. B.
C. D.
4.CO2催化加氢制取甲醇的研究,对于环境、能源问题都具有重要的意义。反应如下:CO2(g) + 3H2(g) CH3OH(g) +H2O(g) ∆H1 =-58 kJ·mol-1,下列说法不正确的是( )
A.增大氢气浓度能提高二氧化碳的转化率
B.升高温度,正、逆反应速率都加快
C.增大压强,有利于向生成甲醇的方向进行
D.选用理想的催化剂可以提高二氧化碳的转化率
5.下列事实中,不能用勒夏特列原理加以解释的是( )
A.夏天,打开啤酒瓶时会在瓶口逸出气体
B.浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体
C.压缩氢气与碘蒸气反应的平衡混合气体,颜色变深
D.将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅
6.向FeCl3溶液中滴加2滴KSCN溶液,发生反应达到平衡Ⅰ。保持温度不变,仅改变某一个条件达到平衡Ⅱ,两次平衡时各物质的浓度如下:
Fe3+(aq)+3SCN-(aq) Fe(SCN)3(aq)
平衡Ⅰ/(mol·L-1) a b c
平衡Ⅱ/(mol·L-1) x y z
下列叙述不正确的是( )
A.存在关系式:c/ab3=z/xy3
B.存在关系式:(a-x)∶(b-y)∶(z-c)=1∶3∶1
C.向溶液中加入少量铁粉,溶液颜色变浅
D.当溶液中c(SCN-)保持不变时达到平衡状态
7.某温度下,E(g)+F(g)R(g)+N(g)的平衡常数K=4/9。该温度下在A、B、C三个恒容密闭容器中,投入E(g)、F(g),其起始浓度如下表,下列判断正确的是( )
起始浓度
A
B
C
c (E)/ mol•L-1
0.010
0.020
0.020
c (F)/ mol•L-1
0.010
0.010
0.020
A.平衡时,B中E的转化率为大于40%
B.平衡时,A中和C中F的转化率均为40%
C.平衡时,C中c(R)是A中的2倍,为0.012mol•L-1
D.反应开始时A和C中反应速率相等
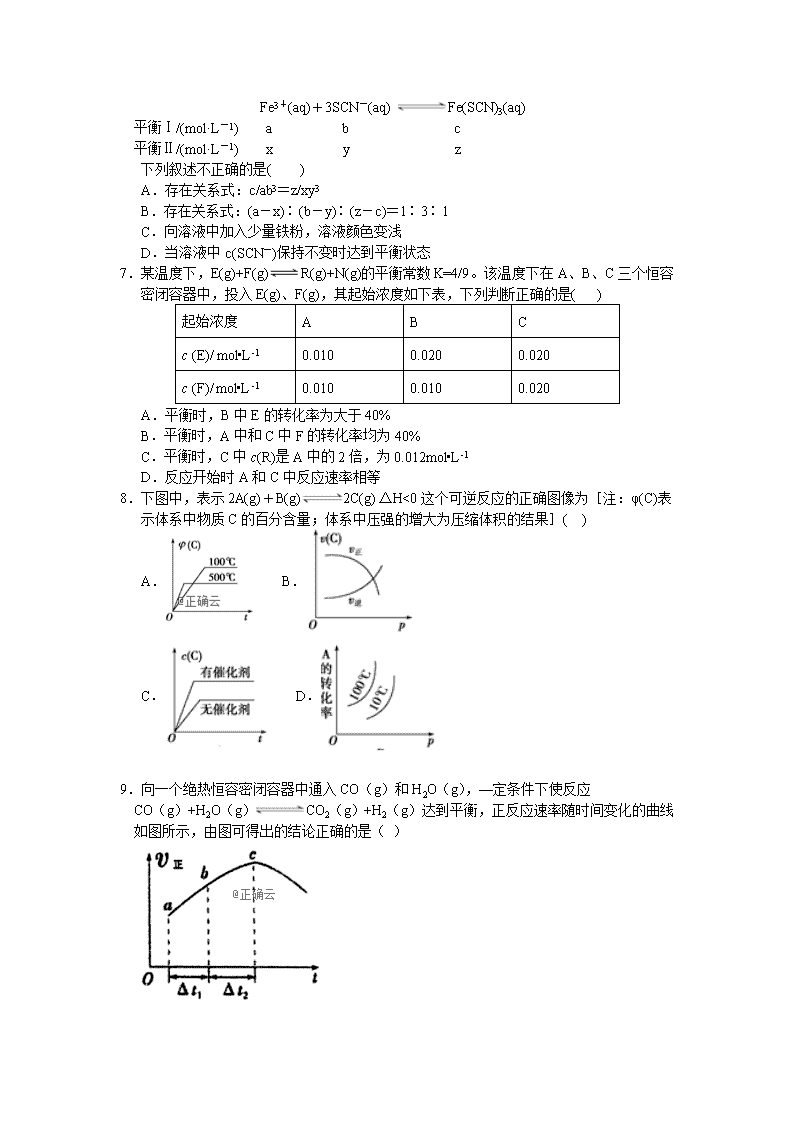
8.下图中,表示2A(g)+B(g)2C(g) △H<0这个可逆反应的正确图像为[注:φ(C)表示体系中物质C的百分含量;体系中压强的增大为压缩体积的结果]( )
A. B.
C. D.
9.向一个绝热恒容密闭容器中通入CO(g)和H2O(g),—定条件下使反应
CO(g)+H2O(g)CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是( )
A.反应物浓度:a点小于c点
B.该反应的正反应可能为放热反应
C.c点达到平衡状态
D.△t1=△t2时,H2的产率:a〜b段大于b〜c段
10.下列依据热化学方程式得出的结论正确的是( )
A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
C.已知C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g) ΔH2;则ΔH2>ΔH1
D.放热过程(ΔH<0)或熵增加(ΔS> 0)的过程一定是自发的
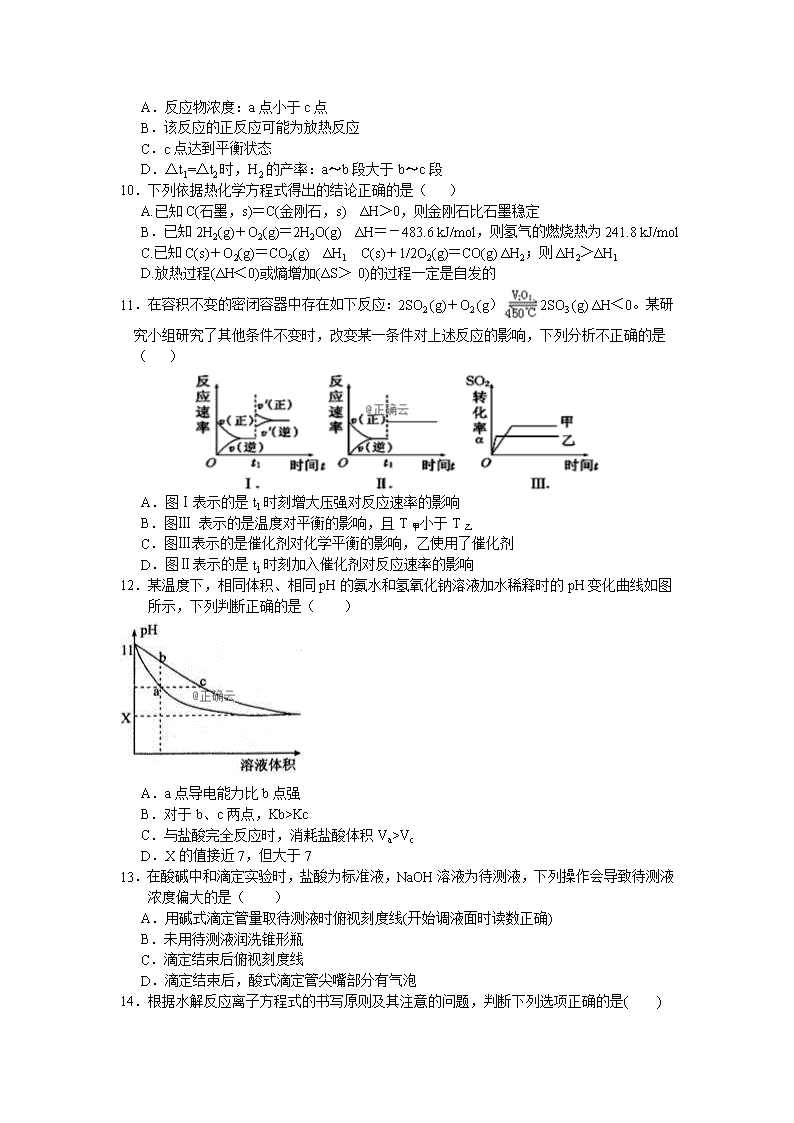
11.在容积不变的密闭容器中存在如下反应:2SO2 (g)+O2 (g)2SO3 (g) ΔH<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是( )
A.图Ⅰ表示的是t1时刻增大压强对反应速率的影响
B.图Ⅲ 表示的是温度对平衡的影响,且T甲小于T乙
C.图Ⅲ表示的是催化剂对化学平衡的影响,乙使用了催化剂
D.图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响
12.某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
A.a点导电能力比b点强
B.对于b、c两点,Kb>Kc
C.与盐酸完全反应时,消耗盐酸体积Va>Vc
D.X的值接近7,但大于7
13.在酸碱中和滴定实验时,盐酸为标准液,NaOH溶液为待测液,下列操作会导致待测液浓度偏大的是( )
A.用碱式滴定管量取待测液时俯视刻度线(开始调液面时读数正确)
B.未用待测液润洗锥形瓶
C.滴定结束后俯视刻度线
D.滴定结束后,酸式滴定管尖嘴部分有气泡
14.根据水解反应离子方程式的书写原则及其注意的问题,判断下列选项正确的是( )
A.FeCl3+3H2O = Fe(OH)3↓+3HCl B.KF溶液:F-+H2O = HF+OH-
C.S2-+2H2OH2S+2OH- D.HCO3-+H2OH2CO3+OH-
15.常温时,1 mol/L的HClO2和1 mol/L的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得曲线如图所示。下列说法正确的是( )
A.当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
B.在0≤pH≤5时,HMnO4溶液满足,pH=lg
C.常温下,浓度均为0.1mol·L-1的HClO2和HMnO4溶液的pH: HMnO4>HClO2
D. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
16.下列图示与对应的叙述不相符的是( )
A.图甲表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:
2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
B.图乙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变
C.图丙表示压强对可逆反应2A(g)+2B(g)3C(g)+D(g)的影响,则P乙>P甲
D.图丁表示反应:4CO(g)+2NO2(g)N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始时CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数
K1>K2
第II卷(非选择题)
二、填空题
17.(6分)已知下列热化学方程式:
①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;
②H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1;
③C(s)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1;
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。
回答下列各问题:
(1)H2燃烧热为 ,燃烧10 g H2生成液态水,放出的热量为 。
(2)盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可通过间接的方法测定,则由已知条件得CO的燃烧热的热化学方程式为 。
18.(12分)(1)某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度 25℃(选填 “>”“<”“=”),其理由是 。
(2)若保持温度不变,向少量水中加入 g的NaOH固体,并加入水至1L,才能使溶液中水电离产生的H+、OH-的浓度乘积为c(H+)水·c (OH-)水=10-26。
(3)若保持温度不变,向水中通入HCl气体,恰好使溶液中的c(H+)/c(OH-)=109,此时水电离出的的c(OH-)= 。
(4)若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两溶液的体积比。
①若所得混合溶液为中性,则a:b = 。
②若a:b=101:9,则混合后溶液的pH= 。
19.(10分)CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g) N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L) 时间/min
0
10
20
30
40
NO
2.0
1.16
0.40
0.40
0.6
N2
0
0.42
0.80
0.80
1.2
CO2
0
0.42
0.80
0.80
1.2
①若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”)。
②根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率υ(N2)= mol·L-1·min-1;计算该反应的平衡常数K= 。
③若30min后只改变某一条件,据上表中的数据判断改变的条件可能是 (填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
(2)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。若某次捕捉后得到pH=10 的溶液,则溶液c(CO32-)∶c(HCO3-)= 。[常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
20.(12分)食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于3.5 g/100 mL。用中和滴定的方法可以测定食醋中醋酸的浓度,某白醋的醋酸浓度测定过程如下图所示:
完成下列填空:
(1)稀释白醋时需要的仪器有烧杯、_____________________________。
(2)某同学一共进行了三次实验。以下是他设计的实验数据记录表,
实验次数
稀释后白醋
体积(mL)
标准NaOH溶液
A
B
消耗体积(mL)
1
20.00
22.05
2
20.00
21.34
3
20.00
21.30
B表示 ,数据处理:消耗标准NaOH溶液的体积= mL。
若测得稀释后白醋的浓度0.0594 mol/L,则该食醋 (选填“符合”、“不符合”)国家标准。
标准NaOH溶液通过以下步骤准备:①配制500 mL浓度约为0.1 mol/L的NaOH溶液;
②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度。
(3)称量所需的NaOH固体置于大烧杯中,加入500 mL蒸馏水,搅拌溶解,该配制步骤
(填“可行”或“不可行”)。
(4)NaOH标准溶液的浓度需通过测定而不能直接配制的原因是 。
21.(12分)NO、NO2等氮氧化物的消除和再利用有多种方法。
(1)活性炭还原法:某研究小组向某密闭容器中加入足量的活性炭和NO,发生反应:
C(s)+2NO(g) N2(g)+ CO2(g) △H = Q kJ·mol-1,在T℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
时间min
浓度mol/L
0
10
20
30
40
50
NO
1.00
0.40
0.20
0.30
0.30
N2
0
0.40
0.60
0.60
CO2
0
0.60
0.60
①0~10min内,N2的平均反应速率υ(N2)= .
②30min后,若只改变一个条件,反应重新达到平衡时各物质的浓度如上表所示,则改变的条件可能是 (填序号).
a.加入一定量的活性炭 b.改变反应体系的温度
c.缩小容器的体积 d.通入一定量的NO e.使用催化剂
(2)NH3催化还原法:原理如图所示。
①若烟气中c(NO2) :c(NO)=1:1,发生图甲所示的脱氮反应时,每转移1.5mol电子放出的热量为113.8kJ,则发生该脱氮反应的热化学方程式为 .
②图乙是在一定时间内,使用不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为
;使用Mn作催化剂时,脱氮率b-a 段呈现如图变化的可能原因是 (答1点).
(3)NO2与N2O4之间存在转化:N2O4(g) 2NO2(g),将一定量的N2O4放入恒容密闭容器中。
己知N2O4的起始压强p0为108 kPa,325℃时,N2O4的平衡转化率为40%,则该温度下反应的平衡常数为:
Kp= kPa(用平衡分压代替平衡浓度计算,分压=总压×各物质的量分数,保留一位小数).