- 451.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
西藏山南市第二高级中学2020届高三第一次模拟考试
理综化学试卷
相对原子质量 H-l C-12 N- 14 O-16 Na-23 Mg-24 S-32 Fe-56 Cu-64
1. 生活中处处有化学。下列说法正确的是
A. 制饭勺、饭盒、高压锅等的不锈钢是合金
B. 做衣服的棉和麻均与淀粉互为同分异构体
C. 煎炸食物的花生油和牛油都是可皂化的饱和酯类
D. 磨豆浆大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
【答案】A
【解析】
【详解】A.“不锈钢是合金”,不锈钢是铁、钴、镍的合金,故A正确;
B.棉和麻主要成分是纤维素,与淀粉一样都属于混合物,不属于同分异构体,故B错误;
C.花生油是不饱和酯类,牛油是饱和酯类,故C错误;
D.豆浆煮沸是蛋白质发生了变性,故D错误。
故选A。
2.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温下,23 g NO2含有NA个氧原子
B. 1 L 0.1 mol·L-1的氨水含有0.1NA个OH-
C. 常温常压下,22.4 L CCl4含有NA个CCl4分子
D. 1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子
【答案】A
【解析】
【详解】A.23gNO2的物质的量是=0.5mol,含有1mol氧原子,选项A正确;
B.氨水是弱碱,部分电离,即.1 L 0.1 mol·L-1氨水含有OH-个数小于0.1NA,选项B错误;
C.常温常压下四氯化碳不是气体,不能适用于气体摩尔体积,选项C错误;
D.反应中亚铁离子失去1个电子,选项D错误;
答案选A。
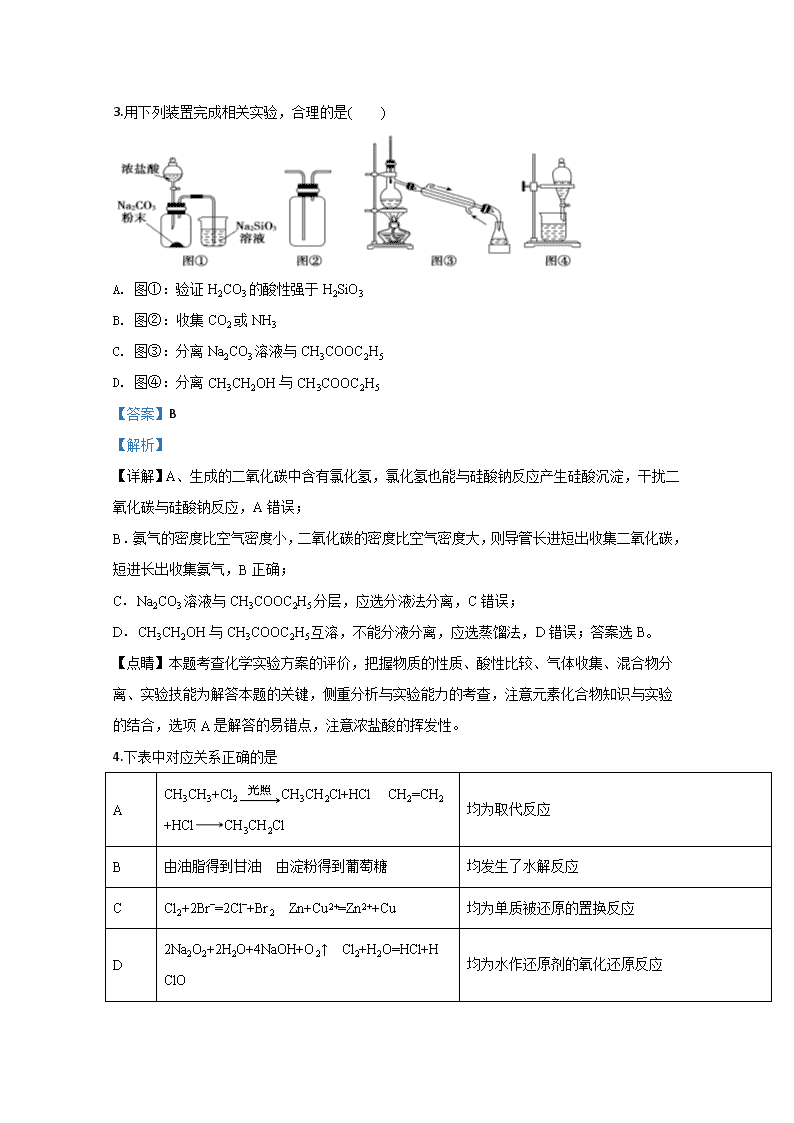
3.用下列装置完成相关实验,合理的是( )
A. 图①:验证H2CO3的酸性强于H2SiO3
B. 图②:收集CO2或NH3
C. 图③:分离Na2CO3溶液与CH3COOC2H5
D. 图④:分离CH3CH2OH与CH3COOC2H5
【答案】B
【解析】
【详解】A、生成的二氧化碳中含有氯化氢,氯化氢也能与硅酸钠反应产生硅酸沉淀,干扰二氧化碳与硅酸钠反应,A错误;
B.氨气的密度比空气密度小,二氧化碳的密度比空气密度大,则导管长进短出收集二氧化碳,短进长出收集氨气,B正确;
C.Na2CO3溶液与CH3COOC2H5分层,应选分液法分离,C错误;
D.CH3CH2OH与CH3COOC2H5互溶,不能分液分离,应选蒸馏法,D错误;答案选B。
【点睛】本题考查化学实验方案的评价,把握物质的性质、酸性比较、气体收集、混合物分离、实验技能为解答本题的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,选项A是解答的易错点,注意浓盐酸的挥发性。
4.下表中对应关系正确的是
A
CH3CH3+Cl2CH3CH2Cl+HCl
CH2=CH2+HClCH3CH2Cl
均为取代反应
B
由油脂得到甘油
由淀粉得到葡萄糖
均发生了水解反应
C
Cl2+2Br‾=2Cl‾+Br2
均为单质被还原的置换反应
Zn+Cu2+=Zn2++Cu
D
2Na2O2+2H2O+4NaOH+O2↑
Cl2+H2O=HCl+HClO
均为水作还原剂的氧化还原反应
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.CH2=CH2+HCl→CH3CH2Cl为烯烃的加成反应,而CH3CH3+Cl2CH3CH2Cl+HCl为烷烃的取代反应,故A错误;
B.油脂为高级脂肪酸甘油酯,水解生成甘油;淀粉为多糖,水解最终产物为葡萄糖,则均发生了水解反应,故B正确;
C.Cl2+2Br-═2Cl-+Br2中Cl元素的化合价降低;Zn+Cu2+═Zn2++Cu中Zn元素的化合价升高,前者单质被还原,后者单质被氧化,均属于置换反应,故C错误;
D.2Na2O2+2H2O═4NaOH+O2↑中只有过氧化钠中O元素的化合价变化,水既不是氧化剂也不是还原剂;Cl2+H2O═HCl+HClO中只有Cl元素的化合价变化,属于氧化还原反应,但水既不是氧化剂也不是还原剂,故D错误;
故选B。
【点睛】本题的易错点是D,2Na2O2+2H2O═4NaOH+O2↑反应中只有过氧化钠中的O元素的化合价变化;Cl2+H2O═HCl+HClO中只有Cl元素的化合价变化。
5.我国科研人员研制出一种室温“可呼吸” Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如图所示。吸收全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是
A. “吸入”CO2时,钠箔为正极
B. “呼出”CO2时,Na+向多壁碳纳米管电极移动
C. “吸入” CO2时的正极反应式为:4Na++3CO2+4e-=2Na2CO3+C
D. 标准状况下,每“呼出”22.4 L CO2,转移电子的物质的量为0.75 mol
【答案】C
【解析】
【详解】A.“吸入”CO2时,活泼金属钠是负极,不是正极,故A错误;
B.“呼出”CO2时,是电解池,多壁碳纳米管电极是阳极,钠离子向阴极钠箔移动,而不是向多壁碳纳米管移动,故B错误;
C. “吸入” CO2时是原电池装置,正极发生还原反应,正极反应式为:4Na++3CO2+4e-=2Na2CO3+C,故C正确;
D.标准状况下,每“呼出”22.4 L CO2,物质的是量为1mol,结合阳极电极反应式2Na2CO3+C-4e-=4Na++3CO2↑,所以每“呼出”22.4 L CO2,转移电子数为1.3 mol,故D错误;
故选C。
6.短周期元素W、X、Y、Z的原子序数依次增加,Y和W、Y和Z分别相邻,且W、Y和Z三种元素的原子最外层电子数之和为19,x原子的电子层数与最外层电子数相等。下列说法错误的是
A. 单质的沸点:Y>W>Z B. 离子半径:XY D. W与X可形成离子化合物
【答案】A
【解析】
【分析】
X原子的电子层数与最外层电子数相等,X应为Al,Y和W、Y和Z分别相邻,且W、Y和
Z三种元素的原子最外层电子数之和为19,则W为O、Y为S,Z为Cl元素。
【详解】A.氯气的相对分子质量比氧气大,沸点比氧气高,故A错误;
B.X为Al、Y为S、硫离子比铝离子多一个电子层,离子半径较大,故B正确;
C.非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,气态氢化物的稳定性:H2O>H2S,故C正确;
D.O的非金属性较强,与铝反应生成的氧化铝为离子化合物,熔融状态下可导电,故D正确。
故选A。
7.常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C. 第二阶段,Ni(CO)4分解率较低
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
【答案】B
【解析】
【详解】A.平衡常数只与温度有关,与浓度无关,故A错误;
B.50℃时,Ni(CO)4以气态存在,有利于分离,从而促使平衡正向移动,故B正确;
C.230℃时,Ni(CO)4分解的平衡常数K逆=1/K正=1/(2×10−5)=5×104,可知分解率较高,故C错误;
D.平衡时,应该是4v生成[Ni(CO)4]=v生成(CO),故D错误;
正确答案:B
8.某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:
己知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
溶解性(本身均可作溶剂)
沸点(℃)
密度(g/mL)
乙醇
与水互溶,易溶于有机溶剂
78.5
0.8
溴乙烷
难溶于水,易溶于有机溶剂
38.4
1.4
请回答下列问题:
(1) B中发生反应生成目标产物的化学方程式为_________。
(2)根据实验目,选择下列合适的实验步骤:①→___________(选填②③④等)。
①组装好装置,___________(填写实验操作名称);
②将A装置中的纯铁丝小心向下插入苯和液溴的混合液中;
③点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10分钟;
④向烧瓶中加入一定量苯和液溴,向锥形瓶中加入无水乙醇至稍高于进气导管口处,向U形管中加入蒸馏水封住管底,向水槽中加入冰水。
(3)简述实验中用纯铁丝代替铁粉的优点:_____。
(4)冰水的作用是_______。
(5)反应完毕后,U形管内的现象是______________;分离溴乙烷时所需的玻璃仪器有_____。
【答案】 (1). C2H5OH+HBrC2H5Br+H2O (2). ④②③ (3). 检査其气密性 (4). 随时控制反应的进行,不反应时上拉铁丝,反应时放下铁丝 (5). 降温,冷凝溴乙烷 (6). U形管底部产生无色的油状液体 (7). 分液漏斗、烧杯。
【解析】
【分析】
装置A中生成溴苯和溴化氢,B中乙醇和溴化氢反应生成溴乙烷和水,C用来收集产品,据此解答。
【详解】(1)HBr和乙醇在加热条件下,发生取代反应生成目标产物溴乙烷和水, B中发生反应生成目标产物的化学方程式为C2H5OH+HBrC2H5Br+H2O。故答案为:C2H5OH+HBrC2H5Br+H2O;
(2)利用苯和液溴反应制得溴苯,同时生成的溴化氢与乙醇发生取代反应得到溴乙烷,则应先连接装置并检查所密性,再添加药品,先加热A装置使苯和液溴先反应,再加热B装置制溴乙烷,即实验的操作步骤为:①④②③,故答案为:④②③;检查气密性;
(3)实验中用纯铁丝代替铁粉的优点:可随时控制反应的进行,不反应时上拉铁丝,反应时放下铁丝,而铁粉添加后就无法控制反应速率了,故答案为:随时控制反应的进行,不反应时上拉铁丝,反应时放下铁丝;
(4)冰水的作用是可降温,冷凝溴乙烷,防止其挥发,故答案为:降温,冷凝溴乙烷;
(5)反应完毕后,U形管内的现象是底部有油状液体;溴乙烷与蒸气水不相溶,混合物可利用分液操作进行分离,需要的玻璃仪器有分液漏斗和烧杯,故答案为:U形管底部产生无色的油状液体;分液漏斗、烧杯。
【点睛】本题考查了溴苯和溴乙烷的制取,这是一个综合性较强的实验题,连续制备两种产品溴苯和溴乙烷,需要根据题意及装置图示,联系所学知识合理分析完成,易错点(5)实验时要注意观察并认真分析分离物质的原理,确定用分液的方法分离。
9.硫酸亚铁晶体俗称绿矾(FeSO4 • 7H2O),重铬酸钠晶体俗称红矾钠(Na2Cr2O7·2H2O),它们都是重要的化工产品。工业上以铬铁矿[主要成分是[Fe(CrO2)2]为原料制备绿矾和红矾钠的工艺流程如图所示。
请回答下列问题:
(1)已知Fe(CrO2)2中铬元素的化合价为+3价,则Fe(CrO2)中铁元素的化合价为______________。
(2)化学上可将某些盐写成氧化物形式,如Na2SiO3写成Na2O·SiO2,则Fe(CrO2)2可写成__________。
(3)煅烧铬铁矿时,矿石中的Fe(CrO2)2转变成可溶于水的Na2CrO4,反应的化学方程式如下:
4Fe(CrO2)2+8Na2CO3+7O22Fe2O3+8Na2CrO4+8CO2
①该反应中还原剂与氧化剂的物质的量之比为________________。
②为了加快该反应的反应速率,可采取的措施是_________________(填一种即可)。
⑷己知CrO42-在氢离子浓度不同的酸性溶液中有不同的反应。如:
2CrO42-+2H+=Cr2O72-+H2O 3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是________________。
②混合溶液乙中溶质的化学式为______________________。
(5)写出Fe与混合溶液丙反应的主要离子方程式_________________。检验溶液丁中无Fe3+的方法是:_____________。从溶液丁到绿巩的实验操作为蒸发浓缩、___________、过滤、洗涤、干燥。
【答案】 (1). +2 价 (2). FeO·Cr2O3 (3). 4:7 (4). 粉碎矿石(或升高温度) (5). H2SO4量少时不能除尽Na2CO3杂质,H2SO4量多时又会生成新的杂质(Cr3O10-2),所以H2SO4必须适量 (6). Na2Cr2O7、Na2SO4 (7). Fe+2Fe3+=3Fe2+ (8). 取少量丁溶液于试管中,向其中加入KSCN溶液,不显红色则说明丁溶液中不含Fe3+ (9). 冷却结晶
【解析】
铬铁矿中加入碳酸钠并通入氧气,高温下将Fe(CrO2)2氧化得到Fe2O3、Na2CrO4,同时生成CO2,将得到的固体溶于水得到Na2CrO4溶液,然后过滤,得到得到Na2CrO4和过量的碳酸钠混合溶液和氧化铁固体,在Na2CrO4和碳酸钠混合溶液中加入硫酸酸化,硫酸和Na2CrO4反应生成Na2Cr2O7和硫酸钠,同时除去碳酸钠,通过蒸发浓缩冷却结晶,得到红矾钠(Na2Cr2O7·2H2O);氧化铁与硫酸反应生成硫酸铁,加入铁粉将硫酸铁还原生成硫酸亚铁,最后蒸发浓缩冷却结晶,得到绿矾。
(1) Fe(CrO2)2中铬元素的化合价为+3价,根据正负化合价的代数和为0,Fe(CrO2)中铁元素的化合价为+2价,故答案为+2 价;
(2) Fe(CrO2)2中铬元素的化合价为+3价,铁元素的化合价为+2价,可写成FeO·Cr2O3
,故答案为FeO·Cr2O3;
(3)①高温氧化时,Fe(CrO2)2和碳酸钠、氧气反应氧化还原反应生成Na2CrO4、二氧化碳和氧化铁,该反应中Fe元素化合价由+2价变为+3价、Cr元素化合价由+3价变为+6价,O元素化合价由0价变为-2价,所以氧气是氧化剂、Fe(CrO2)2是还原剂,则还原剂和氧化剂的物质的量之比为4:7,故答案为4:7;
②根据影响化学反应速率的外界因素,为了加快该反应的反应速率,可采取的措施有粉碎矿石、升高温度等,故答案为粉碎矿石(或升高温度);
⑷①H2SO4量少时不能除尽Na2CO3杂质,H2SO4量多时又会生成新的杂质(Cr3O102-),所以H2SO4必须适量,故答案为H2SO4量少时不能除尽Na2CO3杂质,H2SO4量多时又会生成新的杂质(Cr3O102-),所以H2SO4必须适量;
②根据上述分析,混合溶液乙中的溶质有Na2Cr2O7、Na2SO4,故答案为Na2Cr2O7、Na2SO4;
(5)Fe与硫酸铁溶液反应的离子方程式为Fe+2Fe3+=3Fe2+。检验溶液丁中无Fe3+的方法为:取少量丁溶液于试管中,向其中加入KSCN溶液,不显红色则说明丁溶液中不含Fe3+;从硫酸亚铁溶液到绿巩的实验操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为取少量丁溶液于试管中,向其中加入KSCN溶液,不显红色则说明丁溶液中不含Fe3+ ;冷却结晶。
点睛:本题考查物质的制备、分离和提纯,为高频考点,涉及氧化还原反应、基本实验操作等知识,明确物质的性质、熟悉制备流程和基本实验操作等是解题的关键。本题的难点是(4)①硫酸必须适量的原因,需要理解题目信息方程式中的计量数对反应的影响。
10.氢能是一种极具发展潜力的清洁能源,以太阳能为热能,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
(1)反应I的化学方程式是________。
(2)反应I得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层,含低浓度I2的H2SO4层和含高浓度I2的HI层。
①根据上述事实,下列说法正确的是________(选填序号)。
a 两层溶液的密度存在差异
b 加I2前,H2SO4溶液和HI溶液不互溶
c I2在HI溶液中比在H2SO4溶液中易溶
② 辨别两层溶液的方法是____________。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因______。
(3)反应II : 2H2SO4(l)=2SO2(g) +O2(g) +2H2O(g) △H=+550 kJ • mol-1
它由两步反应组成:
i.H2SO4(l)=SO3(g) +H2O(g) △H =+177 kJ • mol-1
ii.SO3(g)分解。
L(L1, L2)和X可分别代表压强或温度,下图表示L一定时,ⅱ中SO3(g)的平衡转化率随X的变化关系。
①写出反应iiSO3(g)分解的热化学方程式:________。
②X代表的物理量是_______。
【答案】 (1). SO2+I2+2H2O=H2SO4+2HI (2). ac (3). 观察颜色,颜色深的是HI层,颜色浅的是H2SO4层 (4). H2SO4层含有少量HI (5). 2SO3(g)2SO2(g)+O2(g) △H= +196 kJ•mol-1 (6). 压强
【解析】
【详解】(1)反应I为二氧化硫与碘发生氧化还原反应生成硫酸和HI,反应为SO2+2H2O+I2=H2SO4+2HI,
故答案为:SO2+2H2O+I2=H2SO4+2HI;
(2)①a.两层溶液的密度存在差,才出现上下层,故a正确;
b.加I2前,H2SO4溶液和HI溶液互溶,与分层无关,故b错误;
c.I2在HI溶液中比在H2SO4溶液中易溶,则碘在不同溶剂中溶解性不同,类似萃取,与分层有关,故c正确;
故答案为:ac;
② 辨别两层溶液的方法是:观察颜色,颜色深的为HI层,颜色浅的为硫酸层,故答案为:观察颜色,颜色深的为HI层,颜色浅的为硫酸层;
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因硫酸层中含少量的HI,且HI电离出氢离子,故答案为:硫酸层中含少量的HI,且HI电离出氢离子;
(3)根据盖斯定律:反应II=i×2+ii,ii=II-i×2,得ii的△H=+550 kJ·mol-1-(+177 kJ·mol-1)×2= +196 kJ·mol-1,反应iiSO3(g)分解的热化学方程式:2SO3(g)2SO2(g)+O2(g) △H= +196 kJ·mol-1 ,故答案为:2SO3(g)2SO2(g)+O2(g) △H= +196 kJ·mol-1;
由图可知,X越大,转化率越低,升高温度转化率增大,则X表示压强,故答案为:压强。
【点睛】本题考查混合物分离提纯及化学平衡等,把握发生的反应、平衡影响因素为解答的关键,侧重分析与应用能力的综合考查,难点(3)先要由盖斯定律求出三氧化硫分解的热化学反应方程式,再根据反应吸热的特点分析图象。
【化学-选修3:物质结构与性质】
11.A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型: C、D为同周期元素,C核外电子总数是最外层层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___________(填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是____________(填分子式);A和B的氢化物所属的晶体类型分别为___________和___________。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为____________,中心原子的杂化轨道类型为________________。
(4)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为______________。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为________;晶胞中A原子的配位数为____________;列式计算晶体F的密度(g • cm-3 )__________。
【答案】 (1). O (2). ls22s22p63s23p3(或[Ne]3s23p3) (3). O3 (4). 分子晶体 (5). 离子晶体 (6). 三角锥形 (7). sp3 (8). 2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3=Cl2O+CO2+2NaCl) (9). Na2O (10). 8 (11). 2.27 g/cm3
【解析】
分析】
A、B、C、D为原子序数依次增大的四种元索,C核外电子总数是最外层电子数的3倍,则C为P元素,C、D为同周期元索,D元素最外层有一个未成对电子,则D为Cl元素,A2-和B+具有相同的电子构型,则A为O、B为Na元素;通过以上分析,A、B、C、D分别是O、Na、P、Cl元素。
【详解】(1)元素的非金属性越强,其电负性越大,这几种元素非金属性最强的是O元素,则电负性最大的是O元素;C是P元素,其原子核外有15个电子,根据构造原理书写P原子核外电子排布式为ls22s22p63s23p3(或[Ne]3s23p3);故答案为:O;ls22s22p63s23p3(或[Ne]3s23p3);
(2)单质A为氧气,氧气的同素异形体是臭氧,二者都是分子晶体,分子晶体熔沸点与范德华力成正比,范德华力与相对分子质量成正比,臭氧的相对分子质量大于氧气,则范德华力:臭氧>氧气,所以熔沸点较高的是O3;A和B的氢化物所属的晶体类型分别为水是分子晶体和NaH为离子晶体。故答案为:O3;分子晶体;离子晶体;
(3)C和D反应可生成组成比为1:3的化合物PCl3,PCl3中P原子价层电子对个数=3+=4且含1个孤电子对,根据价层电子对互斥理论判断该分子的立体构型为三角锥形、中心原子的杂化轨道类型为sp3,故答案为:三角锥形;sp3;
(4)单质Cl2与湿润的Na2CO3反应可制备Cl2O,其化学方程式为2Cl2+2Na2CO3+H2O= Cl2O+2NaHCO3+2NaCl (或2Cl2+Na2CO3=Cl2O+CO2+2NaCl)。故答案为:2Cl2+2Na2CO3+H2O= Cl2O+2NaHCO3+2NaCl (或2Cl2+Na2CO3=Cl2O+CO2+2NaCl);
(5)O和Na能够形成化合物F,半径大的为O元素离子、半径小的为Na+,该晶胞中大球个数=8×+6×=4、小球个数为8,则大球、小球个数之比=4:8=1:2,则化学式为Na2O;观察晶胞中面心的原子,与之相连的原子有8个,晶胞中O原子的配位数为8;该晶胞体积=a3nm3,晶胞密度= =g·cm-3=2.27g·cm-3;故答案为:Na2O;
2.27g·cm-3。
【点睛】本题考查物质结构和性质,涉及晶胞计算、原子杂化方式判断、微粒空间构型判断、原子核外电子排布等知识点,侧重考查基础知识点的灵活运用、空间想像能力及计算能力,难点是晶胞计算,利用均摊法求出晶胞中原子的个数,结合密度公式含义计算。
【化学一选修5:有机化学基础】
12.由化合物A合成黄樟油(E)和香料F的路线如下(部分反应条件己略去):
请回答下列问题:
(1)下列有关说法正确的是______________(填选项字母)。
a 化合物A核磁共振氢谱为两组峰
b CH2Br2只有一种结构
c 化合物E能发生加聚反应得到线型高分子
d 化合物B能发生银镜反应,也能与NaOH溶液反应
(2)由B转化为D所需的试剂为________________。
(3) D含有的官能团名称为________________。
(4)写出A→B的化学反应方程式:_______________。
(5)满足下列条件的E的同分异构体W有__________种(不含立体异构),其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为_________。
①1molW与足量NaOH溶液反应,能消耗2molNaOH
②能发生银镜反应
③苯环上只有两个取代基,能发生聚合反应
【答案】 (1). bc (2). 液溴、Fe (或液溴、FeBr3) (3). 醚键、溴原子、1-溴丙烯 (4). (5). 9 (6).
【解析】
【分析】
根据A、B的分子式、D的结构简式,可知A为,B为,结合物质的结构简式、转化关系图以及问题分析解答。
【详解】(1)A为,B为。
a.化合物A 有3种化学环境不同的H原子,核磁共振氢谱为3组峰,故a错误;
b.CH2Br2是空间四面体结构,CH2Br2只有一种结构,故b正确;
c.化合物E含有碳碳双键,能发生加聚反应得到线型高分子,故c正确;
d.化合物B没有醛基,不能发生银镜反应,故d错误。
故选bc;
(2)对比B、D结构,由B转化为D发生苯环的溴代反应,所需试剂为:液溴、Fe(或液溴、FeBr3),故答案为:液溴、Fe(或液溴、FeBr3);
(3)D中含有-Br、,官能团名称为溴原子、醚键,C的同分异构体中具有顺反异构,该同分异构体为CH3CH=CHBr,该同分异构体名称为:1-溴丙烯,故答案为:溴原子、醚键;1-溴丙烯;
(4)A→B是与CH2Br2发生取代反应生成,同时还生成的HBr会与氢氧化钠发生中和反应,反应方程式为:,故答案为:;
(5)①lmolW与足量NaOH溶液反应,能消耗2molNaOH,说明含有羧酸与酚形成的酯基;②能发生银镜反应,应是甲酸与酚形成的酯,③能发生聚合反应,还含有碳碳双键,且苯环上只有两个取代基,其中一个为-OOCH,另外一个为-CH2CH=CH2、或者-CH=CHCH2、或者-CH(CH3)=CH2,2个取代基有邻、间、对3种,故符合条件的共有9
种,其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为:,故答案为:9;。
【点睛】本题考查有机物的推断与合成,涉及官能团的结构与性质、限制条件同分异构体书写、有机反应方程式书写等,注意从题目关系图中有机物结构理解有关反应,并在(5)中进行迁移运用。