- 1.60 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高三年级联合考试
理科综合化学
考生注意:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共300分。考试时间150分钟。
2.请将各题答案填写在答题卡上.
3.可能用到的相汁原子质量:H1 C12 N14 O16 Na23 Mg24 S32 Cl35.5
Fe56 Cu64 Ba137
第I卷(选择题 共126分)
一、选择题:本题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.2019年6月5日世界环境日主题是“蓝天保卫战,我是行动者”。下列措施不符合这一主题的是
A.大力倡导绿色出行 B.推广使用清洁能源
C.烟气进行脱硫脱硝处理 D.冬季取暖以煤代电
8.检验反应C+2H2SO4(浓)CO2↑+2SO2↑+2H2O产生的气体中同时含CO2和SO2,下列不需要用到的装置是
9.设NA为阿伏加德罗常数的值。下列说法正确的是
A.2.24L(标准状况)Br2含有的溴分子数为0.1NA
B.2.8g由NaHCO3和MgCO3组成的混合物中含有的氧原子数为0.1NA
C.0.1mol FeCl3·6H2O加入沸水中生成胶体的粒子数为0.1NA
D.3.2 g Cu与20mL 10mol·L-1浓硝酸充分反应生成NO2的分子数为0.1NA
10.柠檬醛、香叶醇、芳樟醇都是食品香料和医药原料,三者之间存在如下转化关系。下列说法不正确的是
A.三种有机物都能使溴水,酸性高锰酸钾溶液褪色
B.三种有机物的分子中所有原子均不可能处于同一平面
C.香叶醇与芳樟醇互为同分异构体,均能与NaHCO2溶液反应
D.柠檬醛发生取代、加成、氧化、还原、加聚等反应
11.电化学腐蚀及防护的研究装置如图所示,下列有关说法不正确的是
A.若a、b用导线相连,铁片主要发生吸氧腐蚀
B.若a、b用导线相连,c处比d处更易生成铁锈
C.若a、b用导线相连,石墨电极上有气泡产生
D.若a、b分别连接电源的正、负极,将加快铁片的腐蚀
12.W、X、Y、Z是原子序数依次增大的短周期主族元素,四种元素原子的最外层电子数之和为16。W、Z位于同一主族,Z的核电荷效是W的2倍;含元素Y的合金是日常生活中使用最广泛的金属材料之一。下列说法不正确的是
A.简单离子半径的大小顺序:X>Y>Z>W
B.工业上采用电解熔融Y2W3的方法来制取单质Y
C.X与Z、X与W形成的化合物均为离子化合物
D.X、Y、Z的最高价氧化物对应的水化物两两间均能发生反应
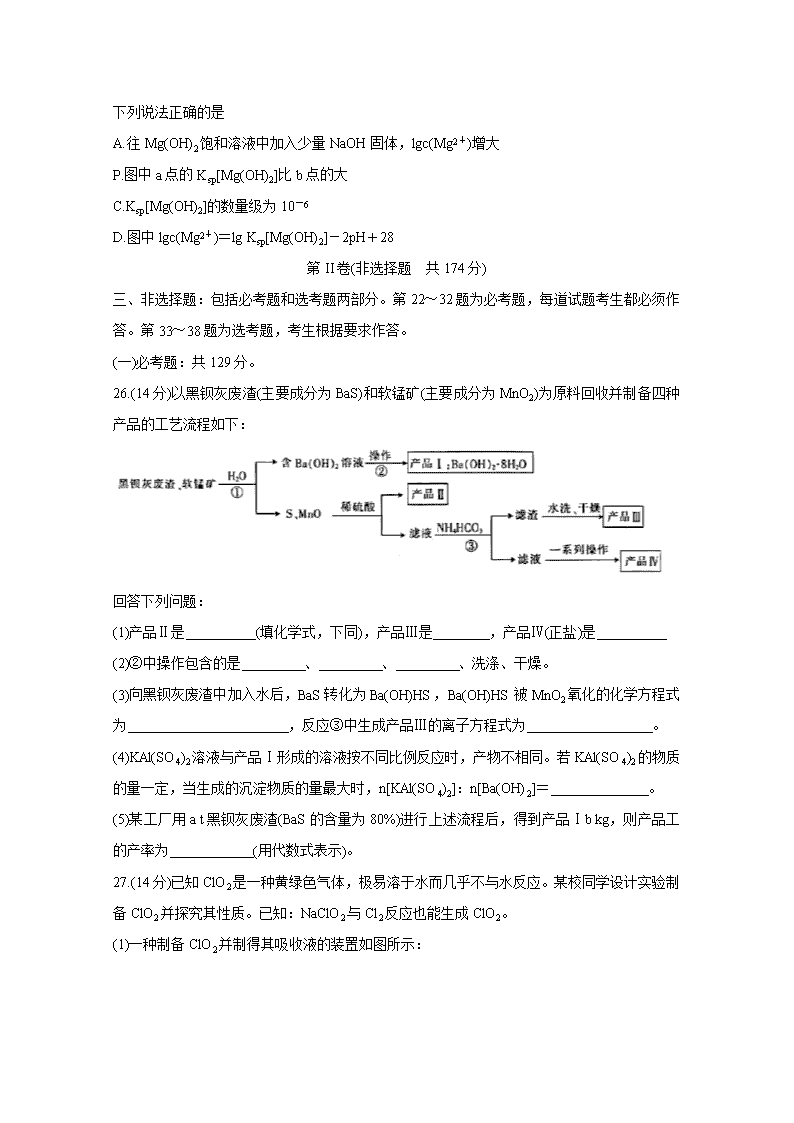
13.25℃时,Mg(OH)2饱和溶液中Mg2+浓度的对数值[lgc(Mg2+)]与溶液pH的关系如图所示:
下列说法正确的是
A.往Mg(OH)2饱和溶液中加入少量NaOH固体,lgc(Mg2+)增大
P.图中a点的Ksp[Mg(OH)2]比b点的大
C.Ksp[Mg(OH)2]的数量级为10-6
D.图中lgc(Mg2+)=lg Ksp[Mg(OH)2]-2pH+28
第II卷(非选择题 共174分)
三、非选择题:包括必考题和选考题两部分。第22~32题为必考题,每道试题考生都必须作答。第33~38题为选考题,考生根据要求作答。
(一)必考题:共129分。
26.(14分)以黑钡灰废渣(主要成分为BaS)和软锰矿(主要成分为MnO2)为原料回收并制备四种产品的工艺流程如下:
回答下列问题:
(1)产品Ⅱ是 (填化学式,下同),产品Ⅲ是 ,产品Ⅳ(正盐)是
(2)②中操作包含的是 、 、 、洗涤、干燥。
(3)向黑钡灰废渣中加入水后,BaS转化为Ba(OH)HS,Ba(OH)HS被MnO2氧化的化学方程式为 ,反应③中生成产品Ⅲ的离子方程式为 。
(4)KAl(SO4)2溶液与产品Ⅰ形成的溶液按不同比例反应时,产物不相同。若KAl(SO4)2的物质的量一定,当生成的沉淀物质的量最大时,n[KAl(SO4)2]:n[Ba(OH)2]= 。
(5)某工厂用a t黑钡灰废渣(BaS的含量为80%)进行上述流程后,得到产品Ⅰb kg,则产品工的产率为 (用代数式表示)。
27.(14分)已知ClO2是一种黄绿色气体,极易溶于水而几乎不与水反应。某校同学设计实验制备ClO2并探究其性质。已知:NaClO2与Cl2反应也能生成ClO2。
(1)一种制备ClO2并制得其吸收液的装置如图所示:
①装置A中发生的主要反应的化学方程式为 (该反应生成的ClO2与Cl2的物质的量之比为2:1)。
②装置B的作用是 ;装置C中可观察到的现象是 ;装置D的作用是 。
③实验过程中不断缓慢通入N2的目的是 。
(2)探究ClO2的性质(ClO2作氧化剂时,被还原为Cl-)
①取少量ClO2的水溶液,向其中滴入MnSO4溶液,有黑色沉淀产生,该反应中氧化剂与还原剂的物质的量之比为
②向ClO2吸收液中滴入Na2S溶液,溶液立刻褪色,该反应的离子方程式为 (S2-转化为SO42-)。
③ClO2是一种水的新型消毒剂,相同质量的ClO2的消毒能力是Cl2的 倍(精确到0.1)。
28.(15分)二硫化碳可用于生产化学纤维、玻璃纸及制备四氯化碳等。回答下列问题:
(1)CS2的电子式为 。
(2)甲烷或二氯甲烷分别与硫磺反应可制取CS2:
天然气法:CH4(g)+4S(g)=CS2(g)+2H2S(g) △H1
二氯甲烷法:CH2Cl2(g)+2S(g)=CS2(g)+2HCl(g) △H2
CH4(g)+2S(g)+2HCl(g)=CH4Cl2(g)+2H2S(g) △H3
则△H1= (用△H2和△H3表示),天然气法比二氯甲烷法更具优势,其主要原因是
(列举1点)。
(3)一种用硫化氢代替硫磺制取CS2的反应为CH4(g)+2H2S(g)CS2(g)+4H2(g) △H。向一体积为20L的恒容密闭容器中充入1mol CH4和2 mol H2S,平衡时各物质的物质的量的关系如图所示:
①该制备反应的△H (填“>”或“<”)0;曲线c表示的物质是 (填化学式)。
②X点CH4的转化率为 。
③850℃时,反应的平衡常数K= ,若维持此时温度不变,再向容器中充入CH4、H2S、CS2、H2各1mol,则v(正) (填“>”“<”或“=”)v(逆)。
④为提高H2S的平衡转化率,除改变温度外,还可采取的措施是 (列举2点)。
(二)选考题:共45分。请考生从给出的2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多答,则每科按所答的第一题计分。
35.[化学——物质结构与性质](15分)
三硝酸六尿素合铁(Ⅲ){ ([Fe(H2NCONH2)6](NC3)3}是一种有机铁肥。
(1)基态铁原子的核外价电子排布式为 。
(2)三硝酸六尿素合铁(Ⅲ)所含的非金属元素中,电负性最大的是 (填元素符号,下同),第一电离能最大的是
(3)尿素分子中C、N原子的杂化方式分别是 、 。
(4)与NH3分子互为等电子体的一种阳离子为 。
(5)NH3的沸点比N2O的沸点 (填“高”或“低”),其主要原因是 。
(6)元素N、Fe可形成某晶体,其晶胞结构如图所示,则该晶体的化学式为 。若晶胞参数为a nm,阿伏加德罗常数为NA,晶体的密度为 (写出表达式即可)g·cm-3。
36.[化学——有机化学基础](15分)
以芳香烃A为原料合成药物H的一种合成路线如下:
回答下列问题:
(1)A的化学名称是 ,H中含氧官能团的名称是 。
(2)C、E的结构简式依次为 、 。
(3)F与足量NaOH溶液在加热条件下反应的化学方程式为 。
(4)X是D的同分异构体,X能发生银镜反应,能与FeCl3溶液发生显色反应。符合条件的X有 种,其中核磁共振氢谱显示分子中有5种不同化学环境的氢,且峰面积之比为1:2:2:2:1的X的结构简式为 。
(5)写出以乙二醇为原料制备聚合物的合成路线(无机试剂任用)。
答案