- 825.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学工艺流程
1、磷酸二氢钾(KH2PO4)是一种高效复合肥。工业上以羟磷灰石精矿[主要成分是Ca5(PO4)3OH,还含有少量石英和氧化铁等杂质]为原料,生产磷酸二氢钾的流程如下:
⑴“制酸”过程中生成磷酸的化学方程式为__________________。该过程若用硫酸代替盐酸,磷酸的产率明显降低,其原因是___________________________________。
⑵“反应”中加入有机碱——三辛胺(TOA)的目的是____________________________________________。
⑶“反应”中,三辛胺的用量会影响溶液的pH。水溶液中H3PO4、、、的分布分数δ随pH的变化如图所示。
①“反应”中,当pH=__________时,停止加入三辛胺。
②使用pH试纸测定溶液pH的操作是__________。
⑷查阅资料可知:①磷酸三丁酯、二(2乙基己基)磷酸都是难溶于水的液态有机物。
②磷酸三丁酯对H3PO4和Fe3+有较强的萃取作用。
③二(2乙基己基)磷酸仅对Fe3+有较强的萃取作用。
请根据题中信息,补充完整“提纯”步骤的实验方案:向“制酸”所得粗磷酸中加入活性炭,_______________________________________________________________,向有机层中加入蒸馏水,振荡、静置,分液取水层,得到稀磷酸。[实验中须使用的试剂有:二(2乙基己基)磷酸、磷酸三丁酯]
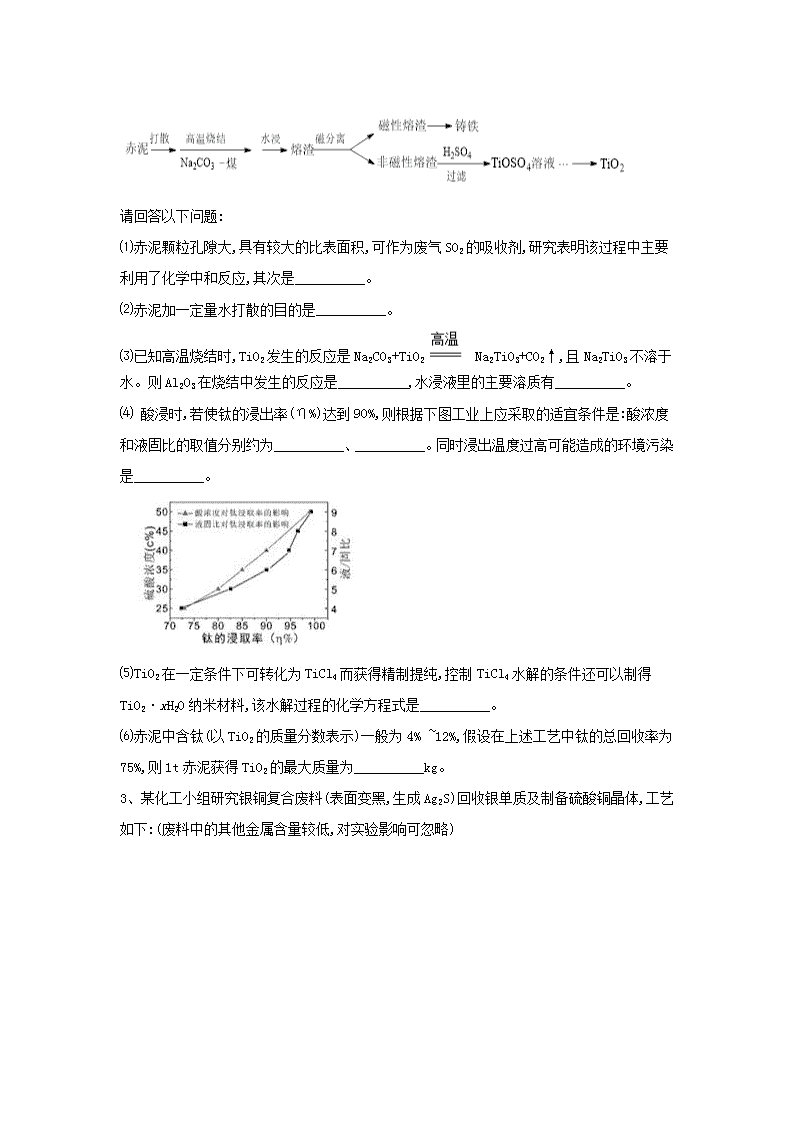
2、赤泥是铝土矿提取氧化铝过程中产生的固体废弃物,其主要成分为Fe2O3、Al2O3、CaO、TiO2、SiO2等,属于强碱性废渣。从赤泥中回收钛的工艺流程如下:
请回答以下问题:
⑴赤泥颗粒孔隙大,具有较大的比表面积,可作为废气SO2的吸收剂,研究表明该过程中主要利用了化学中和反应,其次是__________。
⑵赤泥加一定量水打散的目的是__________。
⑶已知高温烧结时,TiO2发生的反应是Na2CO3+TiO2 Na2TiO3+CO2↑,且Na2TiO3不溶于水。则Al2O3在烧结中发生的反应是__________,水浸液里的主要溶质有__________。
⑷ 酸浸时,若使钛的浸出率(η%)达到90%,则根据下图工业上应采取的适宜条件是:酸浓度和液固比的取值分别约为__________、__________。同时浸出温度过高可能造成的环境污染是__________。
⑸TiO2在一定条件下可转化为TiCl4而获得精制提纯,控制TiCl4水解的条件还可以制得TiO2·xH2O纳米材料,该水解过程的化学方程式是__________。
⑹赤泥中含钛(以TiO2的质量分数表示)一般为4% ~12%,假设在上述工艺中钛的总回收率为75%,则1t赤泥获得TiO2的最大质量为__________kg。
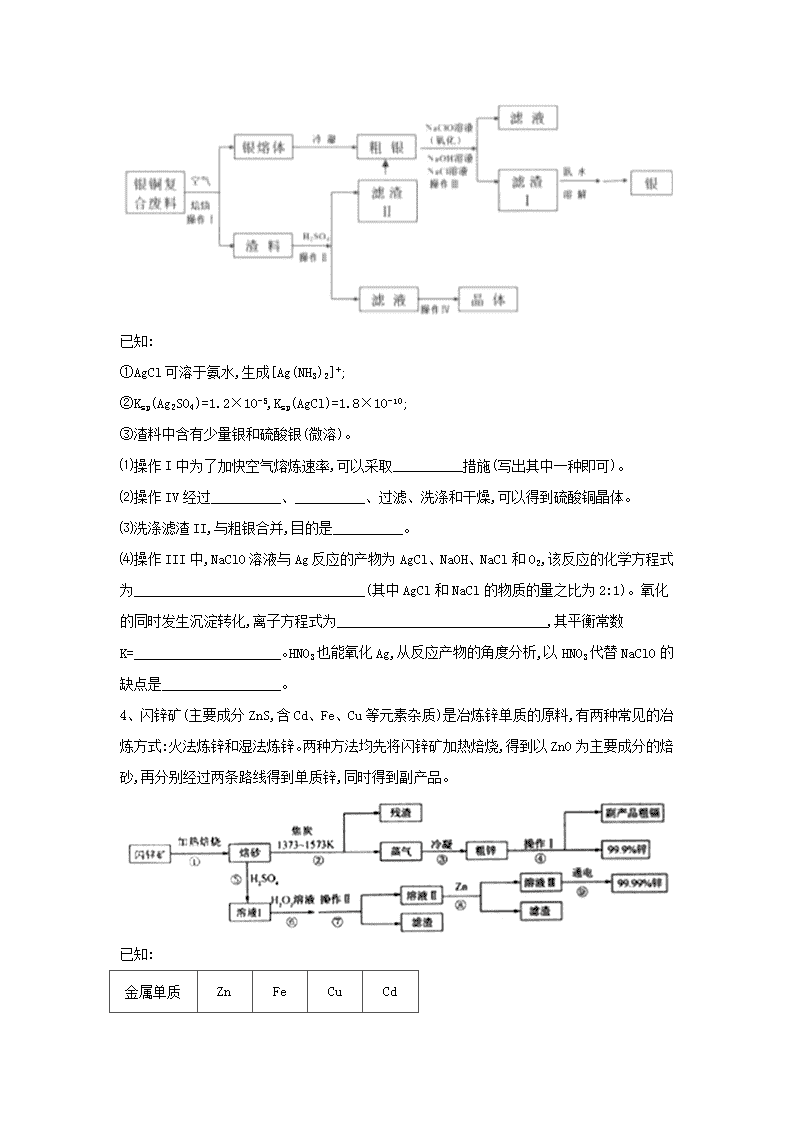
3、某化工小组研究银铜复合废料(表面变黑,生成Ag2S)回收银单质及制备硫酸铜晶体,工艺如下:(废料中的其他金属含量较低,对实验影响可忽略)
已知:
①AgCl可溶于氨水,生成[Ag(NH3)2]+;
②Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10;
③渣料中含有少量银和硫酸银(微溶)。
⑴操作I中为了加快空气熔炼速率,可以采取__________措施(写出其中一种即可)。
⑵操作IV经过__________、__________、过滤、洗涤和干燥,可以得到硫酸铜晶体。
⑶洗涤滤渣II,与粗银合并,目的是__________。
⑷操作III中,NaClO溶液与Ag反应的产物为AgCl、NaOH、NaCl和O2,该反应的化学方程式为_________________________________(其中AgCl和NaCl的物质的量之比为2:1)。氧化的同时发生沉淀转化,离子方程式为______________________________,其平衡常数K=_____________________。HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是_________________。
4、闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
已知:
金属单质
Zn
Fe
Cu
Cd
熔点(K)
693
1812
1356
594
沸点(K)
1180
3023
2840
1040
相关金属单质的熔沸点
开始沉淀pH
完全沉淀pH
Fe3+
1.1
3.2
Zn2+
5.9
8.9
Cu2+
4.7
6.7
Cd2+
6.9
9.6
几种离子生成氢氧化物沉淀的pH
⑴写出步骤①发生的主要反应的化学方程式___________________________。
⑵步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收a kJ的热量,请写出该反应的热化学方程式______________________________________。
⑶步骤④中操作Ⅰ的分离方法为__________,得到副产品粗镉需控制温度为__________左右。
⑷步骤⑦需调节溶液pH 为________,目的是__________________________________。
⑸步骤⑨以Pt为阳极、Al为阴极进行电解的化学方程式为______________________。
⑹分别取闪锌矿200kg,通过火法炼锌得到Zn 的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为__________
5、实验室回收利用废旧锂离子电池正极材料锰酸锂LiMn2O4的一种流程如下:
⑴废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是__________。
⑵“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为Mn ( NO3)2、LiNO3等产物。请写出该反应离子方程式:_________________________________。
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是____________________。
⑶“过滤2”时,洗涤Li2CO3沉淀的操作是__________。
⑷把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是______________________。
⑸制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入______________________________________________________________。
⑹味精厂、化肥厂、垃圾渗滤液等排放的废水中往往含有高浓度的氨氮,若不经处理直接排放会对水体造成严重的污染。电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用。对某养猪场废水进行电化学氧化处理,选用IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为85mA·cm-2下电解,180min内去除率达到98.22%。阳极发生的电极反应式是______________________;HClO氧化除去氨氮的反应离子方程式是__________________________。
6、高铁酸钾(K2FeO4)是新型多功能水处理剂。其生产工艺如下:
回答下列问题:
⑴反应①应在温度较低的情况下进行,因温度较高时NaOH与Cl2反应生成NaClO3,写出温度较高时反应的离子方程式__________。
⑵在溶液I中加入NaOH固体的目的是__________(填字母)。
A.与反应液I中过量的Cl2继续反应,生成更多的NaClO
B.NaOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使NaClO3转化为NaClO
⑶ 反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图1为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4的生成率的影响。
工业生产中最佳温度为__________,此时Fe(NO3)3与NaClO两种溶液的最佳质量浓度之比为__________。
⑷反应③中的离子反应方程式为__________;溶液Ⅱ中加入饱和KOH得到湿产品的原因是__________。
⑸高铁酸钾作为水处理剂是能与水反应其离子反应是:4+10H2O=4Fe(OH)3(胶体)十3O2↑+8OH-。则其作为水处理剂的原理是:①__________;②__________。
7、NaH2PO2(次磷酸钠)易溶于水,水溶液近中性,具有强还原性,可用于化学镀银、镍、铬等。一种利用泥磷(含P4和少量CaO、Fe2O3、Al2O3、CaCl2等)为原料制备NaH2PO2·H2O的工艺流程如下:
已知P4与两种碱的反应主要有:
Ⅰ. 2Ca(OH)2+P4+4H2O=2Ca(H2PO2)2+2H2↑
Ⅱ. 4NaOH+P4+8H2O=4NaH2PO2·H2O+2H2↑
Ⅲ. 4NaOH+P4+2H2O=2Na2HPO3+2PH3↑
Ⅳ. NaH2PO2+NaOH=Na2HPO3+H2↑
⑴尾气中的PH3被NaClO溶液吸收生成NaH2PO2和NaCl的离子方程式为________________________________
⑵ “反应”阶段,在温度和水量一定时,混合碱总物质的量与P4的物质的量之比[n(碱)/n(磷)]与NaH2PO2产率的关系如图所示。当n(碱)/n(磷)>2.6时,NaH2PO2的产率随n(碱)/n(磷)的增大而降低的可能原因是__________________________________________。
⑶常温下通CO2“调pH”应至溶液的pH约为________,滤渣2主要成分为____________(填化学式)。
⑷“过滤2”的滤液须用Ag2SO4、Ba(OH)2及Na2S溶液除去其中Cl-及Fe2+等,其中加入的Ag2SO4溶液不宜过量太多,其主要原因_________________________________。
⑸用NiCl2与NaH2PO2溶液化学镀Ni,同时生成H3PO4和氯化物的化学方程式为_______________________________。
8、NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如下:
流程中相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物
Fe(OH)3
Fe(OH)2
Ni(OH)2
开始沉淀的pH
1.1
6.5
7.1
沉淀完全的pH
3.2
9.7
9.2
⑴为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③__________等
⑵加入H2O2时发生主要反应的离子方程式为________________。
⑶“除铁”时,控制溶液pH的范围为__________。
⑷滤渣B的主要成分的化学式为______________。
⑸已知:Ksp(NiCO3)=1.42×10-7。为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c()>__________mol·L-1。
6.“氧化”生成Ni2O3的离子方程式为________________________________。
9、NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
请回答下列问题:
⑴用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有__________(任写一点)。
⑵向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式:__________________________。
⑶在40℃左右,用6%的H2O2氧化Fe2+,再在95℃时加入NaOH调节pH,除去铁和铬。此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。如图是温度一pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是(选填序号)__________。
a. FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.6×10-29mol·L-1
c.用氯酸钠在酸性条件下氧化Fe2+的离子方程式为6Fe2+++6H+=6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95℃生成黄铁钒钠,此时水体的pH约为3
⑷上述流程中滤液I的主要成分是___________。
⑸操作I的实验步骤依次为(实验中可选用的试剂:6mol·L-1的H2SO4溶液、蒸馏水、pH试纸):
①__________________________________;
②__________________________________;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体;
④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。
10、钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示
⑴滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为__________。
⑵物质A为__________(填化学式),“一系列操作”为__________。
⑶“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有__________、__________。(写出两条)。
⑷“电解”是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。阴极的电极反应式为__________;若制得金属Ti 9.60g,阳极产生气体__________mL(标准状况下)。
⑸将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式__________;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c()=__________mol·L-1。(已知:常温下FeCO3饱和溶液浓度为4.5×10-6mol·L-1)
11、硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4•7H2O的一种流程如图:
⑴步骤Ⅰ的操作是__________。
⑵步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是__________。
⑶步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为______________________。
⑷步骤Ⅲ中,加入锌粉的作用是______________。
⑸已知硫酸锌的溶解度与温度之间的关系如下表:
温度/℃
0
20
40
60
80
100
溶解度/g
41.8
54.1
70.4
74.8
67.2
60.5
从硫酸锌溶液中获得硫酸锌晶体的实验操作为________________、冷却结晶、过滤。烘干操作需在减压低温条件下进行,原因是__________________________。
⑹取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示。分析数据,680℃时所得固体的化学式为__________
a.ZnO
b.Zn3O(SO4)2
c.ZnSO4
d.ZnSO4•H2O
12、钨是熔点最高的金属,是重要的战略物资.自然界中钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物.由黑钨矿冶炼钨的工艺流程如图:
已知:①滤渣I的主要成份是Fe2O3、MnO2。
②上述流程中,除最后一步外,其余步骤钨的化合价未变。
③常温下钨酸难溶于水。
回答下列问题:
⑴钨酸盐(FeWO4、MnWO4)中钨元素的化合价为________,请写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式______________________________________。
⑵上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为、、、等,则“净化”过程中,加入H2O2时发生反应的离子方程式为___________________________,滤渣Ⅱ的主要成分是___________________。
⑶已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则T1时Ksp(CaWO4)=__________mol2•L﹣2.将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为________________________________,T2时该反应的平衡常数为___________mol•L﹣1
⑷硬质合金刀具中含碳化钨(WC),利用电解法可以从碳化钨废料中回收钨.电解时,用碳化钨做阳极,不锈钢做阴极,HCl溶液为电解液,阳极析出钨酸并放出CO2.该阳极反应式为________________________________。
13、一种从铝锂钴废料[含铝箔、CoO和Co2O3(只溶于酸,不溶于碱)及LiCoO2]中回收氧化钴的工艺流程如下:
回答下列问题:
⑴步骤Ⅰ“碱溶”时,为提高铝的去除率,除升高温度和不断搅拌外,还可采取的措施是__________(列举一点),“碱溶”时发生主要反应的化学方程式为__________;步骤Ⅱ“过滤、洗涤”过程中滤渣还会有少量的Al(OH)3,是因为__________(填离子方程式)。
⑵步骤Ⅲ“酸溶”时,Co2O3转化为CoSO4的离子方程式为__________。
⑶步骤Ⅴ“除铝和锂”时,调节pH的适用范围是__________(已知该条件下,Al3+开始沉淀时的PH为4.1,沉淀完全时的pH为4.7,Co2+开始沉淀时的pH为6.9,沉淀完全时的pH为9.4);步骤Ⅳ所得滤渣的成分为__________。
⑷煅烧CoC2O4时发生氧化还原反应,则CoC2O4分解的化学方程式是__________;若仅从沉淀转化角度考虑,能否利用反应将CoCO3转化为CoC2O4?(填“能”或“不能”),说明理由:__________[已知Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8]
答案以及解析
1答案及解析:
答案:⑴Ca5(PO4)3OH+10HCl=5CaCl2+3H3PO4+H2O;使用H2SO4,会产生微溶性的CaSO4覆盖在羟磷灰石的表面,阻止反应的继续进行
⑵加入三辛胺会与溶液中的HCl反应,促进了KH2PO4生成
⑶4.5; 用洁净的玻璃棒蘸取溶液滴在pH试纸上,立即与标准比色卡对比,读取pH
⑷过滤,向滤液中加入适量二(2乙基己基)磷酸,振荡、静置,分液取水层;在水层中加入适量磷酸三丁酯,振荡,静置,分液取有机层
2答案及解析:
答案:⑴物理吸附;⑵增大赤泥的接触面积,且打散后便于搅拌; ⑶Na2CO3+Al2O32NaAlO2+CO2↑ Na2SiO3、NaAlO2
⑷40%; 6; 会形成大量的酸雾;⑸TiCl4+(x+2) H2O TiO2·xH2O↓+4HCl
⑹90
3答案及解析:
答案:⑴粉碎废料、适当增加空气量、搅拌等; ⑵加热浓缩; 降温结晶;⑶为提高Ag的回收率;⑷3NaClO+2Ag+H2O=2AgCl+NaCl+2NaOH+O2↑;Ag2SO4(s)+2Cl-(aq) 2AgCl(s)+ (aq);3.7×1014;有污染性气体生成
4答案及解析:
答案:⑴2ZnS+3O2=2ZnO+2SO2
⑵ZnO(s)+C(s)=Zn(g)+CO(g) ΔH=+a kJ/mol
⑶蒸馏; 1040K;⑷3.2≤pH<5.9;除去溶液中的Fe3+
⑸2ZnSO4+2H2O = 2Zn+O2↑+2H2SO4
⑹48.5%
5答案及解析:
答案:⑴隔绝空气和水分;⑵2LiMn2O4+10H++3H2O2=2Li++4Mn2++3O2↑+8H2O;反应生成Cl2,污染环境
⑶沿着玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流出,重复操作2~3次
⑷MnO2作为催化剂,降低了碳酸锂的分解温度
⑸H2SO4溶液,固体溶解,加入Na2CO3,并控制溶液pH<7.7,过滤,用少量的乙醇洗涤,在低于100℃条件下真空干燥
⑹2Cl--2e-=Cl2↑; 2+3HClO=N2+3H2O+5H++3Cl-
6答案及解析:
答案:⑴6OH-+3Cl2= +5Cl-+3H2O;
⑵AC; ⑶26℃; 6:5(或l.2:1); ⑷2Fe3++3ClO-+10OH-=2+3Cl-+5H2O 高铁酸钾的溶解度比高铁酸钠要小
⑸高铁酸钾中的铁为+6价具有强氧化性能杀菌消毒; 水解产生氢氧化铁胶体具有吸附作用而净水
解析:⑴由题意及流程可知,先制备次氯酸钠,然后除去氯化钠,在碱性条件下次氯酸钠与硝酸铁发生反应生成高铁酸钠,高铁酸钠与氢氧化钾发生复分解反应得到高铁酸钾,经分离提纯后得到高铁酸钾晶体。
温度较高时NaOH与Cl2反应生成NaClO3,反应的离子方程式为6OH-+3Cl2=ClO3+5Cl-+3H2O。
⑵在溶液Ⅰ中加入NaOH固体的目的是,与反应液Ⅰ中过量的Cl2继续反应,生成更多的NaClO,并且为下一步反应提供碱性的环境,选 A、C。
⑶由图1可知。在26。CFe(NO3)3与NaClO两种溶液的质量浓度为330g/L和275g/L时。高锰酸钾的生成率最高。所以,工业生产中造价温度为26。C,此时Fe(NO3)3与NaClO两种溶液的最佳质量浓度之比为6:5(或1.2:1)
⑷反应③中的离子反应方程式为2Fe3++3ClO-+10OH-=2+3Cl-+5H2O;溶液Ⅱ中加入饱和KOH得到湿产品的原因是高铁酸钾的溶解度比高铁酸钠要小。
⑸高铁酸钾作为水处理剂是因为其能与水反应,离子方程式为4+10H2O=4Fe(OH)3(胶体)十3O2↑+8OH-。则其作为水处理剂的原理是:①高铁酸钾中的铁为+6价具有强氧化性能杀菌消毒;②水解产生的氢氧化铁胶体具有吸附作用而净水。
7答案及解析:
答案:⑴PH3+2ClO-+OH-=+2Cl-+H2O
⑵过量的碱将NaH2PO2转化为Na2HPO3
⑶7;CaCO3和Al(OH)3
⑷过量的Ag+会氧化
⑸2NiCl2+NaH2PO2+2H2O=2Ni↓+H3PO4+NaCl+3HCl
8答案及解析:
答案:⑴增大盐酸的浓度; ⑵2Fe2++H2O2+2H+=2Fe3++2H2O
⑶3.2-7.1; ⑷MgF2、CaF2
⑸0.142; ⑹2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O
9答案及解析:
答案:⑴加热或搅拌或增大硫酸浓度等;⑵Cu2++S2-=CuS↓
⑶c; ⑷NiSO4;⑸①过滤,并用蒸馏水洗净沉淀②向沉淀中加6mol·L-1的H2SO4溶液,直至恰好完全
10答案及解析:
答案:⑴
⑵Fe; 蒸发浓缩、冷却结晶、过滤;⑶加水稀释反应物; 加碱中和生成的酸;
⑷
⑸; 1×10-5(或1.0125×10-5等都行)
11答案及解析:
答案:⑴过滤;⑵升高温度、使反应物充分混合,以加快反应速率
⑶3Fe2+++8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+
⑷除去Cu2+; ⑸60℃条件下蒸发浓缩 ;降低烘干的温度,防止ZnSO4•7H2O分解
⑹.b
12答案及解析:
答案:⑴+6;2MnWO4+O2+4NaOH 2MnO2+2Na2WO4+2H2O
⑵H2O2+═+H2O ; MgSiO3、MgHAsO4、MgHPO4
⑶1×10-10 ; +Ca(OH)2=CaWO4+2OH- ; 1×103
⑷WC+6H2O-10e-=H2WO4+CO2↑+10H+
13答案及解析:
答案:⑴增大NaOH溶液的浓度、适当延长浸取时间
2Al+2NaOH+2H2O2NaAlO2+3H2↑ +2H2OAl(OH)3+OH-
⑵4Co2O3++14H+8Co2+++7H2O
⑶ Al(OH)3和LiF
⑷CoC2O4CoO+CO↑+CO2↑ 不能 该反应的平衡常数K=2.22×10-6,转化程度极小
解析:⑴增大NaOH溶液的浓度、适当延长浸取时间等均可提高铝的去除率;铝锂钴废料成分中只有Al可与NaOH溶液发生反应,化学方程式为2Al+2NaOH+2H2O2NaAlO2+3H2↑;经过滤、洗涤后溶液中含有NaAlO2,NaAlO2发生水解生成少量的Al(OH)3沉淀,反应的离子方程式为+2H2OAl(OH)3+OH-。
⑵“酸溶”时,Co2O3转化为CoSO4,Co由+3价转化为+2价,加入的Na2S2O3起还原剂作用,S元素化合价升高,根据化合价升降相等及电荷守恒可得离子方程式为4Co2O3++14H+8Co2+++7H2O。
⑶步骤Ⅴ使Al3+沉淀完全,而Co2+不沉淀,由题给数据得pH的适用范围是;步骤Ⅴ中加入的Na2CO3溶液和Al3+发生双水解生成Al(OH)3沉淀,同时加入NaF溶液使Li+变为LiF沉淀,故步骤Ⅵ所得滤渣的成分为Al(OH)3和LiF。
⑷由题知煅烧CoC2O4时发生氧化还原反应,生成CoO,钴元素化合价不变,则碳元素化合价既要升高又要降低,CoC2O4中C显+3价,碳元素化合价升高则一定有CO2生成,降低则可能有CO生成,根据化合价升降相等及原子守恒可写出化学方程式:CoC2O4CoO+CO↑+CO2
↑;仅从沉淀转化角度考虑,若要实现反应CoCO3+CoC2O4+,该反应的平衡常数,转化程度极小,所以不能实现转化。