- 252.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
电化学基础
1. (2019·江苏高考)将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )
A.铁被氧化的电极反应式为Fe-3e-===Fe3+
B.铁腐蚀过程中化学能全部转化为电能
C.活性炭的存在会加速铁的腐蚀
D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
答案 C
解析 铁在中性环境中发生吸氧腐蚀,负极上铁失电子发生氧化反应,电极反应式为Fe-2e-===Fe2+,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-===4OH-,A、D错误;铁的电化学腐蚀过程中,化学能除转化为电能外还有部分转化为热能,B错误。
2. (2019·河北武邑高三调研)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质。下列说法错误的是( )
A.溶液中OH-向电极a移动
B.反应消耗的NH3与O2的物质的量之比为4∶5
C.O2在电极b上发生还原反应
D.负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
答案 B
解析 NH3
被氧化为常见无毒物质,应生成氮气,a电极通入氨气生成氮气,为原电池负极,则b为正极,氧气得电子被还原。因为a极为负极,则溶液中的阴离子向负极移动,故A正确;反应中,氨气中N元素化合价由-3升高至0价,升高的总数为3;氧气中O元素化合价由0降低至-2价,降低的总数为4,根据得失电子守恒可知,消耗NH3与O2的物质的量之比为4∶3,故B错误;氧气具有氧化性,在原电池中正极上发生还原反应,故C正确;负极是氨气发生氧化反应变成氮气,电极反应式为2NH3-6e-+6OH-===N2+6H2O,故D正确。
3.(2019·广东实验中学高三第三次阶段考试)银锌蓄电池应用广泛,放电时总反应为Zn+Ag2O2+H2O===Zn(OH)2+Ag2O,某小组以银锌蓄电池为电源,用惰性电极电解饱和Na2SO4溶液制备H2SO4和NaOH,设计如图所示装置。连通电路后,下列说法正确的是( )
A.电池的a极反应式为Ag2O2+H2O+2e-===Ag2O+2OH-
B.气体Y为H2
C.pq膜适宜选择阳离子交换膜
D.电池中消耗65 g Zn,理论上生成1 mol气体X
答案 D
解析 惰性电极电解饱和Na2SO4溶液制备H2SO4和NaOH,则在阴极上是氢离子发生还原反应产生氢气,电极附近氢氧根离子浓度增加,显碱性,钠离子移向阴极,所以阴极区域附近氢氧化钠浓度较高,产生氢氧化钠,在阳极上是氢氧根离子失电子,产生氧气,电极附近氢离子浓度增加,显酸性,硫酸根离子移向阳极,所以阳极区域附近硫酸浓度较高,产生硫酸,所以N为阳极,b是电源的正极,a是电源的负极,pq是阴离子交换膜,mn是阳离子交换膜。a是电源的负极,a极反应式为Zn-2e-+2OH-===Zn(OH)2,A错误;N是阳极,在阳极是氢氧根离子失电子,产生氧气,气体Y为O2,B错误;pq膜是阴离子交换膜,C错误;电池中消耗65 g Zn,即1 mol Zn,转移电子是2 mol,在M电极上发生反应:2H++2e-===H2↑,理论上生成1 mol H2,D正确。
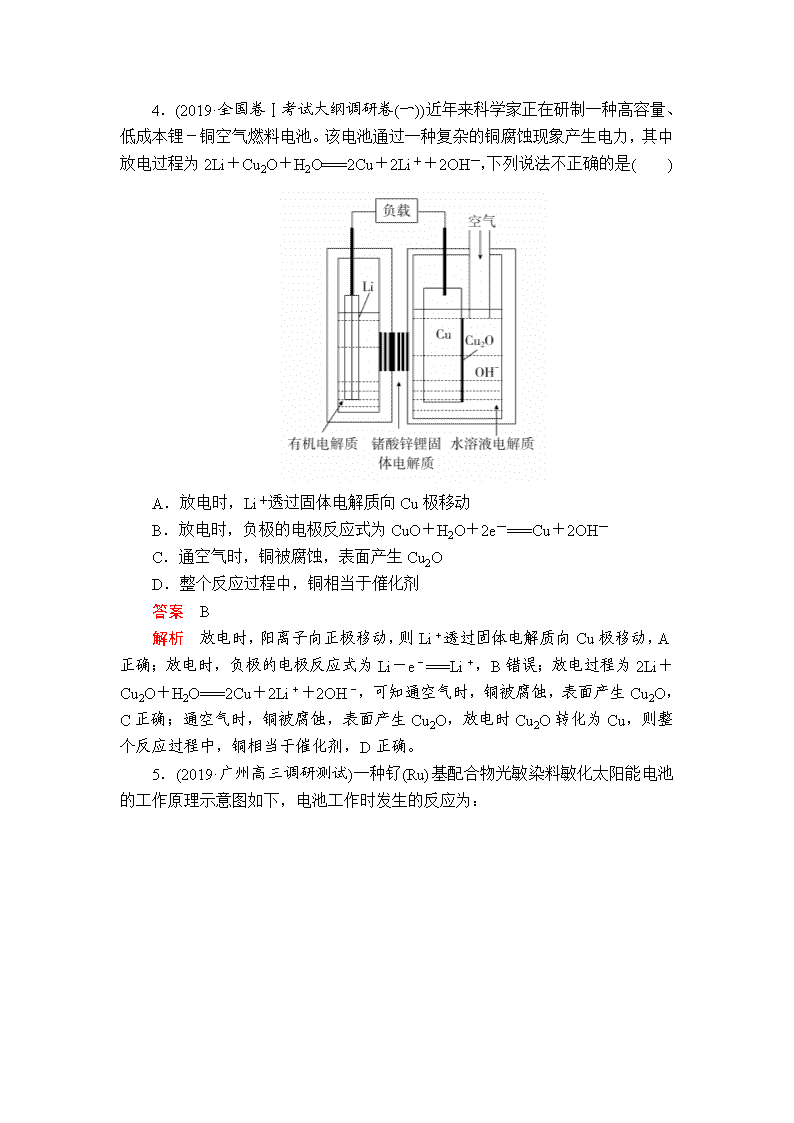
4.(2019·全国卷Ⅰ考试大纲调研卷(一))近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池。该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-,下列说法不正确的是( )
A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,负极的电极反应式为CuO+H2O+2e-===Cu+2OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,铜相当于催化剂
答案 B
解析 放电时,阳离子向正极移动,则Li+透过固体电解质向Cu极移动,A正确;放电时,负极的电极反应式为Li-e-===Li+,B错误;放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-,可知通空气时,铜被腐蚀,表面产生Cu2O,C正确;通空气时,铜被腐蚀,表面产生Cu2O,放电时Cu2O转化为Cu,则整个反应过程中,铜相当于催化剂,D正确。
5.(2019·广州高三调研测试)一种钌(Ru)基配合物光敏染料敏化太阳能电池的工作原理示意图如下,电池工作时发生的反应为:
RuⅡRuⅡ*(激发态)
RuⅡ*―→RuⅢ+e-
I+2e-―→3I-
2RuⅢ+3I-―→2RuⅡ+I
下列关于该电池的叙述错误的是( )
A.电池中镀Pt导电玻璃为正极
B.电池工作时,I-在镀Pt导电玻璃上放电
C.电池工作时,电解质中I-和I浓度不会减少
D.电池工作时,是将太阳能转化为电能
答案 B
解析 根据电池工作时电子从透明导电玻璃流入镀Pt导电玻璃,则透明导电玻璃为负极,镀Pt导电玻璃为正极,A正确;电池工作时,镀Pt导电玻璃为正极,电极反应为I+2e-===3I-,正极上为I放电,B错误;根据电池工作时发生的反应可知,I在正极上得电子被还原为I-,后I-又被RuⅢ氧化为I,I和I-相互转化,电解质中I-和I浓度不会减少,C正确;电池工作时,是将太阳能转化为电能,D正确。
6.(2019·山东济南历城二中高三调研)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是( )
A.HS-在硫氧化菌作用下转化为SO的反应为HS-+4H2O-8e-===SO+9H+
B.电子从b流出,经外电路流向a
C.如果将反应物直接燃烧,能量的利用率不会变化
D.若该电池电路中有0.4 mol电子发生转移,则有0.45 mol H+通过质子交换膜
答案 A
解析 负极上HS-在硫氧化菌作用下转化为SO,失电子发生氧化反应,电极反应式是HS-+4H2O-8e-===SO+9H+,A正确;b是电池的正极,a是负极,所以电子从a流出,经外电路流向b,故B错误;如果将反应物直接燃烧,会有部分化学能转化为光能等,因此能量的利用率会有变化,故C错误;根据电子守恒,若该电池有0.4 mol电子发生转移,则有0.4 mol H+通过质子交换膜,故D错误。
7.(2019·江西师大附中高三期末考试)氯碱工业是以电解饱和食盐水为基础的基本化学工业。下图是某氯碱工业生产原理示意图:
(1)A装置所用食盐水由粗盐水精制而成。精制时,为除去食盐水中的Mg2+
和Ca2+,要加入的试剂分别为________、________。
(2)写出装置A在通电条件下反应的化学方程式:_____________________。
(3)氯碱工业是高耗能产业,按上图将电解池与燃料电池相组合的新工艺可以节(电)能30%以上,且相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中Y是________(填化学式);X与稀NaOH溶液反应的离子方程式是__________________。
②分析比较图示中氢氧化钠质量分数a%与b%的大小:__________。
③若用B装置作为A装置的辅助电源,每当消耗标准状况下氧气的体积为11.2 L时,则B装置可向A装置提供的电量约为______________(一个e-的电量为1.60×10-19 C;计算结果精确到0.01)。
答案 (1)NaOH溶液 Na2CO3溶液
(2)2NaCl+2H2O2NaOH+H2↑+Cl2↑
(3)①H2 2OH-+Cl2===ClO-+Cl-+H2O
②b%>a% ③1.93×105 C
解析 (1)除去杂质不能引入新的杂质,即除去Mg2+用NaOH,除去Ca2+用Na2CO3。
(2)根据生产流程示意图,装置A是电解池装置,电解饱和食盐水,因此化学反应方程式为2NaCl+2H2O2NaOH+H2↑+Cl2↑。
(3)①装置A的右端产生NaOH溶液,说明右端电极是阴极,发生2H2O+2e-===H2↑+2OH-,因此Y是氢气,装置A的左端是阳极,发生2Cl--2e-===Cl2↑,X为Cl2,和NaOH溶液的反应式为Cl2+2OH-===Cl-+ClO-+H2O。
②装置B中通氧气的一极为正极,环境是NaOH,因此正极反应式为O2+2H2O+4e-===4OH-,产生NaOH,因此b%>a%。
③两者装置通过的电量相等,即转移的电量是
C≈1.93×105 C。
8.(2019·湖北省鄂州市、黄冈市高三调研)化学电源在日常生活和工业生产中有着重要的应用。
Ⅰ.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题
(1)甲烷燃料电池负极反应式是____________________________。
(2)石墨(C)极的电极反应式为______________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体体积为________ L;丙装置中阴极析出铜的质量为________ g,一段时间后烧杯中c(Cu2+)________(填“增大”“减小”或“不变”)。
Ⅱ.“长征”火箭发射使用的燃料是液态偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,回答相关问题:
(4)从a口加入________(填名称)。H+移动方向是________(填“A到B”或“B到A”)。
(5)A极发生的电极反应式:____________________________________。
(6)若以该电池为电源,用石墨作电极电解200 mL 0.5 mol/L的CuSO4溶液,电解一段时间后,两极收集到相同体积(相同条件)的气体,则整个电解过程转移的电子的数目是________。
答案 (1)CH4-8e-+10OH-===CO+7H2O
(2)2Cl--2e-===Cl2↑
(3)4.48 12.8 减小
(4)偏二甲肼 A到B
(5)C2H8N2-16e-+4H2O===2CO2↑+N2↑+16H+
(6)0.4NA(或2.408×1023)
解析 甲为燃料电池,甲烷通入一极为负极,氧气通入一极为正极;乙为电解池,Fe为阴极,C为阳极,实质为电解饱和食盐水;丙为电解池,粗铜为阳极,精铜为阴极,实质为电解精炼铜。
(1)甲烷燃料电池负极为CH4,失去电子后结合OH-生成CO,其反应式是CH4-8e-+10OH-===CO+7H2O。
(2)乙为电解池,Fe为阴极,C为阳极,实质为电解饱和食盐水,故石墨(C)极的电极反应式为2Cl--2e-===Cl2↑。
(3)标准状况下,2.24 L氧气的物质的量为0.1 mol,参与反应转移的电子数为0.4 mol;铁电极为阴极,阳离子放电:2H++2e-===H2,则放出氢气0.2 mol,标准状况下体积为4.48 L;丙装置中阴极反应式为Cu2++2e-===Cu,则析出铜0.2 mol,即为12.8 g。一段时间后烧杯中c(Cu2+)会减少。
(4)外电路中电子由A电极流向B电极,由电子转移方向可知A为负极,B为正极,根据原电池原理,还原剂在负极上失去电子发生氧化反应,氧化剂在正极上得到电子发生还原反应,则从a口通入偏二甲肼;内电路一般是阳离子向正极移动,阴离子向负极移动,所以H+移动方向是A到B。
(5)A为负极,还原剂在负极上失去电子发生氧化反应,又已知产物中气体均为空气组分,所以A极发生的电极反应式为C2H8N2-16e-+4H2O===2CO2↑+N2↑+16H+。
(6)两极收集到相同体积(相同条件)的气体,则阴极除了Cu2++2e-===Cu,还应有2H++2e-===H2↑,阳极的电极反应式为2H2O-4e-===4H++O2↑,设生成n(O2)=n(H2)=x,因为n(Cu2+)=0.5 mol/L×0.2 L=0.1 mol,由得失电子守恒得0.1×2+2x=4x,x=0.1 mol,所以n(O2)=n(H2)=0.1 mol,则整个电解过程转移的电子的数目是0.1 mol×4=0.4 mol,即0.4NA。