- 1.65 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
安徽省合肥市2020届高三下学期“停课不停学”线上考试
可能用到的相对原子质量:H1 Li7 C12 N14 O16 Al27 Si28 S32 Cl35.5 Ti48 V51 Cu64 Ba137
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.中华诗词中蕴含着许多化学知识。下列关于诗词的分析错误的是( )
A.“九秋风露越窑开,夺得千峰翠色来”中的“翠色”来自氧化铜
B.“嫘祖栽桑蚕吐丝,抽丝织作绣神奇”中的“丝”不耐酸碱
C.“手如柔荑,肤如凝脂”中的“脂”能够水解
D.“墨滴无声入水惊,如烟袅袅幻形生”中的“墨滴”具有胶体的性质
8.企鹅酮()可作为分子机器的原材料。下列关于企鹅酮的说法错误的是( )
A.能使酸性高锰酸钾溶液褪色 B.可发生取代反应
C.1 mol企鹅酮转化为C10H21OH需消耗3 mol H2 D.所有碳原子一定不可能共平面
9.利用下列装置模拟“侯氏制碱法”,通过制备的NH3和CO2,与饱和食盐水反应先制备NaHCO3。下列说法正确的是( )
A.实验时装置Ⅰ产生的气体应先通入到装置Ⅳ中 B.装置Ⅲ中的试剂为浓硫酸
C.导管口的连接顺序为a-e-f-d-c-b D.实验过程中,装置Ⅳ内会出现浑浊现象
10.《本草图经》有“白矾多人药用”。白矾[KAl(SO4)2·12H2O]又称明矾、钾铝矾、钾明矾等,是一种重要的化学试剂。下列说法正确的是( )
A.含白矾的药物不宜与胃药奥美拉唑碳酸氢钠胶囊同时服用
B.0.1 mol·L-1白矾溶液完全水解生成Al(OH)3胶粒数小于6.02×1022
C.向含0.1 mol白矾的溶液中滴入Ba(OH)2溶液,若SO42-和Al3+全部转化为BaSO4和Al(OH)3沉淀,则此时生成沉淀的质量最大
D.室温下,0.1 mol·L-1白矾溶液中水电离出c(H+)小于10-7 mol·L-1
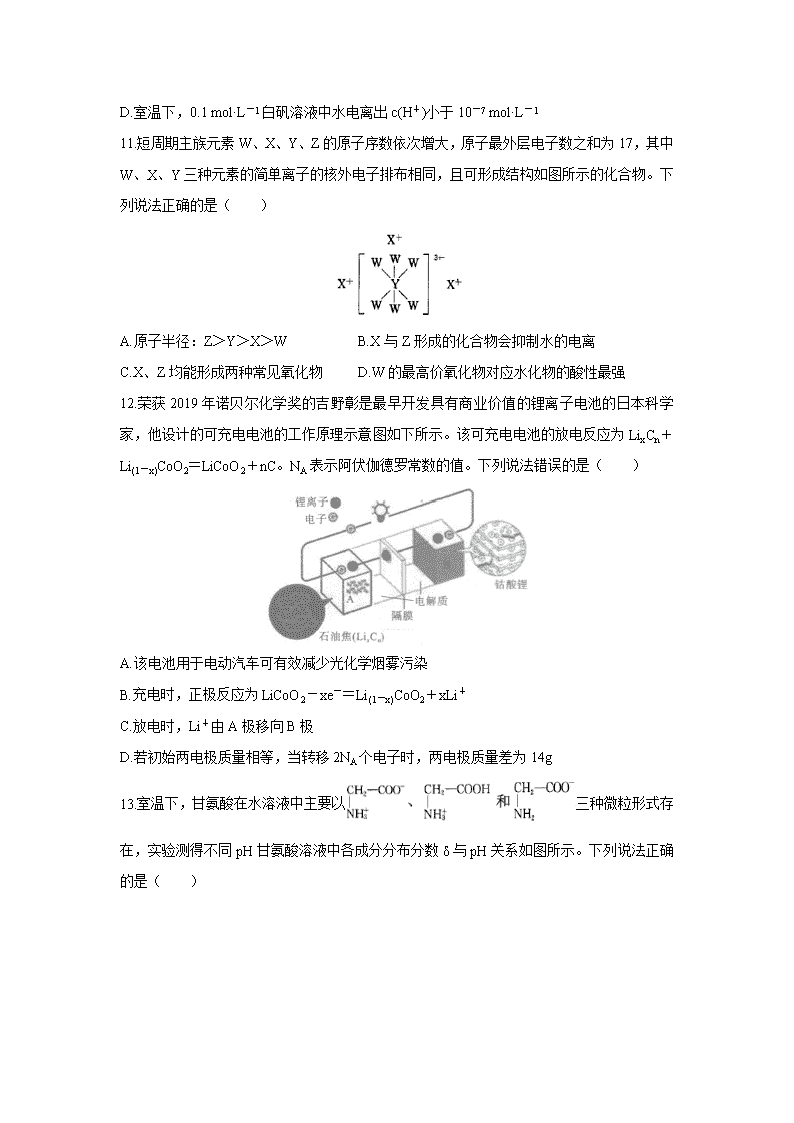
11.短周期主族元素W、X、Y、Z的原子序数依次增大,原子最外层电子数之和为17,其中W、X、Y三种元素的简单离子的核外电子排布相同,且可形成结构如图所示的化合物。下列说法正确的是( )
A.原子半径:Z>Y>X>W B.X与Z形成的化合物会抑制水的电离
C.X、Z均能形成两种常见氧化物 D.W的最高价氧化物对应水化物的酸性最强
12.荣获2019年诺贝尔化学奖的吉野彰是最早开发具有商业价值的锂离子电池的日本科学家,他设计的可充电电池的工作原理示意图如下所示。该可充电电池的放电反应为LixCn+Li(1-x)CoO2=LiCoO2+nC。NA表示阿伏伽德罗常数的值。下列说法错误的是( )
A.该电池用于电动汽车可有效减少光化学烟雾污染
B.充电时,正极反应为LiCoO2-xe-=Li(1-x)CoO2+xLi+
C.放电时,Li+由A极移向B极
D.若初始两电极质量相等,当转移2NA个电子时,两电极质量差为14g
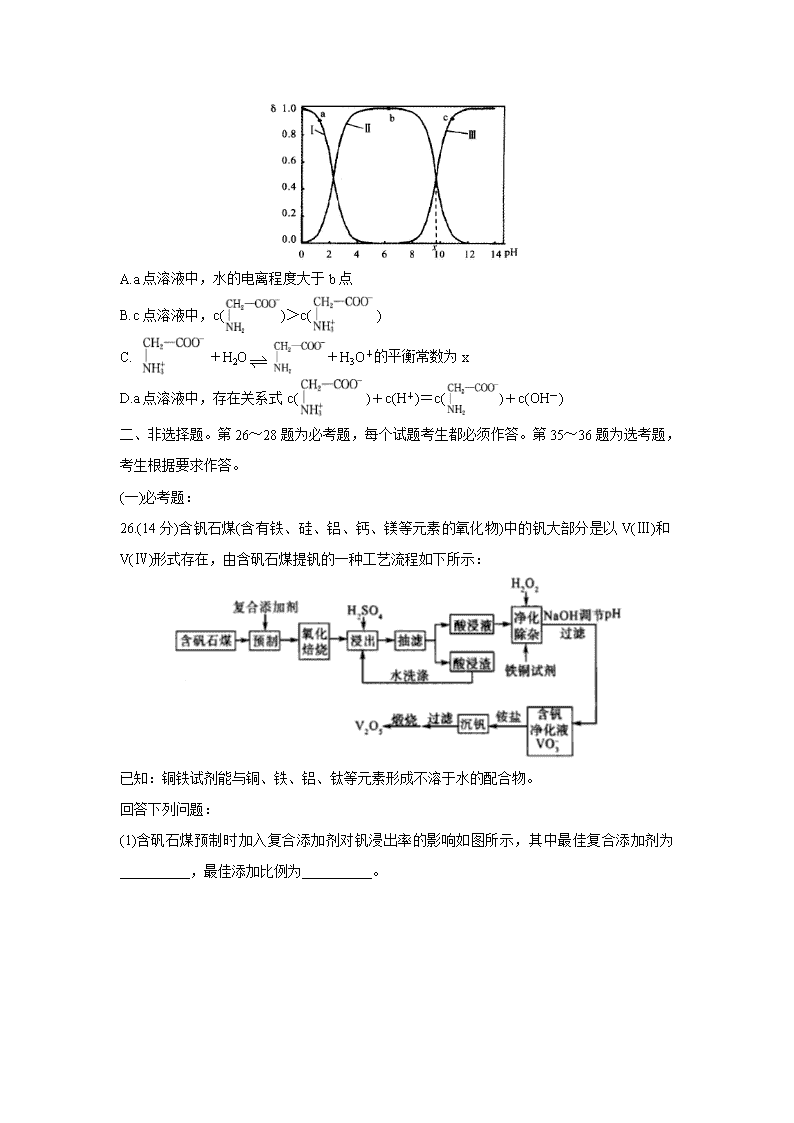
13.室温下,甘氨酸在水溶液中主要以三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
A.a点溶液中,水的电离程度大于b点
B.c点溶液中,c()>c()
C. +H2O+H3O+的平衡常数为x
D.a点溶液中,存在关系式c()+c(H+)=c()+c(OH-)
二、非选择题。第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。
(一)必考题:
26.(14分)含钒石煤(含有铁、硅、铝、钙、镁等元素的氧化物)中的钒大部分是以V(Ⅲ)和V(Ⅳ)形式存在,由含矾石煤提钒的一种工艺流程如下所示:
已知:铜铁试剂能与铜、铁、铝、钛等元素形成不溶于水的配合物。
回答下列问题:
(1)含矾石煤预制时加入复合添加剂对钒浸出率的影响如图所示,其中最佳复合添加剂为__________,最佳添加比例为__________。
(2)上右图为“抽滤”实验原理装置图,“抽滤”时抽气泵的作用是____________________;“酸浸渣”经“水洗涤”返回“浸出”的目的是______________________________。
(3)已知酸浸液中V2O24+被H2O2氧化成VO2+,其离子方程式为________________________。“净化除杂”时用铜铁试剂除去所含的Al3+、Fe3+等杂质离子而不通过调节酸浸液pH的原因是__________________________________________________。
(4)“沉钒”的离子反应方程式为____________________。
(5)“煅烧”纯净的沉钒产物过程中,固体残留率与温度变化如图所示。已知A点坐标为(260℃,85.47%),则A点对应物质的化学式为____________,B点对应的物质为V2O5,则B点坐标为( )。
27.(15分)实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。已知Cu2O+2H+=Cu+Cu2++H2O。回答下列相关问题:
Ⅰ.SO2还原CuO的探究
(1)装置B中宜放入的试剂为_______,消膜泡的作用是_______________________________。
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是_____________________________。
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为______________________。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取m g固体溶解于水配制为250 mL溶液,取20.00 mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-I3-,I2+2S2O32-=S4O62-+2I-。
①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、_________、玻璃棒和试剂瓶。
②若消耗0.1000 mol/L Na2S2O3标准溶液V mL,则产物中CuSO4质量分数为_______(写表达式)。
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值__________(填“偏大”或“偏小”)。为减少实验误差,滴定过程中,常常在接近终点时加入KSCN,使CuI转化为溶解度更小的CuSCN,该沉淀物对I3-吸附能力极弱,KSCN加入太早,I2的浓度较大,I2会将SCN-氧化生成SO42-和ICN,该反应的离子方程式为____________________。
28.(14分)甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)CO(g)+3H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3 kJ·mol-1,
CO(g)+O2(g)=CO2(g) △H2=-283.0 kJ·mol-1,
H2(g)+O2(g)=H2O(l) △H3=-285.8 kJ·mol-1,
CO(g)+H2O(g)=CO2(g)+H2(g) △H4=-41.0 kJ·mol-1,
则甲烷水蒸气重整反应的△H=________kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1 MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如下图所示。
①H2的物质的量分数与水碳比(1~10)的关系是平衡温度一定时,__________________,其原因是__________________________。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为______________,其压强平衡常数为____________;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率v=__________(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如下图所示,若要提高H2的产率,最佳温度为__________;与甲烷水蒸气重整制氢相比其优点有_________________________________________________(至少写两点)。
(二)选考题:
35.[化学——选修3:物质结构与性质](15分)
SiC纤维单向增强的TixAly
基复合材料可作为高超音速飞行器表面的放热材料。回答下列问题:
(1)C元素所在周期中,第一电离能最大的元素是_________(填元素符号),电负性最大的是_________(填元素符号)。
(2)基态Ti原子的价电子排布式为__________,能量最高的能级有__________个空轨道。
(3)甲基硅油结构如图所示,其中Si原子的杂化方式为__________,以甲基硅油为主要成分的硅橡胶能够耐高温的原因是_____________。
(4)Li2CO3、Li2TiO3是锂离子电池中的常用材料,其中CO32-的空间构型为__________,其含有的共价键类型有________________。
(5)TixAly合金的一种结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),该合金的化学式为____________________,其结构单元棱长为a pm,底面边长为b pm,该合金的密度为__________g·cm-3。
36.[化学——选修5:有机化学基础](15分)
痛灭定钠是一种吡咯乙酸类的非甾体抗炎药,其合成路线如下:
回答下列问题:
(1)化合物B中含有官能团的名称是______________________________。
(2)化学反应①和④的反应类型分别为__________和__________。
(3)化合物C的结构简式为_______________________________。
(4)下列关于痛灭定钠的说法错误的是__________。
a.与溴充分加成后官能团种类数不变
b.能够发生水解反应
c.核磁共振氢谱分析能够显示6个峰
d.可使溴的四氯化碳溶液褪色
e.1 mol痛灭定钠与氢气加成最多消耗3 mol H2
(5)反应⑦的化学方程式为__________________________________________________。
(6)芳香族化合物X的相对分子质量比A大14,写出遇FeCl3溶液显紫色且取代基仅位于苯环对位上化合物X的结构简式:____________________(不考虑立体异构)。
(7)根据该试题提供的相关信息,写出由化合物及必要的试剂制备有机化合物的合成路线图。
【参考答案】