- 785.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
绝密★启用前
安徽省示范高中培优联盟2020年春季联赛(高二)
化学
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,第I卷第1至第6页,第II卷第7至第12页。全卷满分100分,考试时间90分钟。
考生注意事项:
1.答题前,务必在试题卷、答题卡规定的地方填写自己的姓名、座位号,并认真核对答题卡上所粘贴的条形码中姓名、座位号与本人姓名、座位号是否一致。
2.答第I卷时,每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
3.答第II卷时,必须使用0.5毫米的黑色墨水签字笔在答题卡上书写,要求字体工整、笔迹清晰。作图题可先用铅笔在答题卡规定的位置绘出,确认后再用0.5毫米的黑色墨水签字笔描清楚。必须在题号所指示的答题区域作答,超出答题区域书写的答案无效,在试题卷、草稿纸上答题无效。
4.考试结束,务必将试题卷和答题卡一并上交。
可能用到的相对原子质量:H1 Li7 C12 N14 O16 Na23 S32 Ca40
第I卷(选择题 共45分)
一、选择题(本大题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
1.新型冠状病毒的主要传播途径有飞沫传播、接触传播和气溶胶传播,戴口罩、勤洗手,给自己居住、生活的环境消毒,都是预防病毒传播行之有效的方法。下列有关说法不正确的是A.云、烟、雾属于气溶胶,它们均能发生丁达尔效应
B.使用酒精作为环境消毒剂时,酒精浓度越大,消毒效果越好
C.“84”消毒液与洁厕灵混合使用可能会产生氯气中毒
D.以聚丙烯为原料生产的熔喷布口罩,在抗击“新冠肺炎”的战疫中发挥了重要作用
2.下列说法正确的是
A.花生油的主要成分是高级脂肪酸甘油酯,属于高分子化合物
B.只有不同种类的氨基酸之间才能形成多肽
C.向鸡蛋清的溶液中加入饱和硫酸钠溶液产生沉淀,加水后沉淀可溶解
D.浓硫酸具有强氧化性,不能干燥具有较强还原性的H2S和SO2气体
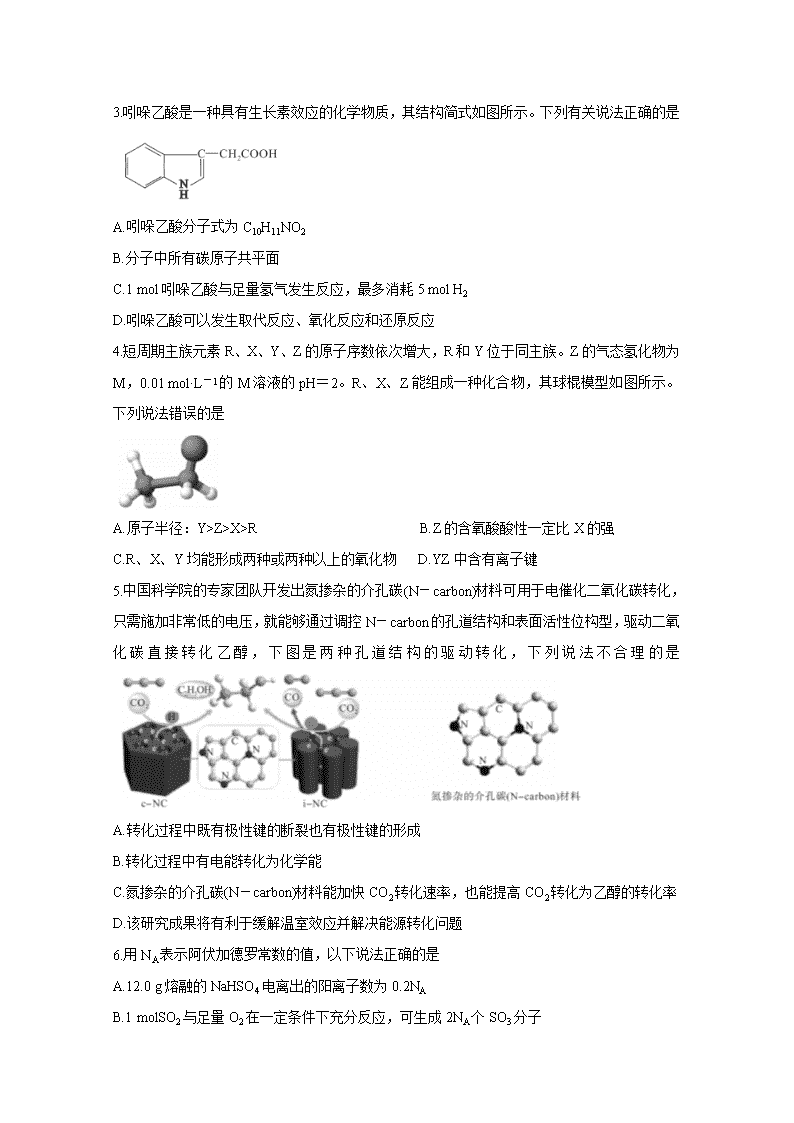
3.吲哚乙酸是一种具有生长素效应的化学物质,其结构简式如图所示。下列有关说法正确的是
A.吲哚乙酸分子式为C10H11NO2
B.分子中所有碳原子共平面
C.1 mol吲哚乙酸与足量氢气发生反应,最多消耗5 mol H2
D.吲哚乙酸可以发生取代反应、氧化反应和还原反应
4.短周期主族元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族。Z的气态氢化物为M,0.01 mol·L-1的M溶液的pH=2。R、X、Z能组成一种化合物,其球棍模型如图所示。下列说法错误的是
A.原子半径:Y>Z>X>R B.Z的含氧酸酸性一定比X的强
C.R、X、Y均能形成两种或两种以上的氧化物 D.YZ中含有离子键
5.中国科学院的专家团队开发出氮掺杂的介孔碳(N-carbon)材料可用于电催化二氧化碳转化,只需施加非常低的电压,就能够通过调控N-carbon的孔道结构和表面活性位构型,驱动二氧化碳直接转化乙醇,下图是两种孔道结构的驱动转化,下列说法不合理的是
A.转化过程中既有极性键的断裂也有极性键的形成
B.转化过程中有电能转化为化学能
C.氮掺杂的介孔碳(N-carbon)材料能加快CO2转化速率,也能提高CO2转化为乙醇的转化率
D.该研究成果将有利于缓解温室效应并解决能源转化问题
6.用NA表示阿伏加德罗常数的值,以下说法正确的是
A.12.0 g熔融的NaHSO4电离出的阳离子数为0.2NA
B.1 molSO2与足量O2在一定条件下充分反应,可生成2NA个SO3分子
C.常温常压下,18 g氨基(-ND2)中含有的电子数为10NA
D.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA
7.2019年诺贝尔化学奖颁给在锂离子电池发展方面作出突出贡献的三位科学家,颁奖词中说:他们创造了一个可再充电的世界。下面是最近研发的Ca-LiFePO4可充电电池的工作示意图,锂离子导体膜只允许Li+通过,电池反应为:xCa2++2LiFePO4xCa+2Li1-xFePO4+2xLi+。下列说法错误的是
A.LiPF6-LiAsF6为非水电解质,其与Li2SO4溶液的主要作用都是传递离子
B.放电时,负极反应为:LiFePO4-xe-=Li1-xFePO4+xLi+
C.充电时,Li1-xFePO4/LiFePO4电极发生Li+脱嵌,放电时发生Li+嵌入
D.充电时,当转移0.2 mol电子时,左室中电解质的质量减轻2.6 g
8.肼(N2H4)是一种重要的工业产品,有极强的还原性,能与水强烈结合生成水合肼。资料表明,用氨和次氯酸钠溶液反应能制取肼,装置如下图所示。下列说法中错误的是
A.肼的电子式是
B.若滴加NaClO溶液时过快、过多,可能会导致生成的肼被氧化
C.从实验安全性角度看,实验装置中B、C均起到了防倒吸的作用
D.肼与水强烈结合的原因是分子间形成氢键
9.向2 mL 0.8 mol·L-1 FeSO4溶液中,滴加2 mL 1 mol·L-1 NaHCO3溶液,产生无色气体和白色沉淀。将浊液分成两份,一份迅速过滤、洗涤,加入稀盐酸,产生的无色气体可使澄清石灰水变浑浊;另一份静置一段时间后变为红褐色。已知:碳酸亚铁是难溶于水的白色固体。下列说法不正确的是
A.产生无色气体和白色沉淀的原因是Fe2+和HCO3-发生水解反应,且相互促进
B.配制FeSO4溶液时是把FeSO4·7H2O晶体溶解在稀硫酸中,并加入适量铁粉
C.白色沉淀与盐酸反应的离子方程式是FeCO3+2H+=Fe2++CO2↑+H2O
D..上述实验过程中发生了氧化还原反应
10.根据下列实验操作和现象所得出的结论正确的是
11.高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应I中尾气后可再利用
C.反应II中氧化剂与还原剂的物质的量之比为3:2
D.该生产条件下,物质的溶解性:Na2FeO4c(HSO3-)=c(SO32-)>c(OH-)=c(H+)(2分)
【解析】
(1)由图可知生成副产物CH2O的能量变化大,即能垒高,反应进行难,生成的量少,相对较多的副产物为CO;由图可知生成甲醇的过程中,能垒最高的变化为*CO+*OH→*CO+*H2O,该反应速率最慢,所以要想提高整个反应速率,应该降低该反应的能垒,故选A。
(2)①碳酸的电离平衡常数Ka2= 5.6×10-11<Ka=5.7×10-10,水解能力:CO>B(OH)4ˉ,相同浓度的碳酸钠溶液和硼酸钠溶液,pH 较大的是Na2CO3。
②根据电离常数可知酸性:H2CO3>H3BO3>HCO, 所以反应为:CO2+ B(OH) ═ H3
BO3+ HCO
(3)“电解 CO2 制得无定型炭是”是这种CO2资源化利用的原理,阴极:CO2 →C,依据题意“高温熔融混合碳酸盐 LiaNabKcCO3 作电解质”可写出阴极反应为:3CO2+4e- ═ C+2CO
(4) ①氧化钙与水反应生成氢氧化钙,氢氧化钙与Na2SO3发生复分解反应,总反应方程式是CaO+H2O+Na2SO3=CaSO3+ 2NaOH;
②25℃ 时, Ka2=1×10-7,即,所以中性条件下c(HSO3-)=c(SO32-),故该混合溶液中各离子浓度由大到小的顺序为c(Na+)>c(HSO3-)=c(SO32-)>c(OH-)=c(H+)。
17(10分)
【答案】(1)①AB(1分) ②abef(2分)
③空气中的O2能氧化H2SO3,使SO2利用率下降(2分)
(2)Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.(2分) 乙醇(1分)
(3)将Na2CO3溶液缓慢加入到盛有MnSO4溶液的反应容器中.(2分)
【解析】
(1)①MnO2研磨、反应时搅拌均可以增大接触面积,加快反应速率,提高混合其中N2比例,二氧化硫的浓度减小,反应速率减小;故选:AB;
②反应不需要加热制备二氧化硫,b装置制备二氧化硫,氮气与二氧化硫通过e装置混合,在图1装置中反应生成MnSO4,利用f进行尾气处理,防止尾气中二氧化硫污染空气;故选:abef;
③制备原理为:H2SO3+MnO2=MnSO4+H2O,若用空气代替N2进行实验,氧气能与亚硫酸反应生成硫酸,二氧化硫失去还原能力,利用率降低;
(2)依据反应原理可知:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
步骤②为洗涤杂质,MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,应用乙醇洗涤,可以防止被氧化,因溶解导致的损失;
(3)MnSO4溶液中缓慢滴入Na2CO3溶液,酸性条件下生成MnCO3,若向 Na2CO3
溶液中缓慢滴加Mn2+溶液,碳酸钠溶液的碱性强,易生成Mn(OH)2,因此最合理的加料方式为:将Na2CO3溶液缓慢加入到盛有MnSO4溶液的反应容器中。
18.(14分)
【答案】(1)27.2(1分) 500 mL容量瓶、胶头滴管(1分 ,漏写不得分)
(2)2Cr3++3H2O2+H2O=Cr2O72-+8H+(2分)
(3)CrO42-(1分) (4)Mg2+、Ca2+(1分漏写不得分)
(5)2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH-(2分)
(6)①B(1分)
②当滴入最后一滴标准液时,沉淀由白色变为砖红色,且半分钟内沉淀颜色不再改变 0.008 mol/L(各2分) ③偏高(1分)
【解析】
(1)配制480mL溶液应选用500mL容量瓶。根据c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液),18.4mol/LV(浓H2SO4)=1mol/L500mL,解得V(浓H2SO4)=27.2mL。根据配制一定物质的量浓度溶液的实验步骤为:计算→量取→稀释→冷却→转移→洗涤→初步振荡→定容→摇匀→装瓶贴标签,配制时所用的玻璃仪器除量筒、烧杯和胶头滴管外,还需500mL容量瓶、玻璃棒。
(2)H2O2将Cr3+氧化成Cr2O72-,H2O2被还原,离子方程式为3H2O2+2Cr3++H2O=Cr2O72-+8H+。
(3)根据各金属阳离子形成沉淀的pH,加入NaOH溶液调pH=8,将Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀而除去;同时将Cr2O72-转化为CrO42-,反应可表示为Cr2O72-+2OH-=2CrO42-+H2O。
(4)加入NaOH溶液调pH=8除去了浸取液中的Fe3+和Al3+,利用钠离子交换树脂除去滤液II中的金属阳离子为Mg2+、Ca2+。
(5)根据流程加入SO2将CrO42-还原为Cr(OH)(H2O)5SO4,SO2被氧化成SO42-,结合原子守恒、电荷守恒和溶液呈碱性,写出离子方程式为3SO2+2CrO42-+12H2O=2Cr(OH)(H2O)5SO4↓+SO42-+2OH-。
(6)①若选择NaCl或者NaCN作指示剂,AgCN、AgCl、AgSCN的颜色都是白色,无法判断滴定终点;若选用K2CrO4作指示剂,Ksp(Ag2CrO4) Ksp(AgSCN),滴入AgNO3先与SCN-形成沉淀,当SCN-沉淀完全,滴入一滴AgNO3溶液与K2CrO4产生砖红色沉淀,可判断滴定终点;若选用KI作指示剂,Ksp(AgI)<Ksp(AgSCN),AgSCN与AgI类型相同,更易形成AgI沉淀,无法判断滴定终点;综上所述,选用K2CrO4作为指示剂,答案选B。
②终点实验现象为:当滴入最后一滴标准液时,当有砖红色沉淀出现,且半分钟内沉淀颜色不再改变。 根据反应可知:nAg+=nSCN ,即25ml · c(SCN-)=0.0100 mol/L·20 ml 可求得: c=0.0080mol/L
③滴定过程中,滴定前有气泡,滴定后气泡消失,则所消耗标准液体积偏大,待测液浓度偏大。
19.(10分)【答案】
Ⅰ.(1)4SO2+3CH4 4H2S+3CO2+2H2O(1分)
Ⅱ.(2)H2SH++HS- (只要写出第一步电离即可,1分)
(3)8.0×10-3mol·L-1 (2分)
Ⅲ.(4)1 076 (2分)
(5)①增大 (1分)反应ⅰ为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应ⅱ为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大(1分)
②0.15mol (单位不写不给分,1分)0.044 (1分)
【解析】
(1)天然气的主要成分是CH4,根据题意,CH4与SO2反应生成H2S、CO2和H2O,反应条件是高温、催化剂。根据得失电子守恒和原子守恒配平化学方程式。
(2)H2S是二元弱酸,分两步电离,且电离过程是“可逆过程”,以第一步电离为主,H2S的第一步电离方程式为H2SH++HS-。
(3)当Sn2+开始沉淀时,溶液中c(S2-)== mol·L-1=1.0×10-24mol·L-1,此时溶液中c(Cd2+)== mol·L-1=8.0×10-3mol·L-1。
(4)反应热=反应物总键能-生成物总键能,对于反应ⅰ,ΔH=(1 319+442-678-x)kJ·mol-1=+7 kJ·mol-1,解得x=1 076[或利用反应ⅱ进行计算,ΔH=(x+930-1 606-442)kJ·mol-1=-42 kJ·mol-1,解得x=1 076]。
(5)①由题图知,随着温度升高,CO的平衡体积分数增大。反应ⅰ为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应ⅱ为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数增大,综合来讲,其他条件不变,升高温度,体系中CO的平衡体积分数增大。
②T1 ℃时, CO的平衡体积分数为5%,反应ⅰ、反应ⅱ均是分子数不变的反应,可知CO的物质的量为3mol×5%=0.15 mol;又知,平衡时体系中COS的物质的量为0.80 mol,则反应的n(COS)=0.20 mol,反应ⅰ生成0.20 mol CO,剩余0.80 mol H2,生成的CO与H2O(g)发生反应ⅱ,设达到平衡时,参加反应ⅱ的CO为x
mol,利用三段式法进行计算:
CO(g)+H2O(g)CO2(g)+H2(g)
起始(mol) 0.20 1 0 0.80
转化(mol) x x x x
平衡(mol) 0.20-x 1-x x 0.80+x
开始共投入3 mol气体,且反应ⅰ和反应ⅱ都是气体分子数不变的反应,故平衡时体系中气体的总物质的量不变。根据题图知,T1℃达到平衡时,CO的体积分数为5%,故×100%=5%,解得x=0.05。故平衡时体系中n(COS)=0.80 mol,n(H2)=0.80 mol+0.05 mol=0.85 mol,n(H2S)=0.20 mol,n(CO)=0.20 mol-0.05 mol=0.15 mol,反应ⅰ的平衡常数K==≈0.044。
20.(10分)【答案】
(1)2-甲基-1,2-丙二醇 羟基、醛基; (各1分)
(2) C7H8 氢氧化钠溶液、加热; (各1分)
(1分)
(4) (1分)
(各1分)
(2分)
21.(10分)【答案】
(1)3d104s24p4 (1分)
(2)大于;小于(各1分)
(3) 2NA sp3杂化 (各1分)
(4) GaN>GaP>GaAs (2分)
(5)①12(1分)
② (2分)
【解析】
(1)Se是34号元素,位于第四周期ⅥA族,核外电子排布式为[Ar] 3d104s24p4。
(2)根据元素周期律,Ga与As位于同一周期,Ga原子序数小于As,故原子半径Ga大于As,同周期第一电离能变化趋势是从左到右增大,故第一电离能Ga小于As。
(3) NH4BF4 中NH4+和BF4离子中各有一个配位键,故lmol NH4BF4晶体中含有配位键的数目为2NA;(CH3)3N可以看作三个甲基取代了NH3分子中的三个H原子而得,N原子含有的 σ 电子对为3,孤电子对数为=1,因此(CH3)3N分子中N原子采用sp3杂化;
(4)因为原子半径N<P<As,键长Ga—N<Ga—P<Ga—As,键能Ga—N>Ga—P>Ga—As,故熔点GaN>GaP>GaAs。
(5) ①从六方晶胞的面心原子分析,上、中、下层分别有3、6、3个配位原子,故配位数为12。
②GaN的晶胞结构和金刚石类似,与同一个Ga原子相连的N原子构成的空间构型为正四面体。GaN晶体的密度为ρ==。