- 1.01 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
课练20 电解池 金属的腐蚀与防护
—————————[狂刷小题 夯基础]————————
[练基础]
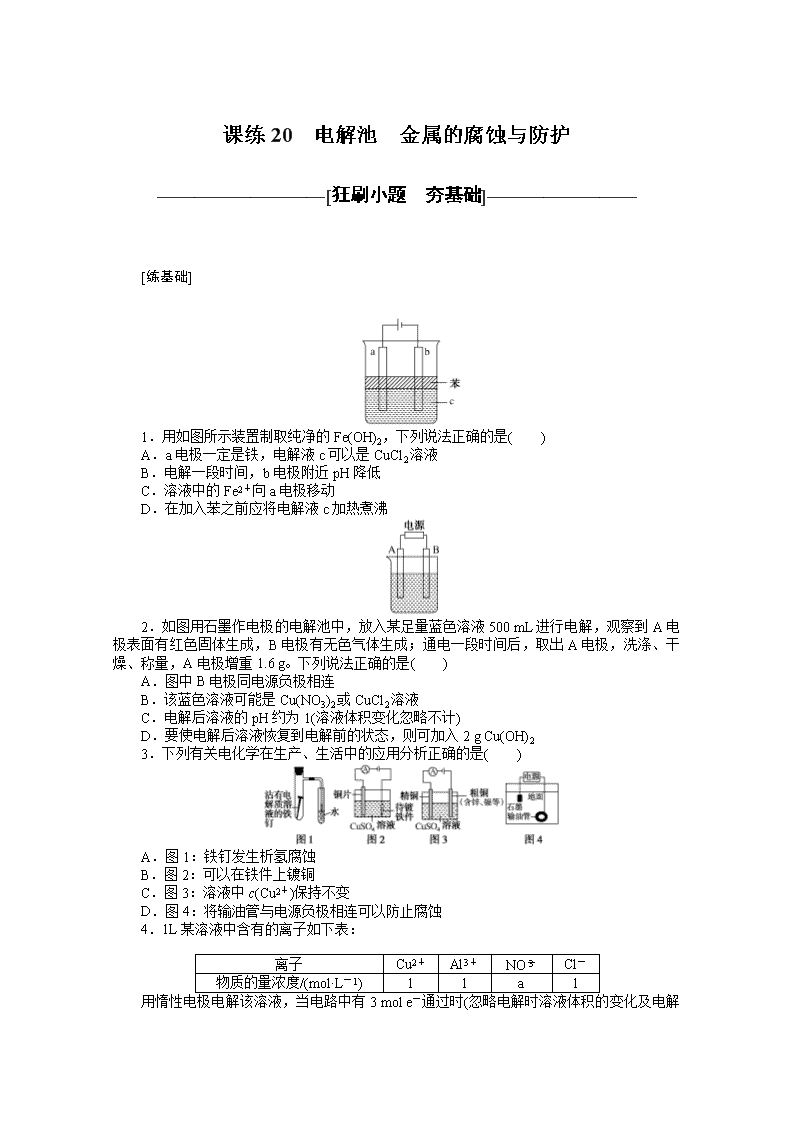
1.用如图所示装置制取纯净的Fe(OH)2,下列说法正确的是( )
A.a电极一定是铁,电解液c可以是CuCl2溶液
B.电解一段时间,b电极附近pH降低
C.溶液中的Fe2+向a电极移动
D.在加入苯之前应将电解液c加热煮沸
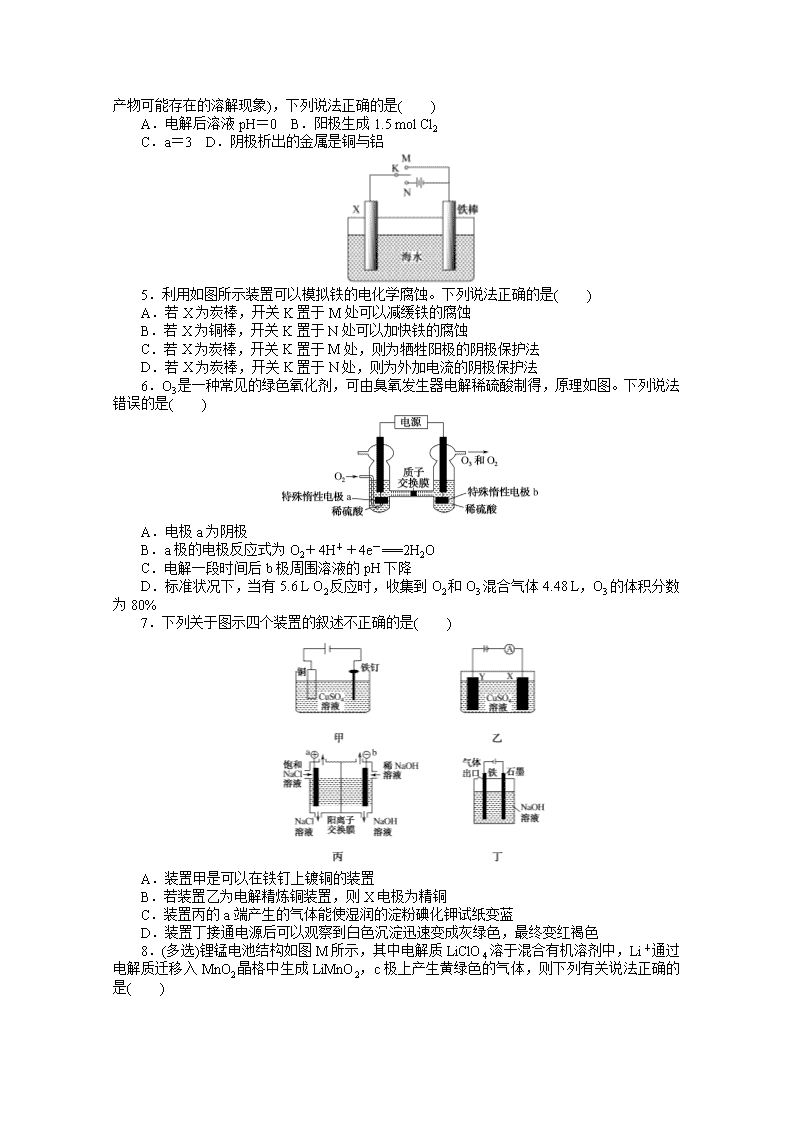
2.如图用石墨作电极的电解池中,放入某足量蓝色溶液500 mL进行电解,观察到A电极表面有红色固体生成,B电极有无色气体生成;通电一段时间后,取出A电极,洗涤、干燥、称量,A电极增重1.6 g。下列说法正确的是( )
A.图中B电极同电源负极相连
B.该蓝色溶液可能是Cu(NO3)2或CuCl2溶液
C.电解后溶液的pH约为1(溶液体积变化忽略不计)
D.要使电解后溶液恢复到电解前的状态,则可加入2 g Cu(OH)2
3.下列有关电化学在生产、生活中的应用分析正确的是( )
A.图1:铁钉发生析氢腐蚀
B.图2:可以在铁件上镀铜
C.图3:溶液中c(Cu2+)保持不变
D.图4:将输油管与电源负极相连可以防止腐蚀
4.1L某溶液中含有的离子如下表:
离子
Cu2+
Al3+
NO
Cl-
物质的量浓度/(mol·L-1)
1
1
a
1
用惰性电极电解该溶液,当电路中有3 mol e-通过时(
忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是( )
A.电解后溶液pH=0 B.阳极生成1.5 mol Cl2
C.a=3 D.阴极析出的金属是铜与铝
5.利用如图所示装置可以模拟铁的电化学腐蚀。下列说法正确的是( )
A.若X为炭棒,开关K置于M处可以减缓铁的腐蚀
B.若X为铜棒,开关K置于N处可以加快铁的腐蚀
C.若X为炭棒,开关K置于M处,则为牺牲阳极的阴极保护法
D.若X为炭棒,开关K置于N处,则为外加电流的阴极保护法
6.O3是一种常见的绿色氧化剂,可由臭氧发生器电解稀硫酸制得,原理如图。下列说法错误的是( )
A.电极a为阴极
B.a极的电极反应式为O2+4H++4e-===2H2O
C.电解一段时间后b极周围溶液的pH下降
D.标准状况下,当有5.6 L O2反应时,收集到O2和O3混合气体4.48 L,O3的体积分数为80%
7.下列关于图示四个装置的叙述不正确的是( )
A.装置甲是可以在铁钉上镀铜的装置
B.若装置乙为电解精炼铜装置,则X电极为精铜
C.装置丙的a端产生的气体能使湿润的淀粉碘化钾试纸变蓝
D.装置丁接通电源后可以观察到白色沉淀迅速变成灰绿色,最终变红褐色
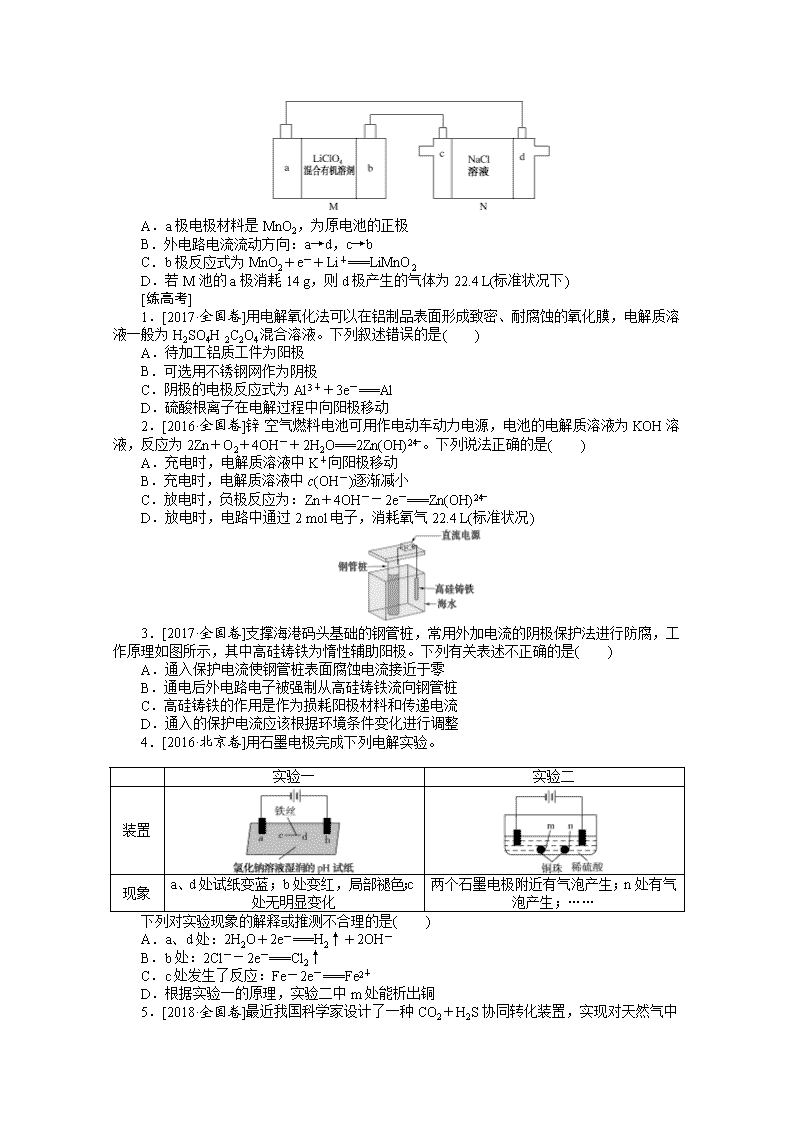
8.(多选)锂锰电池结构如图M所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中生成LiMnO2,c极上产生黄绿色的气体,则下列有关说法正确的是( )
A.a极电极材料是MnO2,为原电池的正极
B.外电路电流流动方向:a→d,c→b
C.b极反应式为MnO2+e-+Li+===LiMnO2
D.若M池的a极消耗14 g,则d极产生的气体为22.4 L(标准状况下)
[练高考]
1.[2017·全国卷]用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4H2C2O4混合溶液。下列叙述错误的是( )
A.待加工铝质工件为阳极
B.可选用不锈钢网作为阴极
C.阴极的电极反应式为Al3++3e-===Al
D.硫酸根离子在电解过程中向阳极移动
2.[2016·全国卷]锌空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O===2Zn(OH)。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为:Zn+4OH--2e-===Zn(OH)
D.放电时,电路中通过2 mol电子,消耗氧气22.4 L(标准状况)
3.[2017·全国卷]支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
4.[2016·北京卷]用石墨电极完成下列电解实验。
实验一
实验二
装置
现象
a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化
两个石墨电极附近有气泡产生;n处有气泡产生;……
下列对实验现象的解释或推测不合理的是( )
A.a、d处:2H2O+2e-===H2↑+2OH-
B.b处:2Cl--2e-===Cl2↑
C.c处发生了反应:Fe-2e-===Fe2+
D.根据实验一的原理,实验二中m处能析出铜
5.[2018·全国卷]最近我国科学家设计了一种CO2+H2S协同转化装置,
实现对天然气中CO2和H2S的高效去除。示意图如下所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTAFe2+-e-===EDTAFe3+
②2EDTAFe3++H2S===2H++S+2EDTAFe2+
该装置工作时,下列叙述错误的是( )
A.阴极的电极反应:CO2+2H++2e-===CO+H2O
B.协同转化总反应:CO2+H2S===CO+H2O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTAFe3+/EDTAFe2+,溶液需为酸性
[练模拟]
1.[2019·成都诊断]港珠澳大桥设计使用寿命为120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是( )
A.防腐原理主要是避免发生反应:2Fe+O2+2H2O===2Fe(OH)2
B.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池
C.采用外加电流的阴极保护法时需外接镁、锌等作辅助阳极
D.钢构件可采用不锈钢材料以减缓电化学腐蚀
2.[2019·昆明调研测试]某研究小组设计如下装置处理pH为5~6的污水。下列说法正确的是( )
A.阳极的电极反应式为:Fe-3e-===Fe3+
B.正极的电极反应式为:O2+2H2O+4e-===4OH-
C.若阴极转移2 mol电子,则负极消耗5.6 L CH4
D.污水中最终会产生Fe(OH)3,吸附污染物而形成沉淀
3.(多选)对氨基苯酚(HOC6H4NH2)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示。下列说法正确的是( )
A.电解时Pt电极应与直流电源的正极相连
B.电解时Pt电极上有H2放出
C.阴极的电极反应式为C6H5NO2+4e-+4H+===HOC6H4NH2+H2O
D.电解一段时间后,右侧硫酸的pH不变化
4.[2019·辽宁五校联考]高压直流电线路的瓷绝缘子经日晒雨淋容易出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽腐蚀,防护原理如图所示。下列说法错误的是( )
A.通电时,锌环是阳极,发生氧化反应
B.通电时,阴极上的电极反应为2H2O+2e-===H2↑+2OH-
C.断电时,锌环上的电极反应为Zn2++2e-===Zn
D.断电时,仍能防止铁帽被腐蚀
5.[2019·湖北部分重点中学考试]硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH-===B(OH),H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是( )
A.当电路中通过1 mol电子时,可得到1 mol H3BO3
B.将电源的正负极反接,工作原理不变
C.阴极室的电极反应式为:2H2O-4e-===O2↑+4H+
D.B(OH)穿过阴膜进入阴极室,Na+穿过阳膜进入产品室
————————[综合测评 提能力]—————————
一、选择题:本题共7小题,每小题2分,共14分。每小题只有一个选项符合题意。
1.[2019·河北石家庄期末]用石墨作电极,电解U形管中的饱和NaCl溶液(滴有酚酞溶液),装置如图。下列叙述正确的是( )
A.通电后,NaCl发生电离
B.通电一段时间后,阳极附近溶液先变红
C.当阳极生成0.1 mol气体时,整个电路中转移0.1 mol电子
D.电解饱和食盐水的总反应方程式为2NaCl+2H2O2NaOH+Cl2↑+H2↑
2.[2019·贵州贵阳三模]某实验小组模拟光合作用,采用电解CO2和H2O的方法制备CH3CH2OH和O2,装置如图所示。下列说法不正确的是( )
A.铂极为阳极,发生氧化反应
B.电解过程中,H+由交换膜左侧向右侧迁移
C.阴极的电极反应式为2CO2+12H++12e-===CH3CH2OH+3H2O
D.电路中转移2 mol电子时,铂极产生11.2 L O2(标准状况)
3.[2019·湖南益阳期末]氧化亚铜可作杀菌剂、陶瓷和搪瓷的着色剂、红色玻璃染色剂,电解法制备氧化亚铜的原理如图所示,下列说法不正确的是( )
A.理论上,除铜电极外,只需对电解液补充水,电解便可连续进行
B.溶液中生成Cu2O的离子方程式为2CuCl+H2O===Cu2O↓+6Cl-+2H+
C.N极的电极反应式为Cu-e-+3Cl-===CuCl
D.M与电源的负极相连,发生还原反应
4.某可充电电池的工作原理如图所示。已知a、b为惰性电极,溶液呈酸性。充电时右槽溶液颜色由绿色变为紫色。下列叙述不正确的是( )
注:V2+为紫色,V3+为绿色
VO2+为蓝色,VO为黄色
A.充电时,b极接直流电源负极,a极接直流电源正极
B.充电过程中,a极的电极反应式为:VO+2H++e-===VO2++H2O
C.放电时,H+从右槽迁移进左槽
D.放电过程中,左槽溶液颜色由黄色变为蓝色
5.验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
①
②
③
在Fe表面生成蓝色沉淀
试管内无明显变化
试管内生成蓝色沉淀
下列说法不正确的是( )
A.对比②③,可以判定Zn保护了Fe
B.对比①②,K3[Fe(CN)6]可能将Fe氧化
C.验证Zn保护Fe时不能用①的方法
D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
6.在潮湿的深层土壤中钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论认为厌氧细菌可促使SO与H或H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( )
A.正极反应式为O2+2H2O+4e-===4OH-
B.钢管腐蚀的产物中含有FeS、Fe(OH)2等
C.SO与H2反应可表示为4H2+SO-8e-S2-+4H2O
D.向钢中加入Cu制成合金可减缓钢管的腐蚀
7.[2019·合肥调研检测]图甲为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能,图乙是一种用惰性电极电解饱和食盐水的消毒液发生器。下列说法不正确的是( )
A.图甲的X点要与图乙中的a极连接
B.图乙中b极的电极反应式为:2Cl--2e-===Cl2↑
C.当N极消耗1 mol气体时,有2 mol H+通过离子交换膜
D.若有机废水中主要含有淀粉,则图甲中M极反应为:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
二、选择题:本题共3小题,每小题4分,共12分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得1分,有选错的得0分。
8.惰性电极电解尿素的碱性溶液制取N2和H2的装置如图所示(电解池中的隔膜仅阻止气体通过)。下列说法错误的是( )
A.A电极上发生氧化反应,当该电极生成2.24 L气体(标准状况)时,导线上转移了0.6NA电子
B.阳极气体产物与阴极气体产物的物质的量之比为3:1
C.若起始时加入电解池的原料配比=5,完全反应后,电解排出液中=3:1
D.B电极反应式为2H2O+2e-===H2↑+2OH-
9.SO2是主要的大气污染物,工业上用Na2SO3吸收SO2生成NaHSO3,再电解NaHSO3制取H2SO4,下列有关说法正确的是( )
A.B极是阴极
B.阴极的电极反应为2HSO+2e-===H2↑+2SO
C.阳极的电极反应为HSO+H2O-2e-===3H++SO
D.a是阴离子交换膜,b是阳离子交换膜
10.以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。下列说法正确的是( )
A.阳离子移向N电极
B.阴极反应为2Cl--2e-===Cl2↑
C.收集产品的区域是d
D.离子交换膜为质子交换膜
三、非选择题:本题共3小题。
11.(11分)[2019·山东平阴、商河等县区联考]如图所示,A、B、C、D均为石墨电极,E、F分别为短周期相邻两种活泼金属元素中的一种单质,且E能与NaOH溶液反应。按图示接通电路,反应一段时间。
(1)甲池是________(填“原电池”或“电解池”)装置,电极A的名称是________。
(2)C极为________(填“阴极”或“阳极”),电极反应式为________________________________。
(3)烧杯中溶液会变蓝的是________(填“a”或“b”)。
(4)F极的名称是________,电极反应式为________________________________________________________________________。
(5)甲池中总反应的离子方程式为________________________________________________________________________。
12.(14分)[2019·山东邹城一中月考]知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(电极均为石墨)。
(1)图甲中,X电极的反应式为__________________;电解一段时间后,气球b中的气体是________(填化学式),U形管________(填“左”或“右”)边的溶液变红。
(2)利用图乙制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分,则X极的电极反应式为________________________;该发生器中电解总反应的离子方程式为________________________________________________________________________。
(3)氯碱工业是高耗能产业,一种将电解池与氢氧燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质传输与转化关系如图丙所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
①燃料电池B中的电极反应式分别为负极:__________________,正极:
__________________。
②分析图丙可知,氢氧化钠的质量分数a%、b%、c%由大到小的顺序为______________________。
13.(12分)[2019·山东淄博实验中学月考]肼(N2H4)空气碱性燃料电池放电效率高,以该电池为电源模拟工业制烧碱,装置如图所示:
回答下列问题:
(1)乙装置的能量转化形式主要是________。
(2)乙装置中离子交换膜的类型是________(填序号)。
A.质子交换膜
B.阳离子交换膜
C.阴离子交换膜
(3)铂电极的名称是________(填“正极”“负极”“阴极”或“阳极”)。
(4)写出铜电极的电极反应式:________________________________________________________________________
(5)电解过程中,石墨电极附近溶液的pH减小,其原因是________________________________________________(用化学用语和必要的文字说明)。
(6)若铂电极上有4.48 L O2(标准状况)发生反应,装置的电流效率为80%,理论上制备纯度为96%的烧碱________g(结果保留1位小数)。
课练20 电解池 金属的腐蚀与防护
[狂刷小题 夯基础]
[练基础]
1.D A项,若电解液为CuCl2溶液,电解的总反应为Fe+Cu2+===Fe2++Cu,
无法得到Fe(OH)2,错误;B项,要得到Fe(OH)2,阴极即b电极是H2O电离出的H+放电,H+浓度减小,促进H2O的电离,使得溶液中OH-浓度增大,故pH升高,错误;C项,电解质溶液中Fe2+在a电极产生,应向b电极移动,错误;D项,加入苯之前应将电解液c加热煮沸,以赶出溶解在其中的O2,防止Fe(OH)2被氧化,正确。
2.C 根据现象判断蓝色溶液可为硫酸铜或硝酸铜溶液。电解时铜在阴极析出,氧气在阳极产生,根据A电极表面有红色固体生成,B电极有无色气体生成知B电极与电源的正极相连,A项错误;若电解CuCl2溶液,阳极产生黄绿色气体,B项错误;根据电路中通过电子数相等,阴极析出铜单质1.6 g÷64 g·mol-1=0.025 mol,知阳极生成0.012 5 mol O2,同时产生0.05 mol H+,c(H+)=0.1 mol·L-1,C项正确;电解时产生铜和氧气,应加入m(CuO)=1.6 g÷64 g·moL-1×80 g·mol-1=2 g,而不是加入Cu(OH)2,D错误。
3.D 图1,电解质溶液若呈酸性,则铁钉发生析氢腐蚀,电解质溶液若呈碱性或中性,则铁钉发生吸氧腐蚀,A项错误;图2,在铁件上镀铜,铜片作阳极,应与电源正极相连,待镀铁件作阴极,应与电源负极相连,B项错误;图3,电解精炼铜时,阳极上锌先放电,铜后放电,而阴极上是Cu2+放电,故电解质溶液中c(Cu2+)减小,C项错误;图4采用外加电流的阴极保护法,将输油管与电源负极相连,输油管作阴极,可以防止腐蚀,D项正确。
4.A 当电路中有3 mol e-通过时,阳极首先发生反应2Cl--2e-===Cl2↑,生成0.5 mol Cl2,然后发生反应2H2O-4e-===O2↑+4H+,生成2 mol H+,阴极首先发生反应Cu2++2e-===Cu,析出1 mol Cu,然后发生反应2H++2e-===H2↑,消耗1 mol H+,生成0.5 mol H2,最终溶液里得到1 mol H+,H+的浓度为1 mol·L-1,pH =0,故A正确,B错误;由溶液中电荷守恒可知:2c(Cu2+)+3c(Al3+)=c(NO)+c(Cl-),可求得c(NO)=4 mol·L-1,即a=4,故C错误;离子放电顺序Cu2+>H+>Al3+,没有Al生成,故D错误。
5.D K置于M处是原电池,X为炭棒,铁比碳活泼,作负极,铁失去电子,加速铁的腐蚀,A错误;K置于N处是电解池,铁作阴极被保护,可以减缓铁的腐蚀,B错误;K置于M处是原电池,Fe比碳活泼,铁作负极失去电子被腐蚀,这不是牺牲阳极的阴极保护法,若X为比铁活泼的金属,则铁作正极被保护,才是牺牲阳极的阴极保护法,C错误;开关K置于N处是电解池,铁作阴极被保护,这是外加电流的阴极保护法,D正确。
6.D 电极b上生成O2和O3,则电极b上发生失电子的氧化反应,则电极b为阳极,电极a为阴极,A项正确;电极a的电极反应式为O2+4e-+4H+===2H2O,B项正确;电极b上H2O失去电子,发生氧化反应生成O2、O3和H+,故电解一段时间后b极周围溶液的pH下降,C项正确;标准状况下,当有5.6 L氧气参加反应时,转移电子1 mol,设收集到氧气x mol,臭氧y mol,则有x+y=0.2,4x+6y=1,解得x=y=0.1,故O3的体积分数为50%,D项错误。
7.D 电镀时,镀层金属作阳极,待镀金属作阴极,电镀液为含有镀层金属阳离子的溶液,所以装置甲可实现在铁钉上镀铜,A正确;电解精炼铜时,纯铜作阴极,粗铜作阳极,乙装置X电极为阴极,用精铜作阴极,B正确;丙装置中a端接电源正极,为阳极,氯离子放电生成氯气,氯气能使湿润的淀粉碘化钾试纸变蓝,C正确;该装置有外接电源,铁为阴极,铁不溶解,D错误。
8.CD 根据题意知,M池为原电池,N池为电解池,c极产生的黄绿色气体为Cl2,则c电极为阳极,则M池中a极为负极,电极材料为Li,b极为正极,电极材料为MnO2。A项,a极为负极,电极材料为金属锂,错误;B项,Li为负极,MnO2为正极,原电池工作时,外电路的电流方向从正极到负极,即从b→c,d→a,错误;C项,b极为正极,电极材料MnO2被还原,电极反应式为MnO2+e-+Li+===LiMnO2,正确;D项,a极Li失电子,14 g Li→2 mol e-,d极反应为2H++2e-===H2↑,H2体积为 22.4 L(标准状况下),正确。
[练高考]
1.C A项,电解氧化法可以在铝的表面形成致密的Al2O3薄膜,即Al被氧化,故待加工铝质工件作阳极,正确;B项,电解质溶液显酸性,因此阴极材料可选用不易被酸腐蚀且能导电的不锈钢网,正确;C项,电解质溶液呈酸性,阴极是H+放电生成H2,错误;D项,电解时,电解池中阴离子向阳极移动,正确。
2.C A项,充电时,作为电解池分析,溶液中的阳离子移向阴极,错误;B项,题干中的反应为原电池反应,将其颠倒即为电解池反应,所以电解过程中有OH-生成,c(OH-)变大,错误;C项,负极为物质失去电子,即为Zn失去电子生成+2价的Zn2+,
结合总反应可知生成Zn(OH),正确;D项,总反应中,每通过4 mol e-时,消耗1 mol O2,所以通过2 mol e-时,消耗标准状况下氧气11.2 L,错误。
3.C A项,外加电流抑制金属电化学腐蚀产生的电流,故腐蚀电流接近于0,正确;B项,被保护的钢管桩作阴极,高硅铸铁作阳极,通电后,在电压作用下,电子被强制流向被保护的钢管桩,正确,C项,高硅铸铁作为惰性辅助阳极,不损耗,错误;D项,外加电流抑制金属电化学腐蚀产生的电流,不同环境条件下,金属受腐蚀程度不同,由于电化学腐蚀产生的电流不同,故通入的保护电流应根据环境条件变化进行调整,正确。
4.B A项,a处电极连电源的负极,作阴极,电极反应式为2H2O+2e-===H2↑+2OH-,铁丝中有电流通过,即b、d电极形成电解池,a、c电极形成电解池,d电极作阴极,发生的反应也为2H2O+2e-===H2↑+2OH-,正确;B项,b电极作阳极,发生的电极反应为2Cl--2e-===Cl2↑,同时还发生反应Cl2+H2OHCl+HClO,而使b处变红,且局部褪色,错误;C项,c极作阳极,铁失去电子生成Fe2+,正确;D项,根据实验一原理,实验二形成3个电解池,电解一段时间后,溶液中Cu2+浓度增大,m处作阴极,电极反应为Cu2++2e-===Cu,正确。
5.C A项,由图中可知,阴极上在酸性条件下CO2―→CO,发生还原反应,故电极反应式为CO2+2e-+2H+===CO+H2O,正确;B项,阳极上H2S―→S,结合两个已知反应,可得两极协同转化总反应为CO2+H2S===CO+H2O+S,正确;C项,由图可知ZnO@石墨烯电极上发生还原反应,故该极为阴极,接光伏电池的负极,石墨烯极为阳极,接光伏电池的正极,由于正极电势高于负极,故石墨烯上的电势更高,错误;D项,由于Fe3+和Fe2+在碱性条件下不能存在,故必须为酸性环境,正确。
[练模拟]
1.C 该桥体钢构件主要发生吸氧腐蚀,吸氧腐蚀的总反应为2Fe+2H2O+O2===2Fe(OH)2,防腐原理主要是避免发生该反应,A项正确;钢构件表面喷涂环氧树脂涂层,目的是将钢构件与空气、水隔绝,防止形成原电池,发生吸氧腐蚀,B项正确;采用牺牲阳极的阴极保护法时需外接镁、锌等作辅助阳极,C项错误;钢构件采用不锈钢,可以减缓电化学腐蚀,D项正确。
2.D 阳极上Fe失去两个电子生成Fe2+,A项错误;由于燃料电池中的电解质为熔融碳酸盐,故正极反应式应为O2+2CO2+4e-===2CO,B项错误;若阴极得到2 mol电子,则整个电路中通过2 mol电子,根据负极反应式:CH4-8e-+4CO===5CO2+2H2O可知负极消耗0.25 mol CH4,但题中没有给出CH4所处的状况,无法确定其体积,C项错误;电解池中阴极上H+放电产生OH-,污水中OH-与阳极生成的Fe2+反应生成Fe(OH)2,Fe(OH)2被污水中溶解的O2氧化成Fe(OH)3,吸附污染物而形成沉淀,D项正确。
3.AC 根据对氨基苯酚用硝基苯(C6H5NO2)电解还原制备,则硝基苯发生还原反应,而电解时阴极发生还原反应,则Pb合金电极为阴极,与直流电源负极相连,故Pt电极为阳极,与直流电源正极相连,A项正确;Pt电极为阳极,阳极上水电离出的OH-发生氧化反应,故Pt电极上有O2放出,B项错误;阴极上硝基苯发生还原反应,H+通过阳离子交换膜向阴极移动参与反应,电极反应式为C6H5NO2+4e-+4H+===HOC6H4NH2+H2O,C项正确;电解一段时间后,阳极区OH-浓度减小,H+向阴极区移动,阳极区溶剂水不断减少,硫酸的pH减小,D项错误。
4.C 通电时,锌环与电源正极相连,作阳极,发生氧化反应,A项正确;通电时,铁帽为阴极,发生还原反应:2H2O+2e-===H2↑+2OH-,B项正确;断电时,形成原电池,锌环为负极,发生氧化反应:Zn-2e-===Zn2+,C项错误;断电时,形成原电池,铁帽为正极,此为牺牲阳极的阴极保护法,仍能防止铁帽被腐蚀,D项正确。
5.A 电解时,左侧石墨电极为阳极,右侧石墨电极为阴极,阳极上H2O失电子生成O2和H+,即2H2O-4e-===O2↑+4H+,阴极上H2O得电子生成H2和OH-,即2H2O+2e-===H2↑+2OH-,当电路中通过1 mol电子时,阳极生成1 mol H+,H+通过阳膜进入产品室,与通过阴膜进入产品室的B(OH)反应生成1 mol H3BO3,A项正确;电源正负极反接后,左侧石墨电极为阴极,阴极反应式为:2H++2e-===H2↑,H+被消耗,无法移向产品室,不能生成H3BO3,B项错误;结合上述分析可知,阴极反应式为2H2O+2e-===H2↑+2OH-,C项错误;电解时原料室中Na+穿过阳膜进入阴极室,B(OH)穿过阴膜进入产品室,D项错误。
[综合测评 提能力]
1.D 本题考查电解饱和NaCl溶液的装置及工作原理。NaCl溶于水时,在水分子作用下发生电离,不需要通电,A错误;阳极反应式为2Cl--2e-===Cl2↑,产生黄绿色气体,阳极附近溶液不变红,B错误;阳极上生成0.1 mol Cl2时,电路中转移0.2 mol电子,C错误;电解饱和食盐水时,阳极上析出Cl2,阴极上析出H2,总反应方程式为2NaCl+2H2O2NaOH+Cl2↑+H2↑,D正确。
2.B 本题考查电解原理及其应用。由图可知,铂极与电源的正极相连,则铂极是阳极,发生氧化反应,A正确;电解时,阳离子向阴极移动,则H+由交换膜右侧向左侧迁移,B错误;阴极上CO2被还原生成CH3CH2OH,电极反应式为2CO2+12H++12e-===CH3CH2OH+3H2O,C正确;铂极是阳极,电极反应式为2H2O-4e-===4H++O2↑,转移2 mol电子时生成0.5 mol O2,在标准状况下的体积为11.2 L,D正确。
3.B 本题考查电解法制备氧化亚铜的原理。由图示可知电解池的总反应为2Cu+H2OCu2O+H2↑,因此理论上,除铜电极外,只需对电解液补充水,电解便可连续进行,A正确;溶液中生成Cu2O的离子方程式为2CuCl+2OH-===Cu2O+6Cl-+H2O,B错误;N极的电极反应式为Cu-e-+3Cl-===CuCl,C正确;M为阴极,与电源负极相连,发生还原反应,D正确。
4.B “充电时右槽溶液颜色由绿色变为紫色”说明充电时右槽发生反应:V3++e-===V2+,为还原反应,因此右槽为阴极区,b极接电源负极,A项正确;充电时左槽发生氧化反应:VO2+-e-+H2O===VO+2H+,B项错误;放电时,左槽反应为VO+2H++e-===VO2++H2O,溶液颜色由黄色变蓝色,H+从右槽进入左槽,C、D项正确。
5.D ②中Zn作负极,发生氧化反应生成Zn2+,Fe作正极被保护,所以取出的少量Fe附近的溶液中滴入铁氰化钾溶液,试管内无明显变化。但③中没有Zn保护Fe,Fe在酸性环境中发生析氢腐蚀,Fe作负极被氧化生成Fe2+,所以取出的少量Fe附近的溶液中滴入铁氰化钾溶液,生成蓝色沉淀,对比②③可知Zn保护了Fe,A项正确;①与②的区别在于:前者是将铁氰化钾溶液直接滴入烧杯中,而后者是在取出的少量Fe附近的溶液中滴加铁氰化钾溶液,①中出现了蓝色沉淀,说明有Fe2+生成,对比分析可知,可能是铁氰化钾氧化Fe生成了Fe2+,B项正确;通过上述分析可知,验证Zn保护Fe时不能用①的方法,C项正确;若将Zn换成Cu,铁氰化钾仍会将Fe氧化为Fe2+,在铁的表面同样会生成蓝色沉淀,所以无法判断Fe2+是不是负极产物,即无法判断Fe与Cu的活泼性,D项错误。
6.B 根据题中所给信息,潮湿的深层土壤中钢管发生厌氧腐蚀,则正极反应式为2H2O+2e-===H2↑+2OH-,A项错误;负极反应式为Fe-2e-===Fe2+,厌氧细菌促使SO与H或H2反应生成S2-,S2-及正极上生成的OH-与Fe2+可分别生成FeS、Fe(OH)2,B项正确;SO与H2反应可表示为4H2+SOS2-+4H2O,C项错误;向钢中加入铜,发生电化学腐蚀时,铜作正极,Fe作负极,从而加速钢管的腐蚀,D项错误。
7.C 图甲中N极上O2转化为H2O,发生还原反应,则N极为正极,M极为负极,图乙通过电解饱和食盐水获得消毒液,则a极析出H2,b极析出Cl2,a极为阴极,b极为阳极,电解池的阳极与电源正极相连,电解池的阴极与电源负极相连,故X点与a极相连,A项正确;图乙中b极析出氯气,电极反应式为:2Cl--2e-===Cl2↑,B项正确;根据O2+4e-+4H+===2H2O,当N极消耗1 mol气体时,转移4 mol电子,故有4 mol H+通过离子交换膜,C项错误;若有机废水中主要含有淀粉,则图甲中M极上淀粉转化为CO2,电极反应为:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+,D项正确。
8.B 电解时,根据氮元素和氢元素的化合价变化可知,A电极为阳极,发生氧化反应,阳极反应式为CO(NH2)2+8OH--6e-===CO+N2↑+6H2O;B电极为阴极,发生还原反应,阴极反应式为2H2O+2e-===H2↑+2OH-,根据阳极反应式可知,当该极生成2.24 L气体(标准状况)即0.1 mol N2时,转移0.6NA个电子,A、D正确;结合阴、阳极反应式与得失电子守恒可知,阳极气体产物与阴极气体产物的物质的量之比为1:3,B错误;
若起始时加入电解池的原料配比=5,则1 mol尿素与2 mol KOH反应,生成1 mol CO,剩余3 mol OH-,所以排出液=3:1,C正确。
9.BC 由图可知,阴极的电极反应为2HSO+2e-===H2↑+2SO,A为阴极,电解池中间为NaHSO3溶液,a为阳离子交换膜,Na+通过a膜从中间向左迁移,B为阳极,阳极的电极反应为HSO+H2O-2e-===3H++SO,HSO通过b膜从中间向右迁移。故选BC。
10.AC 从题干获得信息,该装置为电解池,根据电解知识,判断产生氢气的一极为阴极,推断出N电极为阴极,M电极为阳极。阳离子向阴极即N电极移动,A项正确;2Cl--2e-===Cl2↑为阳极反应,阴极反应为2H2O+2e-===H2↑+2OH-,B项错误;原料应从a口进入,从d口出,因此收集产品应从d区域,C项正确;本题中采用阳离子交换膜,使阳极[(CH3)4N]+移向阴极与OH-结合,得到产物,D项错误。
11.答案:(1)电解池 阳极
(2)阳极 2Cl--2e-===Cl2↑
(3)a
(4)正极 2H2O+2e-===H2↑+2OH-
(5)2Cu2++2H2O2Cu+O2↑+4H+
解析:E、F分别为短周期相邻两种活泼金属元素中的一种单质,且E能与NaOH溶液反应,则E为Al,F为Mg。
(1)Al、Mg、NaOH溶液组成的原电池中,Al失去电子被氧化生成AlO,则E(Al)电极为负极,F(Mg)电极为正极;甲池和中间U形管均形成电解池,根据电极的连接方式可知,电极A为阳极。
(2)U形管是电解池装置,D极连接Al电极(负极),作阴极,故电极C为阳极,Cl-在阳极上发生氧化反应生成Cl2,电极反应式为2Cl--2e-===Cl2↑。
(3)电极C上Cl-发生氧化反应生成Cl2,Cl2通过导管进入淀粉-KI溶液,发生反应:2KI+Cl2===2KCl+I2,反应生成的I2使淀粉溶液变蓝,故a烧杯中溶液会变蓝。
(4)F电极为原电池的正极,发生还原反应,电极反应式为2H2O+2e-===H2↑+2OH-。
(5)甲池中A、B电极材料均为石墨,是惰性电极,电解CuSO4溶液时,阴极上Cu2+放电生成Cu,阳极上OH-放电生成O2,故电池总反应为2Cu2++2H2O2Cu+O2↑+4H+。
12.答案:(1)2Cl--2e-===Cl2↑ H2 右
(2)2H2O+2e-===2OH-+H2↑ Cl-+H2OClO-+H2↑
(3)①2H2+4OH--4e-===4H2O O2+2H2O+4e-===4OH-
②b%>a%>c%
解析:本题考查原电池、电解池中电极和电池反应式的书写等。
(1)根据电子移动方向可知,X是阳极,Cl-发生氧化反应生成Cl2,电极反应式为2Cl--2e-===Cl2↑。Y是阴极,电极反应式为2H2O+2e-===2OH-+H2↑,反应生成OH-,则Y极附近呈碱性,溶液变成红色。
(2)图乙装置上端管与大气相通,X电极应产生无毒的H2,则X电极是阴极,电极反应式为2H2O+2e-===2OH-+H2↑。阳极产生Cl2,并与阴极产生的NaOH反应生成NaClO,故该发生器中电解总反应为Cl-+H2OClO-+H2↑。
(3)①A为电解饱和NaCl溶液装置,则Y为H2,B为氢氧燃料电池,其中电解质溶液是NaOH溶液,H2在负极发生氧化反应,O2在正极发生还原反应,故负极反应式为2H2+4OH--4e-===4H2O,正极反应式为O2+2H2O+4e-===4OH-。
②图丙中,氢氧燃料电池的负极消耗OH-,则NaOH浓度:a%>c%。氢氧燃料电池中,正极上生成NaOH,则NaOH浓度:b%>a%,故NaOH的质量分数:b%>a%>c%。
13.答案:(1)电能转化为化学能 (2)B (3)正极
(4)N2H4+4OH--4e-===N2↑+4H2O
(5)石墨电极发生反应:2Cl--2e-===Cl2↑,Cl2与水发生反应:Cl2+H2OHCl+
HClO,溶液的酸性增强
(6)26.7
解析:本题考查燃料电池的原理和电解原理的应用。
(1)装置甲是肼(N2H4)空气碱性燃料电池,则装置乙是电解池,能量转化形式主要是电能转化为化学能。
(2)N2H4在铜电极被氧化生成N2,则铜电极是负极,根据电极连接方式可知,铁是阴极,石墨是阳极。铁电极(阴极)反应式为2H2O+2e-===2OH-+H2↑,阴极产生OH-,石墨电极(阳极)反应式为2Cl--2e-===Cl2↑,阳极消耗Cl-,为保持溶液呈电中性且制取烧碱,Na+应透过离子交换膜向左侧迁移,阴极室中得到NaOH溶液,故离子交换膜是阳离子交换膜。
(5)电解过程中,石墨电极(阳极)上生成Cl2,Cl2与水发生反应:Cl2+H2OHCl+HClO,则石墨电极附近溶液的酸性增强,pH减小。
(6)铂电极反应式为O2+2H2O+4e-===4OH-,铂电极上有4.48 L O2(标准状况)发生反应,即消耗0.2 mol O2,电路中转移0.8 mol电子,装置的电流效率为80%,则电子的有效利用量为0.8 mol×80%=0.64 mol。制取1 mol NaOH时理论上转移电子的物质的量为1 mol,则制取的NaOH的物质的量为0.64 mol,故理论上制备纯度为96%的烧碱的质量为≈26.7 g。