- 3.49 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
2
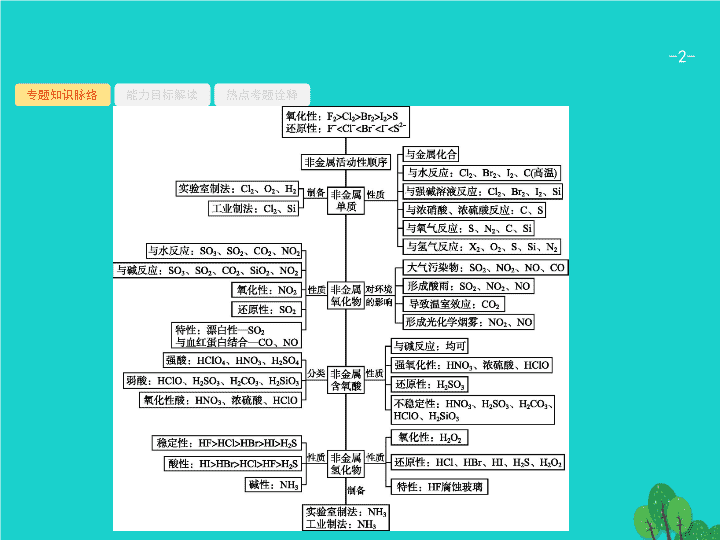
讲 常见的非金属元素及其化合物
-
2
-
专题知识脉络
能力目标解读
热点考题诠释
-
3
-
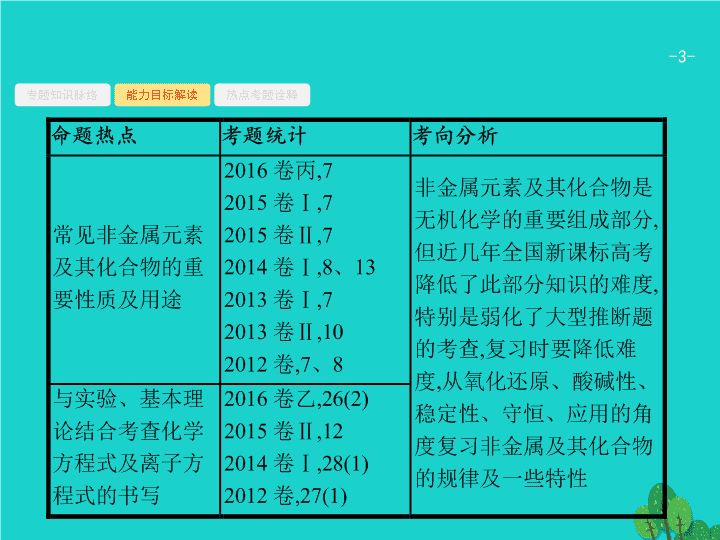
专题知识脉络
能力目标解读
热点考题诠释
-
4
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
3
1
.(2015
课标全国
Ⅰ
)
我国清代《本草纲目拾遗》中记叙无机药物
335
种
,
其中
“
强水
”
条目下写道
:“
性最烈
,
能蚀五金
……
其水甚强
,
五金八石皆能穿滴
,
惟玻璃可盛。
”
这里的
“
强水
”
是指
(
)
A.
氨水
B.
硝酸
C.
醋
D.
卤水
答案
解析
解析
关闭
该强水能溶解五金
,
说明具有酸性和强氧化性
,
且不与玻璃反应
,
则该物质为硝酸
,
即
B
项正确。
答案
解析
关闭
B
-
5
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
3
2
.(2015
课标全国
Ⅱ
)
海水开发利用的部分过程如图所示。下列说法错误的是
(
)
A.
向苦卤中通入
Cl
2
是为了提取溴
B.
粗盐可采用除杂和重结晶等过程提纯
C.
工业生产中常选用
NaOH
作为沉淀剂
D.
富集溴一般先用空气和水蒸气吹出单质溴
,
再用
SO
2
将其还原吸收
答案
解析
解析
关闭
答案
解析
关闭
-
6
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
3
3
.(2016
全国乙
,
节选
)
氮的氧化物
(
NO
x
)
是大气污染物之一
,
工业上在一定温度和催化剂条件下用
NH
3
将
NO
x
还原生成
N
2
。某同学在实验室中对
NH
3
与
NO
2
反应进行了探究。回答下列问题
:
氨气与二氧化氮的反应
将上述收集到的
NH
3
充入注射器
X
中
,
硬质玻璃管
Y
中加入少量催化剂
,
充入
NO
2
(
两端用夹子
K
1
、
K
2
夹好
)
。在一定温度下按图示装置进行实验。
-
7
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
3
-
8
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
3
-
9
-
热点一
热点二
热点三
热点四
常见非金属单质的性质及应用
有关非金属单质性质及应用的思维路径
-
10
-
热点一
热点二
热点三
热点四
问题探究
1
.
常见非金属单质有哪些物理性质和化学性质
?
-
11
-
热点一
热点二
热点三
热点四
-
12
-
热点一
热点二
热点三
热点四
联系与应用
:
我们不仅要熟记上述规律和特性
,
最重要的是学以致用
,
如
:
(1)Cl
2
与碱反应
,
可以用碱性溶液吸收尾气中的
Cl
2
;
(2)
氯气溶于水
,
不能用排水法收集氯气
,
可以用向上排空气法或排饱和食盐水法收集
;
(3)
氯气具有强氧化性
,
可以用湿润的淀粉碘化钾试纸检验。
2
.
常见非金属单质如何制备
?
(1)Cl
2
:
-
13
-
热点一
热点二
热点三
热点四
-
14
-
热点一
热点二
热点三
热点四
例
1
(2015
四川资阳检测
)
利用如图所示装置制备饱和氯水
,
为探究新制饱和氯水的组成和性质而进行了科学实验
:
先对制得的氯水进行观察
,
再用胶头滴管将该氯水逐滴滴入盛有含酚酞的
NaOH
溶液的试管中
,
边滴边振荡
,
并连续观察现象
,
发现溶液的红色逐渐褪去而得无色溶液。据此回答
:
-
15
-
热点一
热点二
热点三
热点四
(1)C
中的试剂是
;
仪器
b
的名称为
,b
中发生反应的离子方程式为
。
(2)
写出新制饱和氯水中含有氯元素物质的化学式
:
。氯水长时间放置
,
氯水中的成分就会发生变化
,
能快速判断氯水中含有较多
Cl
2
的方法是
。
(3)
根据预测
,
实验中溶液红色褪去的原因可能有两种
,
请用简要的文字补充
:
①
氯水与
NaOH
反应
,
碱性减弱红色褪去。
②
。
-
16
-
热点一
热点二
热点三
热点四
(4)
通过实验进一步探究溶液红色褪去的原因究竟是上述中的
①
还是
②
。
【实验步骤】
①
取上述实验后试管内的无色溶液
3
mL
盛于另一支洁净的试管中
;
②
,
振荡试管。
【现象与结论】
①
若
,
则证明溶液红色褪去的原因是
①
而不是
②
。
②
若
,
则证明溶液红色褪去的原因是
②
而不是
①
。
-
17
-
热点一
热点二
热点三
热点四
(5)
为了从新制氯水中制得较高浓度的
HClO
,
可向氯水中加入的试剂是
。
A.CaCO
3
B.NaHSO
3
C.Na
2
CO
3
D.Ca(OH)
2
分析推理
解答性质验证型实验题的关键点是结合题目要求和所给的仪器、装置以及试剂了解命题意图。一般思路是
(1)
结合题干明确实验目的
(
该实验要求做什么
);(2)
结合装置图或操作过程理解实验设计思路及每一个装置的设计意图
;(3)
了解题目有关信息及每步实验原理
;(4)
明确解答问题的切入点
,
即试题给我们设置了什么样的问题情境
,
要求我们回答什么问题
;(5)
分析并排除每步实验的干扰因素。
-
18
-
热点一
热点二
热点三
热点四
-
19
-
热点一
热点二
热点三
热点四
(2)
化学平衡的特点及移动
:
Cl
2
+H
2
O
HCl+HClO
是一个可逆反应
,
反应存在限度。要想得到较高浓度的
HClO
需改变条件使平衡发生移动
,
同时还应注意在移动过程中不要引入新的杂质。
(3)
对反应原理的假设论证
:
对于某一个现象有多种假设原因时
,
应根据不同假设的差异点来设计实验证明。题目中红色褪去可能是
NaOH
被消耗了
,
也可能是
HClO
的漂白作用
,
两种假设下的不同之处在于
NaOH
的有无
,
这便是设计实验的突破口。
-
20
-
热点一
热点二
热点三
热点四
-
21
-
热点一
热点二
热点三
热点四
题后反思
(1)
根据反应装置选择合理的反应
;
对于
Cl
2
的实验室制备除掌握课本上的
MnO
2
与浓盐酸外
,
还需拓展到
KMnO
4
与浓盐酸
,
区别在于有无加热装置。
(2)
设计实验方案时应注意简约性原则。
(3)
注意化学用语的规范性
,
例如不能将
“
NaOH
溶液
”
写成
“
NaOH
”
。
-
22
-
热点一
热点二
热点三
热点四
对点训练
1
下列叙述中正确的是
。
①
溴水中加入足量碘化钾固体
,
溶液变为无色
②
氢气在氯气中燃烧
,
与空气接触有白雾生成
③
氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
④
氯气可以使湿润的有色布条褪色
,
说明氯气具有漂白作用
⑤
如果发生了氯气泄漏
,
可以用湿毛巾或蘸有纯碱水的毛巾捂住口鼻撤离
⑥
Si
是制造太阳能电池和光导纤维的主要原料
⑦
C
可以把
SiO
2
中的
Si
和
H
2
O
中的
H
还原出来
⑧
S
在过量氧气中燃烧生成
SO
3
-
23
-
热点一
热点二
热点三
热点四
-
24
-
热点一
热点二
热点三
热点四
-
25
-
热点一
热点二
热点三
热点四
常见非金属氧化物的性质
有关非金属氧化物性质的思维路径
-
26
-
热点一
热点二
热点三
热点四
问题探究
常见非金属氧化物有哪些性质
?
-
27
-
热点一
热点二
热点三
热点四
-
28
-
热点一
热点二
热点三
热点四
-
29
-
热点一
热点二
热点三
热点四
联系与应用
:
(1)
气体收集
:
①
NO
与氧气反应
,
所以不能用排空气法收集
,
可用排水法收集
;
②
CO
2
、
SO
2
、
NO
2
均与水反应
,
所以不能用排水法收集
,
可以用向上排空气法收集。
(2)
尾气处理
:
除
CO
外
,
大多数非金属氧化物均能与强碱反应
,
所以可以用强碱溶液吸收
,CO
可用点燃的方法除去。
(3)
检验
:
①
依据
SO
2
具有较强还原性、漂白性
,
检验
SO
2
常用方法
:a.
通入酸性高锰酸钾溶液
,
溶液褪色
;b.
通入品红溶液
,
溶液褪色
,
加热后恢复红色。
②
检验
CO
2
常用方法
:
通入澄清石灰水
,
石灰水变浑浊
,
但要排除
SO
2
的干扰。
(4)
除杂
:
依据
SO
2
具有较强还原性、
H
2
SO
3
的酸性强于
H
2
CO
3
,
所以除去
CO
2
中的
SO
2
常用方法
:a.
通过盛有酸性高锰酸钾溶液的洗气瓶
;b.
通过盛有饱和
NaHCO
3
溶液的洗气瓶。
-
30
-
热点一
热点二
热点三
热点四
例
2
(2014
北京理综
)
碳、硫的含量影响钢铁性能
,
碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体
,
再用测碳、测硫装置进行测定。
(1)
采用装置
A,
在高温下
x
g
钢样中碳、硫转化为
CO
2
、
SO
2
。
①
气体
a
的成分是
。
-
31
-
热点一
热点二
热点三
热点四
(2)
将气体
a
通入测硫酸装置中
(
如图
),
采用滴定法测定硫的含量。
①
H
2
O
2
氧化
SO
2
的化学方程式
:
。
②
用
NaOH
溶液滴定生成的
H
2
SO
4
,
消耗
z
mL
NaOH
溶液
,
若消耗
1 mL
NaOH
溶液相当于硫的质量为
y
g,
则该钢样中硫的质量分数
:
。
-
32
-
热点一
热点二
热点三
热点四
(3)
将气体
a
通入测碳装置中
(
如图
),
采用重量法测定碳的含量。
①
气体
a
通过
B
和
C
的目的是
。
②
计算钢样中碳的质量分数
,
应测量的数据是
。
-
33
-
热点一
热点二
热点三
热点四
分析推理
提纯非金属元素氧化物的方法。
①
杂变纯
:CO
2
中混有的
SO
2
或
HCl
气体可通过饱和
NaHCO
3
溶液除去
,SO
2
中混有的
HCl
气体可通过饱和
NaHSO
3
溶液除去
,NO
中混有的
NO
2
可通过水除去
,CO
2
中混有的
CO
可通过炙热氧化铜除去。
②
CO
2
中混有的
SO
2
可通过氧化剂利用
SO
2
的还原性除去。
-
34
-
热点一
热点二
热点三
热点四
答案
(1)
①
O
2
、
SO
2
、
CO
2
②
Fe
3
O
4
SO
2
(3)
①
排除
SO
2
对
CO
2
测定的干扰
②
吸收
CO
2
前后吸收瓶的质量
-
35
-
热点一
热点二
热点三
热点四
评分细则警示
(1)
分子式书写错误
,
不配平
,“ ”
写成
“——”,
写成离子方程式均不得分
;(3)
①
一定要突出吸收
SO
2
;
②
问突出吸收
CO
2
前后及吸收瓶的质量。
-
36
-
热点一
热点二
热点三
热点四
对点训练
2
物质间的转化关系错综复杂。
X
、
Y
、
Z
三种物质间的转化关系如图所示
(
各物质之间通过一步反应转化
),
下列不符合该转化关系的是
(
)
答案
解析
解析
关闭
答案
解析
关闭
-
37
-
热点一
热点二
热点三
热点四
常见无机酸的重要规律及特性
有关常见无机酸的重要性质及特征的思维路径
-
38
-
热点一
热点二
热点三
热点四
问题探究
1
.
如何判断及应用酸性强弱规律
?
(1)
酸性强弱
:
①
最高价含氧酸的酸性强弱取决于元素非金属性强弱
,
如根据酸性
:HClO
4
>H
2
SO
4
>H
3
PO
4
>H
2
CO
3
,
可知非金属性
:Cl>S>P>C
。
②
记忆酸性强弱
:H
2
SO
4
>H
2
SO
3
>H
2
CO
3
>
HClO
;
六大强酸
:HNO
3
、
H
2
SO
4
、
HClO
4
、
HCl
、
HBr
、
HI,
其余的酸大多数为弱酸。
-
39
-
热点一
热点二
热点三
热点四
③
设计实验验证酸性强弱
:
a.
可利用复分解反应中
“
强酸制弱酸
”
的规律判断
,
如
:Na
2
SiO
3
+H
2
O+CO
2
H
2
SiO
3
↓+Na
2
CO
3
、
Ca(
ClO
)
2
+H
2
O+CO
2
2HClO+CaCO
3
↓;
b.
利用盐类水解
:Na
2
CO
3
的碱性强于
Na
2
SO
3
的
,
可知酸性
:H
2
SO
3
>H
2
CO
3
。
(2)
应用
:
①
造气
:CO
2
、
SO
2
、
H
2
S
气体分别可用
Na
2
CO
3
、
Na
2
SO
3
、
FeS
与硫酸反应制得
;
②
除杂
:CO
2
中的
HCl
气体可通过通入饱和碳酸氢钠溶液除去。
-
40
-
热点一
热点二
热点三
热点四
2
.
酸与金属反应有何特点
?
(1)
非氧化性酸
(
如盐酸、稀硫酸
)
与活动性排在
H
前面的金属反应生成氢气。
(2)
强氧化性酸
(
如
HNO
3
、浓硫酸
)
与金属反应
,
一般不会生成氢气
;
金属与浓硝酸反应一般生成
NO
2
,
与稀硝酸反应一般生成
NO,
与浓硫酸在加热条件下反应一般生成
SO
2
。
3
.
常见酸的物理特性有哪些
?
(1)
除硫酸外
,
其他常见酸大多数具有挥发性
,
如浓盐酸、浓氢溴酸、浓氢碘酸、浓硝酸等敞口放置均有白雾出现
,
遇氨气能冒白烟。
(2)H
2
SiO
3
是唯一难溶性酸。
-
41
-
热点一
热点二
热点三
热点四
4
.
常见酸的化学特性有哪些
?
(1)
硝酸特性
:
①
浓、稀硝酸均具有强氧化性
,
与
Na
2
S
、
SO
2
、
Na
2
SO
3
等还原剂发生氧化还原反应。
②
浓硝酸与
Cu(
足量
)
、
Zn(
足量
)
等反应
,
随着反应的进行
,
产物会发生变化。
(2)
浓硫酸特性
:
①
浓硫酸具有吸水性、脱水性、强氧化性。
②
浓硫酸与
Cu(
足量
)
反应
,
硫酸和铜均剩余
;
浓硫酸与
Zn(
足量
)
等反应
,
随着反应的进行
,
产物会发生变化。
③
SO
2
、
CO
、
H
2
具有还原性
,
但不与浓硫酸反应
,
所以能用浓硫酸干燥。
(3)
常温下
,
铁、铝遇浓硫酸、浓硝酸钝化。
(4)HNO
3
、
HClO
见光受热易分解。
-
42
-
热点一
热点二
热点三
热点四
-
43
-
热点一
热点二
热点三
热点四
例
3
向
200 mL
稀硝酸中加入
11.2 g
铁粉
,
充分反应后
,
铁粉全部溶解并放出
NO,
溶液质量增加
7.0 g,
则所得溶液中
Fe
3+
的物质的量浓度约为
(
)
A.0.1 mol·L
-1
B.0.2 mol·L
-1
C.0.3 mol·L
-1
D.0.4 mol·L
-1
-
44
-
热点一
热点二
热点三
热点四
分析推理
(1)
金属与硝酸反应的计算模板
:
-
45
-
热点一
热点二
热点三
热点四
(2)
三大守恒在解答
HNO
3
有关计算中的应用
:
①
原子守恒法
:HNO
3
与金属反应时
,
一部分
HNO
3
起酸的作用
,
以
的形式存在于溶液中
;
一部分作为氧化剂转化为还原产物
,
这两部分中氮原子的总物质的量等于反应消耗的
HNO
3
中氮原子的物质的量。
②
得失电子守恒
:HNO
3
与金属的反应属于氧化还原反应
,HNO
3
中氮原子得电子的物质的量
=
金属失电子的物质的量。
③
电荷守恒
:HNO
3
过量时
,
反应后溶液中
(
忽略
OH
-
)
答案
A
-
46
-
热点一
热点二
热点三
热点四
对点训练
3
中学化学中有很多
“
规律
”
都有适用范围
,
下列根据有关
“
规律
”
推出的结论正确的是
(
)
-
47
-
热点一
热点二
热点三
热点四
答案
D
解析
盐酸的制备不一定通过复分解反应
,
也可以使用氧化还原反应
,
如
2HclO 2HCl+O
2
↑,A
项错误
;
常温下铝遇浓硫酸、浓硝酸发生钝化
,B
项错误
;
氨分子间可形成氢键
,
其沸点高于
PH
3
,C
项错误
;
根据溶解平衡可知
:
溶解度小的沉淀易向溶解度更小的沉淀转化
,
CuS
比
ZnS
更难溶
,D
项正确。
-
48
-
热点一
热点二
热点三
热点四
常见非金属元素形成离子的检验
常见非金属离子检验的思维路径
-
49
-
热点一
热点二
热点三
热点四
问题探究
如何鉴别常见非金属离子
?
-
50
-
热点一
热点二
热点三
热点四
-
51
-
热点一
热点二
热点三
热点四
-
52
-
热点一
热点二
热点三
热点四
-
53
-
热点一
热点二
热点三
热点四
-
54
-
热点一
热点二
热点三
热点四
-
55
-
热点一
热点二
热点三
热点四
对点训练
4
在
Na
+
浓度为
0.5 mol·L
-1
的某澄清透明溶液中
,
还可能含有下表中的若干种离子
:
取该溶液
100
mL
进行如下实验
(
气体体积在标准状况下测定
):
-
56
-
热点一
热点二
热点三
热点四
-
57
-
热点一
热点二
热点三
热点四
请回答下列问题
:
(1)
能否根据
“
澄清透明溶液
”
判断
Fe
3+
不存在
?
(
填
“
能
”
或
“
否
”),
理由是
。
(2)
依据步骤
Ⅰ
能确定一定不存在的阳离子是
。该步骤中生成沉淀的离子方程式为
。
(3)
通过步骤
Ⅰ
、
Ⅱ
、
Ⅲ
和必要计算
,
填写下表中阴离子的浓度
(
能计算出的填写计算结果
,
一定不存在的离子填
“0”,
不能确定是否存在的离子填
“?”)
-
58
-
热点一
热点二
热点三
热点四
(4)
判断
K
+
是否存在
,
若存在求其最小浓度
,
若不存在
,
说明理由
。
(5)
为了检验可能存在的阴离子
,
取少量
Ⅱ
所得的滤液于试管中
,
加入硫酸亚铁溶液
,
产生无色气体
,
气体在空气中变红棕色。实验结论是
,
写出溶液中反应的离子方程式
:
。
-
59
-
热点一
热点二
热点三
热点四
-
60
-
热点一
热点二
热点三
热点四
-
61
-
1
2
3
4
1
.(2016
山东曲师大附中模拟
)
某溶液中含有的溶质是
FeBr
2
、
FeI
2
,
若先向该溶液中通入一定量的氯气。再向反应后的溶液中滴加
KSCN
溶液
,
溶液变为红色
,
则下列叙述正确的是
(
)
①
原溶液中的
Br
-
一定被氧化
②
通入氯气之后原溶液中的
Fe
2+
一定有部分或全部被氧化
③
不能确定通入氯气后的溶液中是否存在
Fe
2+
④
若取少量所得溶液
,
再加入
CCl
4
溶液充分振荡
,
静置、分液
,
向上层溶液中加入足量的
AgNO
3
溶液
,
只产生白色沉淀
,
说明原溶液中的
I
-
、
Fe
2+
、
Br
-
均被完全氧化
A.
①②③
B.
②③④
C.
①③④
D.
①②③④
答案
解析
解析
关闭
由于离子还原性强弱顺序为
I
-
>Fe
2+
>Br
-
,
故先反应的离子是
I
-
,
其次是
Fe
2+
,
最后是
Br
-
。加硫氰化钾溶液后
,
变为红色
,
证明已经有
Fe
3+
生成
,
所以
I
-
已经反应完全
,
但无法得知
Fe
2+
是否反应完
,
而不能确定
Br
-
是否反应
,
①错误
,
②③④正确
,
若溶液中有碘离子和溴离子
,
则沉淀颜色不为白色
,
故选
B
。
答案
解析
关闭
B
-
62
-
1
2
3
4
2
.(2016
安徽蚌埠模拟
)
将
SO
2
气体通入
BaCl
2
溶液中无沉淀产生
,
但分别加入
①
氨水
②
氯水
③
H
2
S
溶液后均有沉淀产生
,
这些沉淀分别为
(
)
A.BaSO
4
、
BaSO
3
、
S
B.S
、
BaSO
3
、
BaSO
4
C.BaSO
3
、
BaSO
4
、
S
D.BaSO
3
、
S
、
BaSO
4
答案
解析
解析
关闭
由于盐酸酸性强于亚硫酸的酸性
,
因此
SO
2
气体通入
BaCl
2
溶液中
,
二者不反应。若通入气体生成沉淀
,
这说明可能发生氧化还原反应生成硫酸钡沉淀
,
或溶液碱性增强生成亚硫酸钡沉淀。①氨水溶液显碱性
,
有亚硫酸钡白色沉淀生成
;
②氯水具有强氧化性
,
把
SO
2
氧化生成了硫酸
,
进一步生成硫酸钡白色沉淀
;
③
H
2
S
具有还原性
,
与
SO
2
反应生成单质
S
沉淀和水
,
答案选
C
。
答案
解析
关闭
C
-
63
-
1
2
3
4
3
.(2014
山东理综
)
工业上常利用含硫废水生产
Na
2
S
2
O
3
·5H
2
O,
实验室可用如下装置
(
略去部分夹持仪器
)
模拟生产过程。
-
64
-
1
2
3
4
(1)
仪器组装完成后
,
关闭两端活塞
,
向装置
B
中的长颈漏斗内注入液体至形成一段液柱
,
若
,
则整个装置气密性良好。装置
D
的作用是
。装置
E
中为
溶液。
(2)
为提高产品纯度
,
应使烧瓶
C
中
Na
2
S
和
Na
2
SO
3
恰好完全反应
,
则烧瓶
C
中
Na
2
S
和
Na
2
SO
3
物质的量之比为
。
(3)
装置
B
的作用之一是观察
SO
2
的生成速率
,
其中的液体最好选择
。
a.
蒸馏水
b.
饱和
Na
2
SO
3
溶液
c.
饱和
NaHSO
3
溶液
d.
饱和
NaHCO
3
溶液
-
65
-
1
2
3
4
实验中
,
为使
SO
2
缓慢进入烧瓶
C,
采用的操作是
。已知反应
(
Ⅲ
)
相对较慢
,
则烧瓶
C
中反应达到终点的现象是
。反应后期可用酒精灯适当加热烧瓶
A,
实验室用酒精灯加热时必须使用石棉网的仪器还有
。
a.
烧杯
b.
蒸发皿
c.
试管
d.
锥形瓶
-
66
-
1
2
3
4
(4)
反应终止后
,
烧瓶
C
中的溶液经蒸发浓缩、冷却结晶即可析出
Na
2
S
2
O
3
·5H
2
O,
其中可能含有
Na
2
SO
3
、
Na
2
SO
4
等杂质。利用所给试剂设计实验
,
检测产品中是否存在
Na
2
SO
4
,
简要说明实验操作、现象和结论
:
。
已知
Na
2
S
2
O
3
·5H
2
O
遇酸易分
解
:
供选择的试剂
:
稀盐酸、稀硫酸、稀硝酸、
BaCl
2
溶液、
AgNO
3
溶液
-
67
-
1
2
3
4
答案
(1)
液柱高度保持不变 防止倒吸
NaOH
(
合理即可
)
(2)2
∶
1
(3)c
控制滴加硫酸的速度
(
合理即可
)
溶液变澄清
(
或浑浊消失
)
a
、
d
(4)
取少量产品溶于足量稀盐酸
,
静置
,
取上层溶液
(
或过滤
,
取滤液
),
滴加
BaCl
2
溶液
,
若出现沉淀则说明含有
Na
2
SO
4
杂质
(
合理即可
)
-
68
-
1
2
3
4
-
69
-
1
2
3
4
4
.(2015
广东联考
)
某消毒液的主要有效成分是次氯酸钠
,
可用于各类家居用品、餐具、棉织衣物等的消毒
,
对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面
,
勿用于铝、铜、碳钢制品。消毒液须密封
,
置阴凉暗处保存。请完成以下实验探究过程
:
(1)
推测该消毒液的酸碱性
:
,
原因是
(
用离子方程式表示
)
。
(2)
该消毒液还具有的化学性质是
性、
性和
性。
-
70
-
1
2
3
4
(3)
若将一定量的消毒液与
Na
2
SO
3
溶液相混合
,
得到混合液。混合时发生反应的离子方程式为
。基于该反应
,
对反应后混合液进行探究。
提出合理假设
:
假设
1:Na
2
SO
3
有剩余
;
假设
2:NaClO
有剩余
;
假设
3:
。
设计后续实验方案验证假设。限选实验试剂
:3 mol·L
-1
盐酸、
3 mol·L
-1
H
2
SO
4
溶液、
0.01 mol·L
-1
KMnO
4
溶液、
0.1 mol·L
-1
BaCl
2
溶液、
20% KSCN
溶液、
3% H
2
O
2
溶液、淀粉
-KI
溶液、紫色石蕊溶液。
-
71
-
1
2
3
4
-
72
-
1
2
3
4