- 141.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
金属的电化学腐蚀和防护
一.选择题(共15小题)
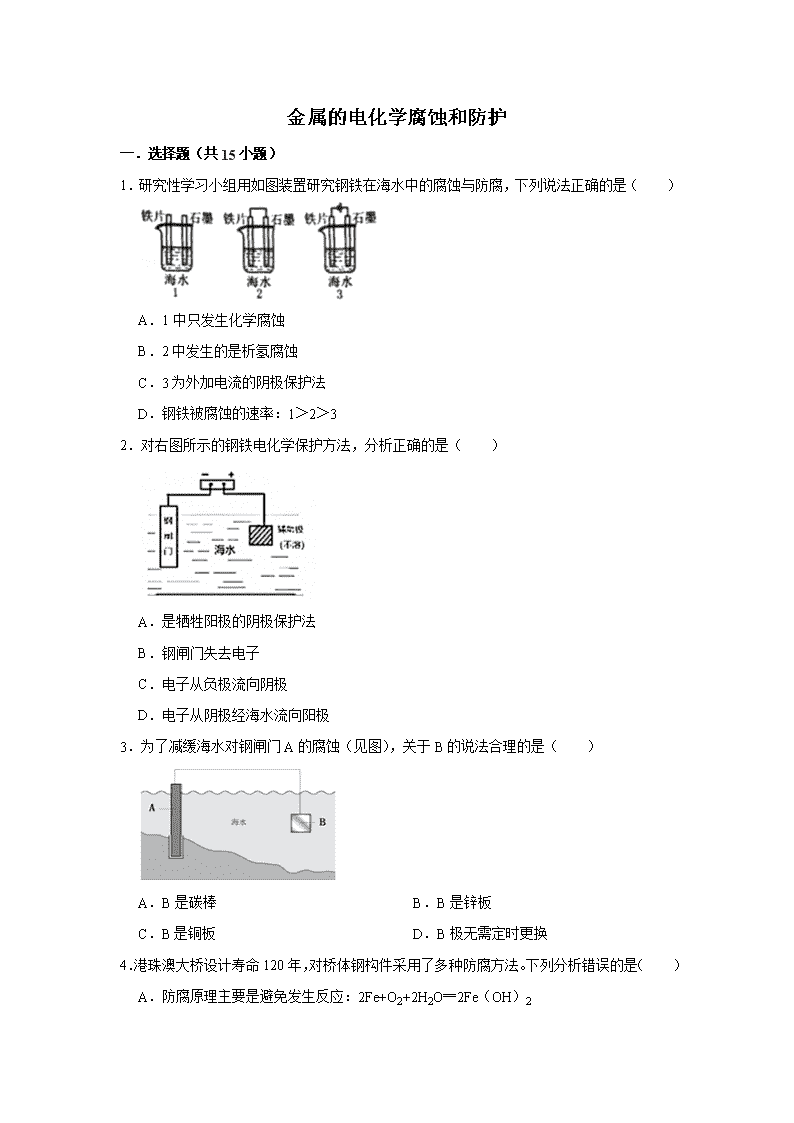
1.研究性学习小组用如图装置研究钢铁在海水中的腐蚀与防腐,下列说法正确的是( )
A.1中只发生化学腐蚀
B.2中发生的是析氢腐蚀
C.3为外加电流的阴极保护法
D.钢铁被腐蚀的速率:1>2>3
2.对右图所示的钢铁电化学保护方法,分析正确的是( )
A.是牺牲阳极的阴极保护法
B.钢闸门失去电子
C.电子从负极流向阴极
D.电子从阴极经海水流向阳极
3.为了减缓海水对钢闸门A的腐蚀(见图),关于B的说法合理的是( )
A.B是碳棒 B.B是锌板
C.B是铜板 D.B极无需定时更换
4.港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是( )
A.防腐原理主要是避免发生反应:2Fe+O2+2H2O═2Fe(OH)2
B.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池
C.采用外加电流的阴极保护时需外接镁、锌等作辅助阳极
D.钢构件可采用不锈钢材料以减缓电化学腐蚀
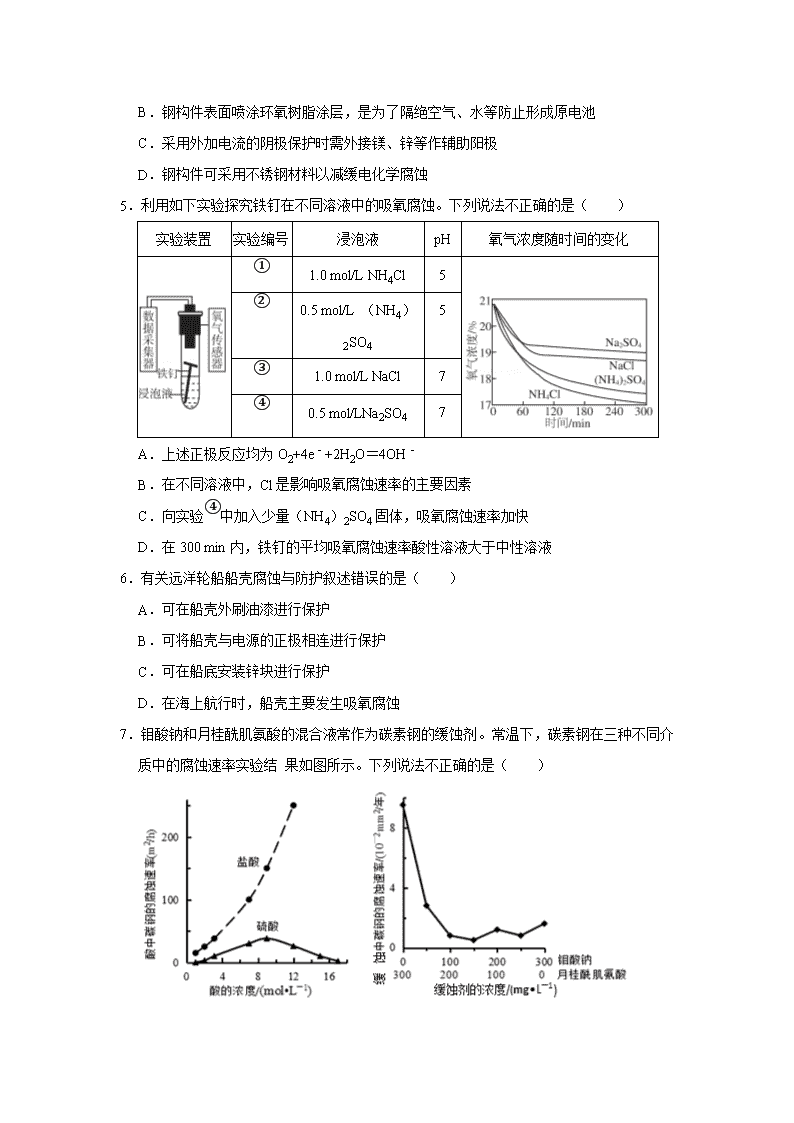
5.利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。下列说法不正确的是( )
实验装置
实验编号
浸泡液
pH
氧气浓度随时间的变化
①
1.0 mol/L NH4Cl
5
②
0.5 mol/L (NH4)2SO4
5
③
1.0 mol/L NaCl
7
④
0.5 mol/LNa2SO4
7
A.上述正极反应均为O2+4e﹣+2H2O=4OH﹣
B.在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C.向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D.在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
6.有关远洋轮船船壳腐蚀与防护叙述错误的是( )
A.可在船壳外刷油漆进行保护
B.可将船壳与电源的正极相连进行保护
C.可在船底安装锌块进行保护
D.在海上航行时,船壳主要发生吸氧腐蚀
7.钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结 果如图所示。下列说法不正确的是( )
A.盐酸的浓度越大,腐蚀速率越快
B.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与 c(H+)成正比
D.对比盐酸和硫酸两条曲线,可知 Cl﹣也可能会影响碳素钢的腐蚀速率
8.化学与生产、生活密切相关,下列叙述错误的是( )
A.Na2CO3热溶液呈碱性,有助于除去餐具油污
B.高纯度单质硅制成光导纤维,可以传输信息
C.钢铁的电化学腐蚀比较普遍,危害也较大
D.蛋白质在人体内分解,最后主要生成尿素排出体外
9.钢铁的外加电流阴极保护法中,铁应( )
A.接在电源正极 B.接在电源负极
C.连接锌 D.连接铜
10.港珠澳大桥设计寿命为120年,对桥体钢制构件采用了多种防腐措施,下列防腐措施错误的是( )
A.用导线与石墨相连 B.用导线与电源负极相连
C.钢制构件上焊接锌块 D.表面喷涂分子涂层
11.化学与生活密切相关。下列说法错误的是( )
A.小苏打常常用作生产膨松剂
B.电热水器用镁棒防止内胆腐蚀,其原理是牺牲阳极的阴极保护法
C.补铁保健品中的铁元素通常表现氧化性
D.唾液不能水解葡萄糖
12.钢铁在海水中的锈蚀过程示意见图,有关说法正确的是( )
A.电子从碳转移给铁
B.在钢铁上连接铅块,可起到防护作用
C.正极反应为:O2+2H2O+4e→4OH﹣
D.该金属腐蚀过程为析氢腐蚀
13.对钢铁析氢腐蚀和吸氧腐蚀的比较,合理的是( )
A.负极反应不同 B.正极反应相同
C.析氢腐蚀更普遍 D.都是电化学腐蚀
14.下列说法正确的是( )
A.海水淡化的常用方法有蒸馏法、离子交换法和电解法
B.钢铁在焊接前可以用NH4C1溶液的酸性清除表面的铁锈
C.甲醛和苯酚通过加聚反应制得酚醛树脂
D.在轮船外壳上焊接锌块或接直流电源正极,均可减缓船体的腐蚀速率
15.为使埋在地下的钢管不被腐蚀,所采取的下列措施错误的是( )
A.向钢管外填埋干燥土壤,避开电解质溶液
B.在钢管外镀上一层锌皮,此锌皮会作负极
C.将钢管连接在直流电源的负极上,作阴极
D.在钢管外涂上油漆、沥青等使与土壤隔绝
二.填空题(共5小题)
16.金属腐蚀一般可分为化学腐蚀和电化学腐蚀两种.一般情况下,这两种腐蚀同时存在,只是 腐蚀存在更加普遍.写出一种金属防护的方法 .
17.材料是人类赖以生存和发展的重要物质.
①钢铁在潮湿的空气中易发生吸氧腐蚀,写出正极电极反应式 ;
②水泥、玻璃都是传统的硅酸盐材料,生产水泥和玻璃都要用到的原料是 (填字母代号,下同);
A.石灰石B.小苏打 C.烧碱
③目前用量最大、用途最广的金属材料是 .
A.铜合金 B.铝合金 C.钢铁.
18.材料是人类赖以生存和发展的物质基础,材料科学的发展离不开化学.
①钢铁是常见的金属材料之一,但钢铁的腐蚀也给人类带来巨大损失,铁在潮湿的空气中锈蚀主要属于 腐蚀.请你说出防止金属腐蚀的任一种具体方法 .
②除金属材料外,人类还研发了许多材料,如:塑料、合成橡胶、合成纤维等,它们属于 材料.
19.炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.试回答:
①铁锅的腐蚀主要是由于 腐蚀(填“析氢”或“吸氧”).
②铁锅锈蚀的正极反应式为 .
③家里炒完菜后防止铁锅生锈的正确方法是 (填序号)A.及时洗净后保持干燥B.将铁锅一直浸泡在水中C.不用清洗铁锅.
20.人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属.
(1)现代社会使用大量的钢铁,钢铁与 接触容易生锈造成损失,在钢铁表面采用 方法可以防止钢铁生锈.
(2)波尔多液是由硫酸铜和熟石灰加水配制而成,不能用铁制容器配制的原因是(用化学方程式表示) .
金属的电化学腐蚀和防护
参考答案与试题解析
一.选择题(共15小题)
1.【分析】A.钢铁中含有碳,在海水中还发生吸氧腐蚀;
B.根据电化学腐蚀中的氢气和氧气的情况来确定电化学腐蚀类型;
C.钢铁与外加电源的负极相接,钢铁作为阴极发生还原反应,得到保护;
D.图1装置中钢铁正常锈蚀,图2形成原电池、钢铁作负极,发生氧化反应,图3钢铁得到保护,腐蚀最慢。
【解答】解:A.钢铁中含有碳,在海水中发生吸氧腐蚀和化学腐蚀,所以A错误;
B.海水接近于中性,钢铁不可能发生析氢腐蚀,所以发生了吸氧腐蚀,故B错误;
C.钢铁与外加电源的负极相接,钢铁作为阴极发生还原反应,保护方式为外加电流的阴极保护法,故C正确;
D.图1装置中钢铁正常锈蚀,图2形成原电池、钢铁作负极,发生氧化反应,图3钢铁得到保护,腐蚀最慢;所以钢铁被腐蚀的速率为:2>1>3,故D错误;
故选:C。
2.【分析】A.牺牲阳极的阴极保护法是原电池原理,在原电池中,负极被消耗,正极被保护;
B.利用电解原理保护钢铁时,与电源负极相连作阴极被保护,阳极失去电子;
C.形成电解池反应,电子从负极流向阴极;
D.电子由阳极沿导线流向正极,负极沿导线流向阴极。
【解答】解:A.在原电池中正极上溶液中的离子得电子,正极的电极材料不反应,即正极被保护,负极失电子被腐蚀,属于牺牲阳极的阴极保护法,图示形成电解池反应,不是牺牲阳极的阴极保护法,故A错误;
B.图示形成电解池反应,钢闸门与电源的负极相连,作阴极本身不放电,阴极被保护,钢闸门不失去电子,故B错误;
C.形成电解池反应,电子由阳极沿导线流向正极,负极沿导线流向阴极,故C正确;
D.电解质溶液的导电是因离子的定向移动,电子只流经外电路,电子由阳极沿导线流向正极,负极沿导线流向阴极,故D错误;
故选:C。
3.【分析】形成原电池时,Fe作正极被保护;该电化学保护方法的名称是 牺牲阳极的阴极保护法,由此分析解答;
【解答】解:形成原电池时,Fe作正极被保护,则要选择活泼性比Fe强的金属作负极,所以选锌,
故选:B。
4.【分析】A、大桥在海水中发生吸氧腐蚀;
B、钢构件表面喷涂环氧树脂涂层,能隔绝空气和水;
C、外加电流的阴极保护法中阳极可以采用惰性阳极;
D、不锈钢的耐腐蚀性比较好。
【解答】解:A、大桥在海水中发生吸氧腐蚀,负极上铁失电子:Fe﹣2e﹣=Fe2+,正极上氧气得电子:O2+4e﹣+2H2O=4OH﹣,故总反应为2Fe+O2+2H2O═2Fe(OH)2,故防腐蚀即为了避免此反应的发生,故A正确;
B、钢铁生锈的条件是有氧气和水,而钢构件表面喷涂环氧树脂涂层,能隔绝空气和水,故能防止原电池的形成,故B正确;
C、外加电流的阴极保护法中,钢铁做阴极被保护,阳极可以采用惰性阳极,而无需采用活性电极,故C错误;
D、不锈钢的耐腐蚀性比较好,故钢构件可以才用不锈钢,故D正确。
故选:C。
5.【分析】根据所给的信息可知,①②溶液中阳离子是NH4+,且NH4+浓度相同,均为1mol/L,而阴离子不同;③④溶液中的阳离子是Na+,且Na+浓度相同,均为1mol/L,而阴离子不同,根据图象可知,①②的反应速率接近,③④的反应速率接近,且①远大于③,②远大于④,故阴离子对反应速率影响不大,是阳离子影响了反应速率,据此分析。
【解答】解:A、根据图象可知,实验装置中的氧气浓度是逐渐降低的,故此腐蚀为吸氧腐蚀,故正极反应均为O2+4e﹣+2H2O=4OH﹣,故A正确;
B、根据图象可知,①②的反应速率接近,③④的反应速率接近,且①远大于③,②远大于④,故阴离子对反应速率影响不大,NH4+是影响反应速率的主要因素,故B错误;
C、NH4+是影响反应速率的主要因素,能导致钢铁的吸氧腐蚀速率加快,故向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快,故C正确;
D、①②溶液显酸性,③④显中性,根据图象可知,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液,故D正确。
故选:B。
6.【分析】A、在船壳外刷油漆可以防止金属和海水、空气接触;
B、将船壳与电源的正极相连,即船壳为阳极,在电解池的阴极金属被保护;
C、在船底安装锌块,金属锌是负极,被腐蚀,正极材料被保护;
D、海水是中性环境,金属会发生吸氧腐蚀。
【解答】解:A、在船壳外刷油漆可以防止金属和海水、空气接触,所以在船壳外刷油漆可以对船壳进行保护,故A正确;
B、将船壳与电源的正极相连,即船壳为阳极,阳极材料易被腐蚀,在电解池的阴极金属被保护,故B错误;
C、在船底安装锌块,形成原电池,金属锌是负极,被腐蚀,正极材料Fe被保护,故C正确;
D、海水是中性环境,金属会发生吸氧腐蚀,即在海上航行时,船壳主要发生吸氧腐蚀,故D正确。
故选:B。
7.【分析】A.由酸的浓度对腐蚀速率的影响图可知,曲线斜率越大,腐蚀速率越快;
B.由图可知,曲线的最低点速率最小;
C.浓硫酸有强氧化性,能使金属表面形成致密的氧化膜保护层;
D.碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异。
【解答】解:A.由酸的浓度对腐蚀速率的影响图可知,盐酸的浓度越大,腐蚀速率越快,故A正确;
B.由图可知,曲线的最低点速率最小,则钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小,故B正确;
C.浓硫酸有强氧化性,能使金属表面形成致密的氧化膜保护层,则硫酸浓度较大时不能说明速率与氢离子的关系,故C错误;
D.碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,可知Cl﹣有利于碳钢的腐蚀,SO42﹣不利于碳钢的腐蚀,故D正确;
故选:C。
8.【分析】A、Na2CO3是强碱弱酸盐,水解显碱性;
B、光导纤维的成分是二氧化硅;
C、钢铁的腐蚀以电化学腐蚀为主;
D、蛋白质是多种氨基酸的脱水缩合物。
【解答】解:A、碳酸钠溶液水解显碱性,CO32﹣+H2O⇌HCO3﹣+OH﹣,加热促进水解,碱性增强,油脂在碱性溶液中水解生成溶于水的物质,所以能用于清洗油污,故A正确;
B、光导纤维的成分为二氧化硅,对光具有良好的全反射作用,而Si为半导体材料,故B错误;
C、电化学腐蚀加速负极金属被腐蚀,比化学腐蚀快,危害更大,故C正确;
D、蛋白质是生命活动的主要体现者,可以在人体内水解生成氨基酸,也氧化分解的产物是二氧化碳、水和尿素,尿素通过尿液排出,故D正确。
故选:B。
9.【分析】外加电流的阴极保护法即电解池原理,而在电解池中,活性阳极被腐蚀,阴极被保护,据此分析。
【解答】解:外加电流的阴极保护法即电解池原理,而在电解池中,活性阳极被腐蚀,阴极被保护,故钢铁应该做阴极,即连接电源的负极。
故选:B。
10.【分析】A.作原电池负极的金属加速被腐蚀;
B.作电解池阴极的金属被保护;
C.作原电池正极的金属被保护;
D.隔绝空气和电解质溶液能被保护。
【解答】解:A.作原电池负极的金属加速被腐蚀,石墨、Fe和电解质溶液构成原电池,Fe作负极加速被腐蚀,故A错误;
B.作电解池阴极的金属被保护;,将铁和电源负极相连时Fe作阴极而被保护,故B正确;
C.作原电池正极的金属被保护,Fe、Zn和电解质溶液构成原电池时Zn作负极、Fe作正极,则Fe被保护,故C正确;
D.隔绝空气和电解质溶液能被保护,在钢结构表面喷涂分子涂层隔绝空气和电解质溶液,能保护钢结构,故D正确;
故选:A。
11.【分析】A、小苏打NaHCO3受热易分解;
B、Mg比Fe活泼,当发生化学腐蚀时Mg作负极;
C、保健品中的铁应为+2价;
D、葡萄糖是单糖。
【解答】解:A、小苏打NaHCO3受热易分解生成碳酸钠、水和二氧化碳,故能做膨松剂,故A正确;
B、Mg比Fe活泼,当发生化学腐蚀时Mg作负极而被腐蚀,从而阻止Fe被腐蚀,属于牺牲阳极的阴极保护法,故B正确;
C、人体中的铁以+2价存在,则保健品中的铁应为+2价,故C错误;
D、葡萄糖是单糖,不能水解,故D正确。
故选:C。
12.【分析】A、电子从负极铁转移给正极碳;
B、在钢铁上连接铅块,因为铁比铅活泼,则铁为负极,加快腐蚀;
C、吸氧腐蚀时,氧气在正极发生得电子的还原反应;
D、根据电化学腐蚀中的氢气和氧气的情况来确定电化学腐蚀类型.
【解答】解:钢铁中含有铁和碳,在潮湿的环境中构成原电池,铁作负极,碳作正极。
A、电子从负极铁转移给正极碳,故A错误;
B、在钢铁上连接铅块,因为铁比铅活泼,则铁为负极,加快腐蚀,故B错误;
C、吸氧腐蚀时,氧气在正极发生得电子的还原反应:O2+2H2O+4e→4OH﹣,故C正确;
D、从图中看出,空气中的氧气减少,所以发生了吸氧腐蚀,故D错误。
故选:C。
13.【分析】钢铁的吸氧腐蚀和析氢腐蚀时,都是铁作负极,碳作正极,负极上铁失电子发生氧化反应,正极上氢离子或氧气得电子发生还原反应,据此分析解答。
【解答】解:A.钢铁的吸氧腐蚀和析氢腐蚀时,都是铁作负极,负极上铁失电子发生氧化反应,反应相同,故A错误;
B.钢铁的吸氧腐蚀和析氢腐蚀时,正极上氢离子或氧气得电子发生还原反应,则反应不同,故B错误;
C.钢铁的吸氧腐蚀更普遍,故C错误;
D.钢铁的吸氧腐蚀和析氢腐蚀,都是形成原电池,则都是电化学腐蚀,故D正确;
故选:D。
14.【分析】A.电解法不能淡化海水;
B.NH4C1溶液水解显酸性,可与氧化铁反应;
C.甲醛和苯酚发生缩聚反应;
D.在轮船外壳上焊接锌块,Fe为正极被保护;在轮船外壳接直流电源负极,作阴极被保护.
【解答】解:A.电解法不能淡化海水,而蒸馏法、离子交换法均可淡化海水,故A错误;
B.NH4C1溶液水解显酸性,可与氧化铁反应,则钢铁在焊接前可以用NH4C1溶液的酸性清除表面的铁锈,故B正确;
C.甲醛和苯酚发生缩聚反应,生成酚醛树脂,还有小分子生成,故C错误;
D.在轮船外壳上焊接锌块,Fe为正极被保护;在轮船外壳接直流电源负极,作阴极被保护,则不能连接电源的正极,作阳极加快腐蚀,故D错误;
故选:B。
15.【分析】A.铁管在潮湿的环境下容易形成原电池,加快铁的腐蚀;
B、锌比铁活泼;
C、将钢管连接在直流电源的负极上,作阴极被保护;
D、在钢管外涂上油漆、沥青等与空气隔绝。
【解答】解:A.铁管在潮湿的环境下容易形成原电池,加快铁的腐蚀,向钢管外填埋干燥土壤,起不到避开电解质溶液,故A错误;
B、锌比铁活泼,所以在钢管外镀上一层锌皮,此锌皮会作负极,故B正确;
C、将钢管连接在直流电源的负极上,作阴极被保护,从而减慢被腐蚀的速率,故C正确;
D、在钢管外涂上油漆、沥青等与空气隔绝,起到减慢腐蚀的目的,故D正确;
故选:A。
二.填空题(共5小题)
16.【分析】金属的腐蚀包括化学腐蚀和电化学腐蚀,以电化学腐蚀为主,为防止金属腐蚀,可隔绝空气,外加电极或电源等,以此解答该题.
【解答】解:金属的腐蚀包括化学腐蚀和电化学腐蚀,二者同时存在,以电化学腐蚀为主,为防止金属腐蚀,可隔绝空气,如涂油漆,也可外加电极或电源等,如牺牲阳极的阴极保护法和外加电源的阴极保护法等,
故答案为:电化学;涂油漆(或其它答案).
17.【分析】①铁在潮湿的空气中发生吸氧腐蚀时,正极上是氧气得电子的过程;
②水泥的原料是粘土和石灰石,玻璃的原料是纯碱、石灰石和石英;
③钢铁是目前用量最大、用途最广的金属材料.
【解答】解:①铁在潮湿的空气中发生吸氧腐蚀时,正极上是氧气得电子的过程,电极反应为:O2+2H2O+4e﹣=4OH﹣,故答案为:O2+2H2O+4e﹣=4OH﹣;
②生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥;所以在玻璃工业、水泥工业中都用到的原料是石灰石,故选A;
③钢铁是目前用量最大、用途最广的金属材料,故选:C.
18.【分析】①在潮湿的环境中,钢铁形成原电池而发生电化学腐蚀,防止腐蚀的方法有:隔绝空气或水、改变物质结构等;
②塑料、合成橡胶、合成纤维等都属于有机合成材料.
【解答】解:(1)①在潮湿的环境中,铁、碳和电解质溶液构成原电池而产生电流,所以主要发生电化学腐蚀;
常用的方法有:电镀、涂油漆等;
故答案为:电化学;电镀(或涂油漆);
②塑料、合成橡胶、合成纤维等都属于有机合成材料,在生活中被广泛应用,故答案为:有机合成.
19.【分析】(1)铁锅未及时洗净(残液中含NaCl)能发生电化学腐蚀;
(2)钢铁的吸氧腐蚀正极上为氧气得电子生成氢氧根离子;
(3)根据金属生锈的条件来回答.
【解答】解:(1)铁锅未及时洗净(残液中含NaCl)能发生电化学腐蚀,由于电解质溶液为中性所以发生吸氧腐蚀;故答案为:吸氧;
(2)钢铁的吸氧腐蚀正极上为氧气得电子生成氢氧根离子,其电极反应式为:2H2O+O2+4e﹣=4OH﹣,故答案为:2H2O+O2+4e﹣=4OH﹣;
(3)防止铁锅生锈可以将金属和空气(水)接触即可,故答案为:A.
20.【分析】(1)钢铁和空气、水能构成原电池而被腐蚀,根据金属被腐蚀的原因采取措施防止铁生锈;
(2)铁的活泼性比铜强,铁能置换铜.
【解答】解:(1)钢铁中碳、铁和空气、水能构成原电池,铁作负极而被腐蚀,为防止铁被腐蚀,应采取措施防止铁与空气、水接触,可以采用的方法有:镀铬、刷漆、涂油等,故答案为:空气和水;表面涂层;
(2)铁的活泼性比铜强,铁能置换铜而使铁被腐蚀,反应方程式为:Fe+CuSO4═FeSO4+Cu,故答案为:Fe+CuSO4═FeSO4+Cu.
日期:2019/4/29 8:48:45;用户:鑫飞中学;邮箱:xinfeizx@xyh.com;学号:27690441