- 656.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
甘肃省武威第一中学2019-2020学年高二下学期期中考试
第I卷(选择题)
一、单选题(1~15小题每题2分,16~25小题每题3分)
1.下列物质的沸点按由高到低的顺序排列正确的是( )
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.②④①③ B.④②①③ C.④③②① D.②④③①
2.某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是( )
A.a极是负极,发生氧化反应
B.正极的电极反应是:O2+2H2O+4e-=4OH-
C.该甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O
D.甲烷燃料电池是环保电池
3.一氯甲烷等卤代烃跟苯的反应如图所示(无机小分子产物略去)。下列说法正确的是( )
A.该反应属于化合反应
B.b的二氯代物有6种结构
C.1mol b加氢生成饱和烃需要6molH2
D.C5H11Cl的结构有8种
4.萜品油烯(D)可用作香料的原料,它可由A合成得到如下所示,下列说法正确的是( )
A.有机物B的分子式为C11H19O3
B.有机物D分子中所有碳原子一定共面
C.1 mol有机物A中含有1.204×1024个双键
D.有机物C的同分异构体中不可能有芳香化合物
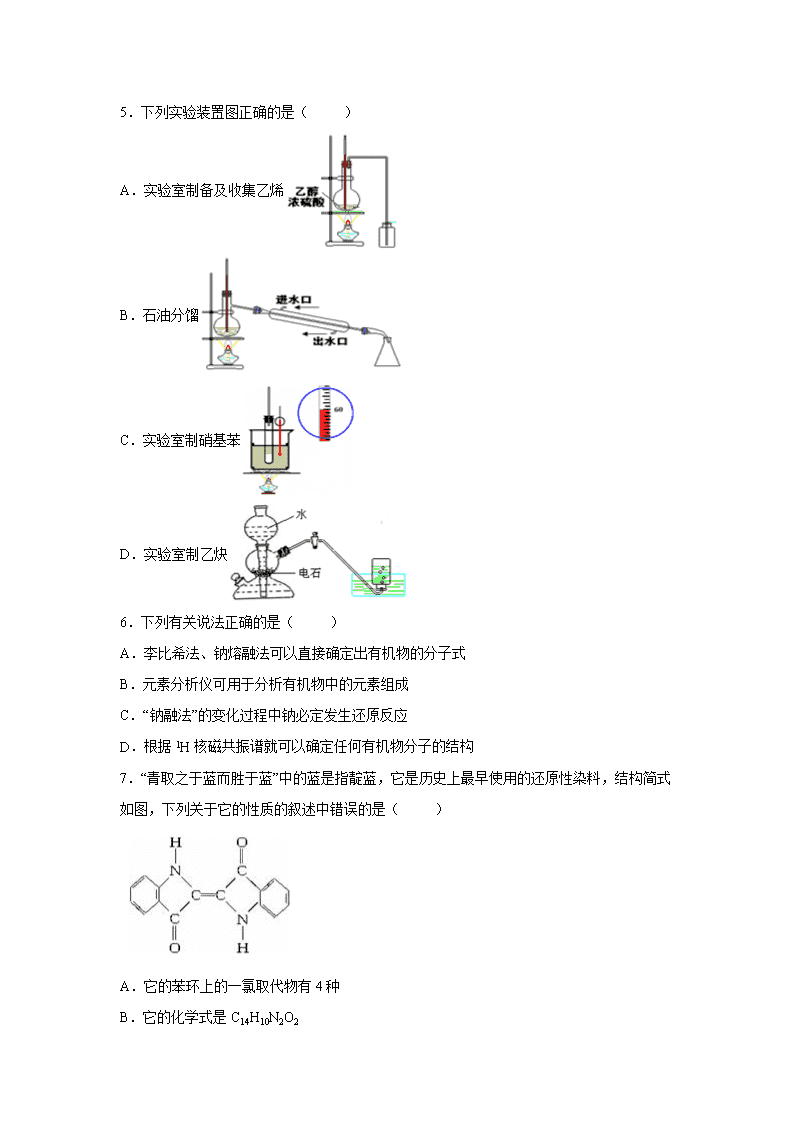
5.下列实验装置图正确的是( )
A.实验室制备及收集乙烯
B.石油分馏
C.实验室制硝基苯
D.实验室制乙炔
6.下列有关说法正确的是( )
A.李比希法、钠熔融法可以直接确定出有机物的分子式
B.元素分析仪可用于分析有机物中的元素组成
C.“钠融法”的变化过程中钠必定发生还原反应
D.根据1H核磁共振谱就可以确定任何有机物分子的结构
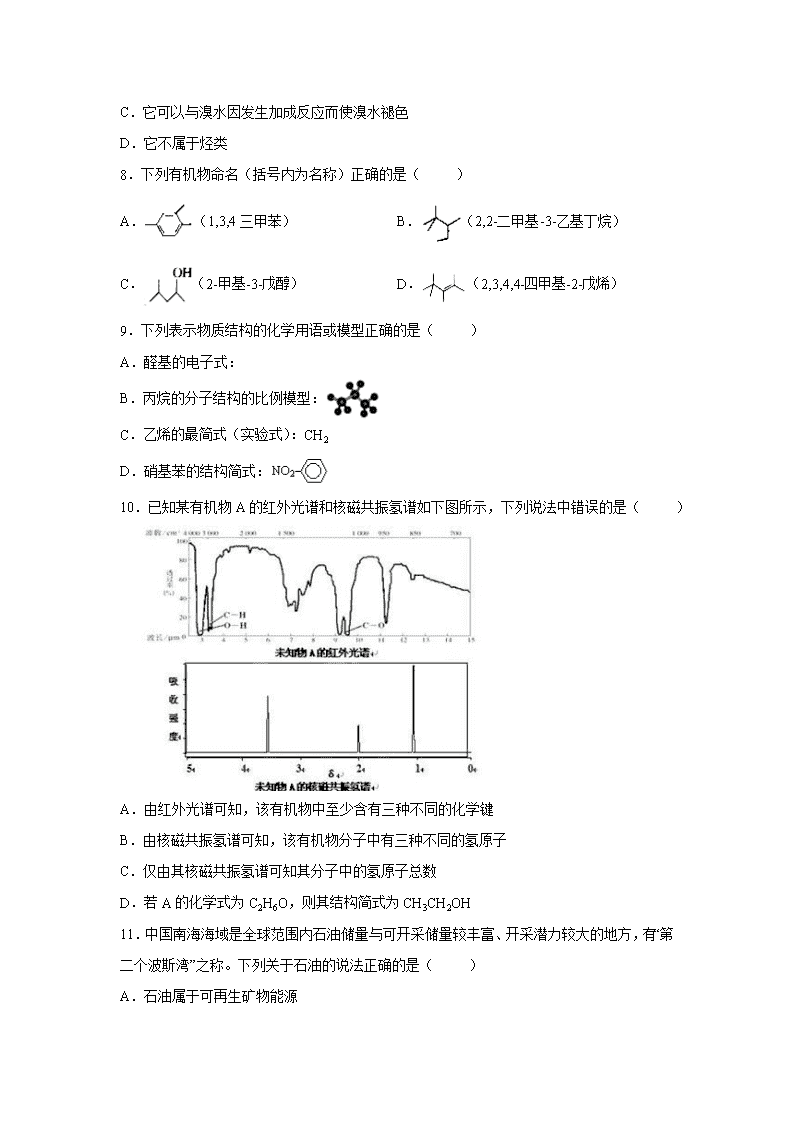
7.“青取之于蓝而胜于蓝”中的蓝是指靛蓝,它是历史上最早使用的还原性染料,结构简式如图,下列关于它的性质的叙述中错误的是( )
A.它的苯环上的一氯取代物有4种
B.它的化学式是C14H10N2O2
C.它可以与溴水因发生加成反应而使溴水褪色
D.它不属于烃类
8.下列有机物命名(括号内为名称)正确的是( )
A.(1,3,4三甲苯) B.(2,2-二甲基-3-乙基丁烷)
C.(2-甲基-3-戊醇) D.(2,3,4,4-四甲基-2-戊烯)
9.下列表示物质结构的化学用语或模型正确的是( )
A.醛基的电子式:
B.丙烷的分子结构的比例模型:
C.乙烯的最简式(实验式):CH2
D.硝基苯的结构简式:
10.已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是( )
A.由红外光谱可知,该有机物中至少含有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C.仅由其核磁共振氢谱可知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3CH2OH
11.中国南海海域是全球范围内石油储量与可开采储量较丰富、开采潜力较大的地方,有“第二个波斯湾”之称。下列关于石油的说法正确的是( )
A.石油属于可再生矿物能源
B.石油只含有碳、氢、氧三种元素
C.石油裂化的主要目的是提高轻质液体燃料的产量和质量
D.石油分馏所得的各馏分均是纯净物
12.烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是( )
A.A为原电池,B为电解池
B.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
C.经过一段时间,B烧杯中溶液的浓度减小
D.将B中右侧石墨改为铜电极,电极上发生的反应不变
13.某同学为了使反应2HCl+2Ag=2AgCl+H2↑能进行,设计了如下所示的四个实验方案,你认为可行的方案是( )
A. B.C. D.
14.在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( )
A.正极的电极反应式为2H2O+O2+4e-===4OH-
B.SO与H2的反应可表示为4H2+SO-8e-S2-+4H2O
C.钢管腐蚀的直接产物中含有FeS、Fe(OH)2
D.在钢管表面镀锌或铜可减缓钢管的腐蚀
15.某学生想制作一种家用环保型消毒液发生器,用石墨作电极解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,产生有较强杀菌能力的消毒液,设计了如图所示的装置,以下对电源电极名称和消毒液和主要成分判断正确的是( )
A.a为正极,b为负极:NaClO和NaCl
B.a为负极,b为正极:NaClO和NaCl
C.a为阳极,b为阴极:HClO和NaCl
D.a为阴极,b为阳极:HClO和NaCl
16.金属镍有广泛的有途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法备高纯度的镍,下列叙述正确的是(已知氧化性:Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,电极反应式:Ni2++2e-=Ni
B.电解后,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中有Cu和Pt
17.2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家。一种锂离子电池的结构如图所示,电池反应式为 LixC6 + Li1-xCoO2C6 + LiCoO2(x<1)。下列说法正确的是( )
A.充电时 a 极接外电源的负极
B.放电时Li+在电解质中由a极向b极迁移
C.充电时若转移0.02 mol电子,石墨电极将减重0.14 g
D.该废旧电池进行“放电处理”有利于锂在LiCoO2极回收
18.近年来,金属—空气电池的研究和应用取得很大进步,这种新型燃料电池具有比能量高、污染小、应用场合多等多方面优点。铝—空气电池工作原理如图所示,关于金属—空气电池的说法不正确的是( )
A.铝—空气电池(如上图)中,铝作负极,电子通过外电路到正极
B.为帮助电子与空气中的氧气反应,可使用活性炭作正极材料
C.碱性溶液中,负极反应为Al(s)+3OH-(aq)=Al(OH)3(s)+3e-,每消耗2.7 g Al(s),需耗氧6.72 L(标准状况)
D.金属—空气电池的可持续应用要求是一方面在工作状态下要有足够的氧气供应,另一方面在非工作状态下能够密封防止金属自腐蚀
19.红色基B(2-氨基-5-硝基苯甲醚)的结构简式如图所示,它主要用于棉纤维织物的染色,也用于制一些有机颜料,则分子式与红色基B相同,且氨基(—NH2)与硝基(—NO2)直接连在苯环上并呈对位关系的同分异构体的数目(包括红色基B)为( )
A.7种 B.8种 C.9种 D.10种
20.莲花清瘟胶囊对新冠肺炎轻症状患者有显著疗效,其有效成分绿原酸存在如图转化关系,下列有关说法正确的是( )
A.H的分子式为C17H14O4
B.Q中所有碳原子不可能都共面
C.绿原酸可发生加成、氧化和取代反应
D.W既属于羧酸类化合物又属于酚类化合物
21.CaC2和ZnC2、Al4C3、Ba4C3、Li2C2等都同属离子型碳化物。请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
A.Ba4C3水解生成丙烷(C3H8)
B.Al4C3水解生成丙炔(C3H4)
C.ZnC2水解生成乙烷(C2H6)
D.Li2C2水解生成乙烯(C2H4)
22.研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中不正确的是( )
A. 由TiO2制得1mol金属Ti,理论上外电路转移4mol电子
B. 阳极的电极反应式为C+2O2--4e-=CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量会不断减少
D. 装置中石墨电极材料需要定期更换
23.全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。下列说法不正确的是( )
A.放电过程中右槽溶液颜色逐渐由紫色变为绿色
B.放电过程中氢离子的作用之一是参与正极反应
C.充电过程中左槽溶液逐渐由蓝变黄
D.充电时若转移的电子数为3.011023个,左槽溶液中n(H+)的变化量为1mol
24.青蒿素是我国药学家屠呦呦在1971年发现的一种含有过氧基团的倍半萜内酯的无色针状晶体,不溶于水,易溶于乙醇、石油醚、苯等有机溶剂,熔点为156℃,沸点389.9℃
,热稳定性差。一种超声提取青蒿素的主要工艺流程如图:
已知:石油醚的沸点为30~80℃,青蒿素在95%乙醇中的溶解度随温度的升高而增大。下列说法不正确的是( )
A.超声提取的原理是在强大的超声波作用下,使青蒿细胞乳化、击碎、扩散,其优点是加速溶解
B.操作1的名称是萃取
C.操作3的步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
D.操作3中若温度过高,会降低青蒿素的产率,其原因可能是青蒿素热稳定性差
25.某烃的结构式用键线式可表示为,若该烃与Br2发生加成反应(反应物的物质的量之比为1∶1),则所得产物(不考虑顺反异构)有( )
A.2种 B.4种 C.6种 D.8种
第II卷(非选择题)
二、综合题(每空2分,共20分)
26.铝和氢氧化钠都是重要的工业产品。请回答:
(1)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如左下图所示。
①请写出A、B两处物质的名称或化学式:A___________________、B____________________
②请写出电解食盐水制烧碱的离子方程式__________________________________________
(2)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池如上右图。
①负极材料为________(填Mg或Al)。
②该原电池的总反应式为____________________________________________
27. 工业上为了处理含有Cr2O72-酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,经过一段时间,有Fe(OH)3 和Cr(OH)3 沉淀生成,经处理后的工业废水中铬(Cr)的含量已低于排放标准。请回答下列问题:
(1)电极反应式:阳极 ,阴极
(2)写出Cr2O72-变为Cr3+的离子方程式
(3)工业废水pH升高的原因
(4)该装置中不能改用石墨电极,原因是 。
三、实验题(每空2分,共10分)
28.下列装置中有机物样品在电炉中充分燃烧,通过测定生成的CO2和H2O的质量,来确定有机物分子式。
(1)A装置是提供实验所需的O2,C中CuO的作用是____________。
(2)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44 g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88 g,已知该物质的相对分子质量为44,则该样品的化学式为_________。
(3)若该有机物的核磁共振氢谱如下图所示,峰面积之比为1:3,该化合物的结构简式是: 。
(4)若符合下列条件,则该有机物的结构简式为_____________________ 。
①环状化合物②只有一种类型的氢原子
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个装置E,其主要目的是__________________。
四、推断题(每空2分,共10分)
29.2014年中国十大科技成果之一是:我国科学家成功实现甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃和氢气等化学品,为天然气化工开发了一条革命性技术。以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去):
(1)乙酸分子中所含官能团名称为_________________。
(2)聚苯乙烯的结构简式为__________________。
(3)图中9步反应中只有两步属于取代反应,它们是____(填序号)。
(4)写出下列反应的化学方程式(注明反应条件):
反应⑤为 ;
反应⑥为 。
参考答案
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
A
C
D
C
C
B
B
D
C
C
C
D
C
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
C
B
D
D
C
D
C
A
C
D
B
B
26.(每空2分,共10分)
(1) ①A:浓NaCl溶液(饱和食盐水也可) B:浓NaOH溶液
②2NaCl+2H2O=电解=2NaOH+H2↑+Cl2↑
(2) ①Al ②2Al+2NaOH+2H2O=2NaAlO2+3H2↑
27. (每空2分,共10分)
(1)阳极:Fe-2e-=Fe2+ 阴极:2H++2e-=H2↑
(2)Cr2O72-+6 Fe2++14 H+==2Cr3++6Fe3++7H2O
(3)电解时H+在阴极上不断放电; Fe2+还原Cr2O72-消耗H+,使溶液中[H+]减小,pH增大;生成Fe(OH)3、Cr(OH)3沉淀。(答出两点即可)
(4)若用石墨电极,不能提供还原剂Fe2+,无法使Cr2O72-还原而除去。
28.(每空2分,共10分)
(1)使有机物充分氧化生成CO2 、H2O
(2)C2H4O (3) CH3CHO (4)
(5)吸收空气中的二氧化碳和水蒸气
29.(每空2分,共10分)
(1)羧基 (2) (3)⑤⑥
(4)反应⑤为
反应⑥为