- 640.32 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017
届高考化学二轮总复习
离子晶体 专题练习
A
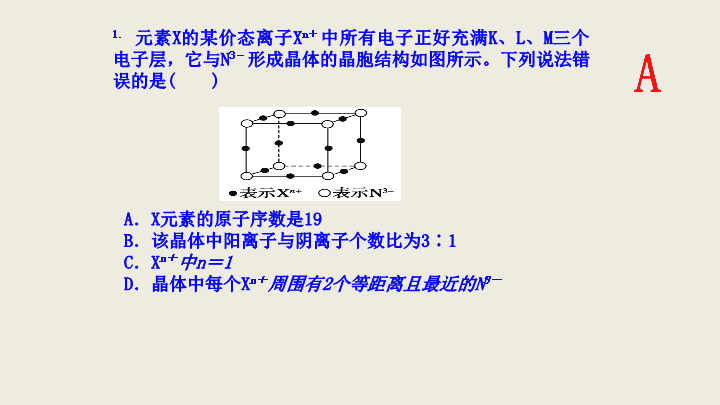
1.
元素
X
的某价态离子
X
n
+
中所有电子正好充满
K
、
L
、
M
三个电子层,它与
N
3
-
形成晶体的晶胞结构如图所示。下列说法错误的是
(
)
A
.
X
元素的原子序数是
19
B
.该晶体中阳离子与阴离子个数比为
3
∶
1
C
.
X
n
+
中
n
=
1
D
.晶体中每个
X
n
+
周围有
2
个等距离且最近的
N
3
-
2.
下列不属于影响离子晶体结构的因素的是
(
)
A
.晶体中阴、阳离子的半径比
B
.晶体中阴、阳离子的电荷比
C
.离子键的纯粹程度
D
.离子晶体的晶格能
【
解析
】
选
D
。晶体中阴、阳离子的半径比、电荷比和离子键的纯粹程度影响着离子键的强弱,离子键的强弱可用晶格能来衡量。
【
答案
】D
D
3.
下列有关说法一定正确的是
(
)
A
.依据相对分子质量能判断组成和结构相似的分子晶体的熔、沸点的高低
B
.
NaCl
晶体中
Na
+
和
Cl
-
存在如图所示的位置关系
C
.
SiC
晶体的网状结构中,由共价键形成的最小的环上有
6
个碳原子
D
.金属晶体的熔点都比原子晶体的熔点低
B
【
解析
】
本题考查
NaCl
、
SiC
这两种常见晶体的结构。组成和结构相似的分子晶体,一般相对分子质量越大,物质的熔、沸点越高,但若是分子间除了范德华力,还存在氢键的作用,则会使物质的熔、沸点反常得高,
A
项错误;
SiC
晶体中最小的环为六元环,由
3
个碳原子、
3
个硅原子构成,
C
项错误;金属晶体的熔点范围跨度很大,有些金属晶体的熔点很高,如金属钨,其熔点要比原子晶体高得多,
D
项错误。
【
答案
】B
B
5.
有关晶体的叙述正确的是
(
)
A
.在
SiO
2
晶体中,由
Si
、
O
构成的最小单元环是
8
元环
B
.在
12 g
金刚石中,含
C—C
共价键键数为
4 mol
C
.在
60 g
二氧化硅中,含
Si—O
共价键键数为
4 mol
D
.在
NaCl
晶体中,每个
Na
+
周围与它最近且距离相等的
Na
+
有
6
个
【
解析
】
SiO
2
中最小的环是
12
元环
(6
个
Si
原子,
6
个
O
原子
)
;
12 g
金刚石
(1 mol)
中含
C—C
键
2 mol
;
C
项正确;
D
项每个
Na
+
周围与它最近且距离相等的
Na
+
是
12
个。
【
答案
】C
C
6.
共价键、离子键、范德华力、氢键和金属键是构成物质粒子间的不同作用方式。下列物质中,只含有上述一种作用的是
(
)
A
.冰
B
.氢氧化钠
C
.铁
D
.石墨
【
解析
】
选
C
。冰中分子内含有极性键,水分子间含有氢键和范德华力;氢氧化钠中含有离子键和极性键;铁中只含金属键;石墨是混合晶体,含有非极性键、范德华力和金属键。
【
答案
】C
C
7.
萤石
(CaF
2
)
是一种难溶于水的固体。下列实验事实能说明
CaF
2
一定是离子晶体的是
(
)
A
.
CaF
2
难溶于水,其水溶液的导电性极弱
B
.
CaF
2
的熔点较高,硬度较大
C
.
CaF
2
固体不导电,但在熔融状态下可以导电
D
.
CaF
2
在有机溶剂
(
如苯
)
中的溶解度极小
【
解析
】
化合物中存在离子键则必为离子晶体,而离子晶体区别于其他晶体的突出特点是固体不导电,熔融状态下能导电,故选
C
。
【
答案
】C
C
8.
在
NaCl
晶体中,距离最近的
Na
+
组成的最小多面体是
(
)
A
.正四面体
B
.正六面体
C
.正八面体
D
.正十二面体
【
解析
】
选
A
。在
NaCl
晶体中,距离最近的同种离子是晶体中最小的立方体中的
8
个顶角上的
4
个离子,这
4
个离子构成了正四面体结构。
【
答案
】A
A
9.
下列各物质的晶体中,晶体类型相同的是
(
)
A
.金刚砂
(SiC)
、金刚石和金
B
.
Si
、
SiO
2
和
Na
2
SiO
3
C
.冰、干冰和冰醋酸
D
.
NaCl
、
MgCl
2
和
AlCl
3
【
解析
】
选
C
。金刚砂
(SiC)
、金刚石、
Si
、
SiO
2
都属于原子晶体,金属于金属晶体,
Na
2
SiO
3
、
NaCl
和
MgCl
2
都属于离子晶体,
AlCl
3
、冰、干冰和冰醋酸都属于分子晶体。
【
答案
】C
C
10.
如图是
NaCl
晶体的一个晶胞的结构模型。
KO
2
的晶体结构与
NaCl
相似,
KO
2
可以看作是
Na
+
的位置用
K
+
代替,
Cl
-
的位置用
O
代替,则下列对于
KO
2
晶体结构的描述正确的是
(
)
A
.与
K
+
距离相等且最近的
O
共有
8
个
B
.与
K
+
距离相等且最近的
O
构成的多面体是正八面体
C
.与
K
+
距离相等且最近的
K
+
有
8
个
D
.一个
KO
2
晶胞中的阳离子和阴离子的粒子数比为
1
∶
2
B
11.
NaF
、
NaI
、
MgO
晶体均为离子晶体,根据下列数据,这三种晶体的熔点高低顺序是
(
)
物质
NaF
NaI
MgO
离子所带电荷数
1
1
2
离子核间距离
/10
-
10
m
2.31
3.18
2.10
A
.
NaF
>
NaI
>
MgO
B
.
MgO
>
NaF
>
NaI
C
.
MgO
>
NaI
>
NaF
D
.
NaI
>
NaF
>
MgO
B
【
解析
】
选
B
。离子晶体的熔点与离子键的强弱有关,而离子键的强弱可用晶格能来衡量。离子所带电荷数越多,离子核间距离越小,晶格能就越大,离子键就越强,则离子晶体的熔点就越高。
【
答案
】B
12.
下列性质中,可以较充分地说明某晶体是离子晶体的是
(
)
A
.具有较高的熔点
B
.可溶于水
C
.固态不导电,熔融状态能导电
D
.固态不导电,水溶液能导电
【
解析
】
选
C
。离子晶体区别于其他晶体的突出特点是固态不导电,熔融状态能导电。某些分子晶体也能溶于水且水溶液能导电,如
HCl
;原子晶体也具有较高的熔点,如
SiO
2
。
【
答案
】C
C
13.
根据下列性质判断,属于离子晶体的物质是
(
)
A
.熔点
2700
℃,导电性好,延展性强
B
.无色晶体,熔点
3550
℃,不导电,质硬,难溶于水和有机溶剂
C
.无色晶体,能溶于水,质硬而脆,熔点为
800
℃,熔化时能导电
D
.熔点-
56.6
℃,微溶于水,硬度小,固态或液态时不导电
【
解析
】
选
C
。
A
项符合金属晶体的特征,
B
项符合原子晶体的特征,
D
项符合分子晶体的特征。
【
答案
】C
C
14.
下列有关晶体的叙述中,错误的是
(
双选
)(
)
A
.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,化学键不被破坏
B
.白磷晶体中,结构粒子之间通过共价键结合
C
.石英晶体是直接由硅原子和氧原子通过共价键所形成的空间网状结构的晶体
D
.构成分子晶体的结构粒子中一定存在共价键
BD
【
解析
】
选
BD
。离子晶体是通过离子键将阴、阳离子结合在一起的,所以熔化时,离子键被破坏;而分子晶体是通过分子间作用力将分子结合在一起的,所以熔化时,分子内部的化学键未发生变化,破坏的只是范德华力,则
A
正确;白磷晶体是分子晶体,在
P
4
内部存在共价键,而结构粒子
(P
4
)
之间是通过分子间作用力结合的,则
B
错误;石英晶体是原子晶体,则
C
正确;稀有气体在固态时也属于分子晶体,而稀有气体是单原子分子,在分子内部不存在共价键,则
D
错误。
【
答案
】BD
15.
某离子晶体中晶体结构最小的重复单元如下图:
A
为阴离子,在正方体内,
B
为阳离子,分别在顶点和面心,则该晶体的化学式为
(
)
A
.
B
2
A
B
.
BA
2
C
.
B
7
A
4
D
.
B
4
A
7
B
16.
泽维尔研究发现,当激光脉冲照射
NaI
时,
Na
+
和
I
-
两核间距
1.0
~
1.5 nm
,呈离子键;当两核靠近约距
0.28 nm
时,呈现共价键。根据泽维尔的研究成果能得出的结论是
(
)
A
.
NaI
晶体是离子晶体和分子晶体的混合物
B
.离子晶体可能含有共价键
C
.
NaI
晶体中既有离子键,又有共价键
D
.共价键和离子键没有明显的界线
D
【
解析
】
选
D
。由题中信息可知,离子的核间距较大时,呈离子键,而核间距较小时,呈共价键,当核间距改变时,键的性质会发生改变,这说明离子键和共价键并没有明显的界线。但
NaI
晶体是典型的离子晶体,说明其晶体中核间距在
1.0
~
1.5 nm
之间。
【
答案
】D
17.
已知三种氟化物的晶格能。
化学式
NaF
MgF
2
AlF
3
晶格能
/ kJ·mol
-
1
923
2957
5492
这三种氟化物的晶格能递变的原因是
__________________________________________
。
【
解析
】
NaF
、
MgF
2
和
AlF
3
都是离子晶体,晶格能的大小与离子半径、离子所带电荷数有关。离子半径越小,离子所带电荷数越多,则晶格能就越大。
【
答案
】
晶格能的大小与离子所带电荷数成正比,与离子半径成反比
18.
如图表示
NaCl
晶胞,直线交点处的圆圈为
Na
+
或
Cl
-
所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)
请将其中代表
Cl
-
的圆圈涂黑
(
不必考虑体积大小
)
,以完成
NaCl
晶胞示意图。
(2)
晶体中,在每个
Na
+
的周围与它最接近且距离相等的
Na
+
共有
________
个;
(3)
在
NaCl
晶胞中正六面体的顶角上、面上、棱上的
Na
+
或
Cl
-
为该晶胞与其相邻的晶胞所共有,一个晶胞中
Cl
-
的个数等于
________
,即
________(
填计算式
)
;
Na
+
的个数等于
________
,即
________(
填计算式
)
。
【
答案
】
(1)
如图
(
答案不惟一,合理即可
)
(2)12
(3)4
8×
+
6×
=
4
4
12×
+
1
=
4(
答案不惟一,只要与第
1
问对应即可
)
19.
根据下图推测,
CsCl
晶体中两距离最近的
Cs
+
间距离为
a
,则每个
Cs
+
周围与其距离为
a
的
Cs
+
数目为
______
,每个
Cs
+
周围距离相等且次近的
Cs
+
数目为
________
,距离为
________
,每个
Cs
+
周围距离相等且第三近的
Cs
+
数目为
________
,距离为
________
,每个
Cs
+
周围紧邻且等距的
Cl
-
数目为
________
。
【
解析
】
以图中大立方体中心的
Cs
+
为基准,与其最近的
Cs
+
分别位于其上、下、前、后、左、右的六个方位;与其次近的
Cs
+
分别位于通过中心
Cs
+
的三个切面的大正方形的顶点,个数为
4×3
=
12
;与其第三近的
Cs
+
分别位于大立方体的
8
个顶点上;每个
Cs
+
周围紧邻且等距的
Cl
-
数目为
8
。
20.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
请回答下列问题:
(1)Ni
原子的核外电子排布式为
_____________________________________
;
(2)NiO
、
FeO
的晶体结构类型均与氯化钠的相同,
Ni
2
+
和
Fe
2
+
的离子半径分别为
69 pm
和
78 pm
,则熔点
NiO________FeO(
填“<
”
或“>
”
)
;
(3)NiO
晶胞中
Ni
和
O
的配位数分别为
____________
、
__________
;
(4)
金属镍与镧
(La)
形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为
________
。
【
答案
】
(1)1s
2
2s
2
2p
6
3s
2
3p
6
3d
8
4s
2
或
[Ar]3d
8
4s
2
(2)
>
(3)6
6
(4)LaNi
5