- 433.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
四大平衡常数(Ka、Kh、Kw、Ksp)的综合应用
1.四大平衡常数的比较
常数
符号
适用
体系
影响因素
表达式
水的离
子积常数
Kw
任意水
溶液
温度升高,
Kw增大
Kw=c(OH-)·c(H+)
电离
常数
酸Ka
弱酸
溶液
升温,
K值增大
HAH++A-,电离常数Ka=
碱Kb
弱碱
溶液
BOHB++OH-,电离常数Kb=
盐的水
解常数
Kh
盐溶液
升温,Kh
值增大
A-+H2O
OH-+HA,水解常数Kh=
溶度
积常数
Ksp
难溶电
解质溶液
升温,大
多数Ksp
值增大
MmAn的饱和溶液:Ksp=
cm(Mn+)·
cn(Am-)
2.四大平衡常数的应用
(1)判断平衡移动的方向
Qc与K的关系
平衡移动方向
溶解平衡
Qc>K
逆向
沉淀生成
Qc=K
不移动
饱和溶液
Qc”“=”或“<”)。
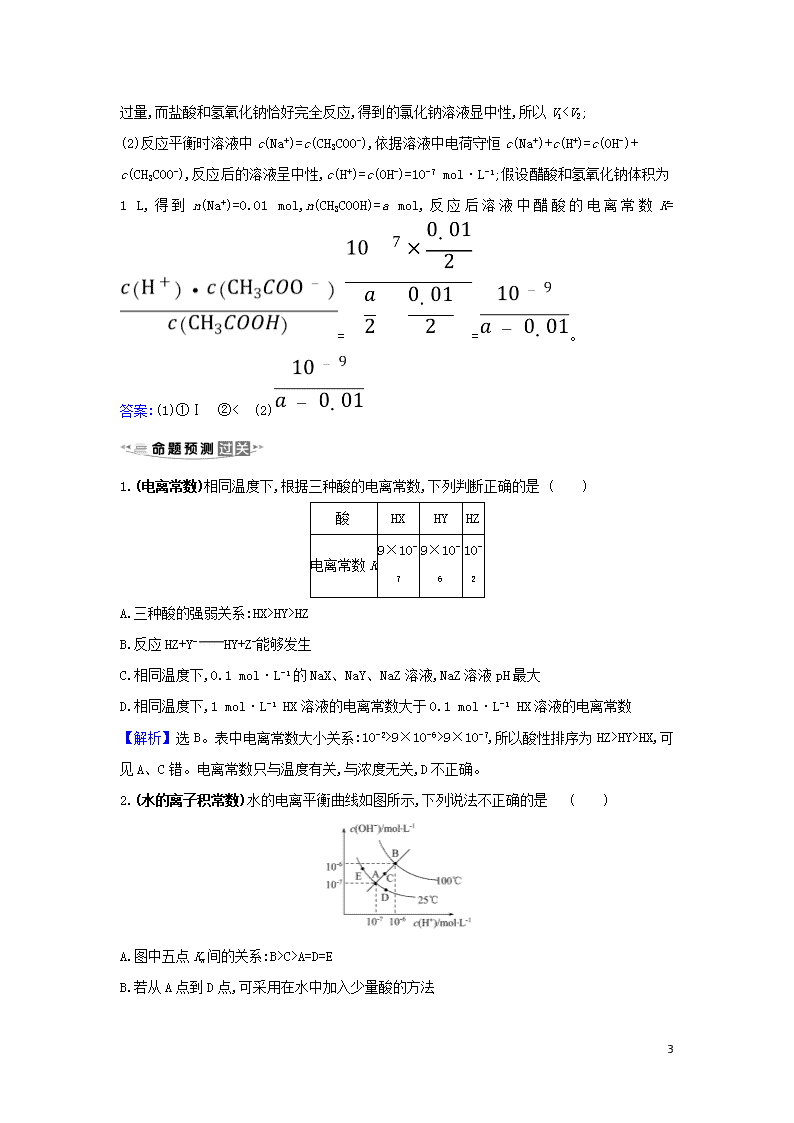
(2)25 ℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为________。(用含a的代数式表示)。
【审题流程】明确意义作判断,紧扣关系解计算
【解析】(1)①醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大,曲线Ⅱ为滴定盐酸曲线,曲线Ⅰ为滴定醋酸曲线,答案填Ⅰ;
②
6
醋酸和氢氧化钠恰好完全反应时,得到的醋酸钠溶液显碱性,要使溶液pH=7,需要醋酸稍过量,而盐酸和氢氧化钠恰好完全反应,得到的氯化钠溶液显中性,所以V1HY>HZ
B.反应HZ+Y-HY+Z-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX溶液的电离常数
【解析】选B。表中电离常数大小关系:10-2>9×10-6>9×10-7,所以酸性排序为HZ>HY>HX,可见A、C错。电离常数只与温度有关,与浓度无关,D不正确。
2.(水的离子积常数)水的电离平衡曲线如图所示,下列说法不正确的是 ( )
A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
6
C.若从A点到C点,可采用温度不变时在水中加入适量NH4Cl固体的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
【解析】选C。水的离子积常数只是温度的函数,温度越高离子积常数越大,温度不变则离子积常数不变;A点到D点氢离子浓度增大,可采用加入酸的方法;从A点到C点水的离子积常数增大,只能采用升高温度的方法;处在B点时水的离子积常数为10-12,pH=2的硫酸溶液c(H+)=10-2 mol·L-1,pH=10的KOH溶液c(OH-)=
10-2 mol·L-1,等体积混合恰好完全反应同时生成强酸强碱盐硫酸钾,因此混合液显中性。
3.(溶度积常数)Cu(OH)2在水中存在着如下沉淀溶解平衡:Cu(OH)2(s)Cu2+(aq)+2OH-(aq),在常温下,Ksp=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调整pH,使溶液的pH大于 ( )
A.2 B.3 C.4 D.5
【解析】选D。Cu(OH)2(s)Cu2+(aq)+2OH-(aq),其中Ksp=c(Cu2+)·c2(OH-),要使Cu(OH)2沉淀需达到其Ksp,故c(OH-)>= mol·L-1,故c(OH-)>1×10-9 mol·L-1,则c(H+)<1×10-5 mol·L-1,因此pH应大于5。
【加固训练】
1.化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是
( )
A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离平衡常数Ka变小
C.Ksp(AgCl)>Ksp(AgI) ,由此可以判断AgCl(s) + I-(aq)AgI(s)+ Cl-(aq)能够发生
D.Ka(HCN)”“<”或“=”)。
(2)用惰性电极电解饱和草酸溶液可制得乙醛酸(OHC—COOH)。阴极的电极反应式为 _______________________________________________ 。
(3)草酸钠是一种重要的还原剂。合成草酸钠的操作如下:
草酸草酸钠晶体
①75%酒精的作用是________________________________ 。
②当草酸与碳酸钠的物质的量按2∶1充分混合后,溶液中pH<7。请将该溶液中离子浓度按由大到小的顺序排列 ________________________________。
(4)已知某温度下CaC2O4的Ksp为2.5×10-9。将0.02 mol·L-1澄清石灰水和0.01 mol·L-1 H2C2O4溶液等体积混合,所得溶液中C2的物质的量浓度为________ 。
【解析】(1)由题给表格可知,H2C2O4、HC2、NH3·H2O的电离常数大小为H2C2O4>HC2>NH3·H2O,故草酸铵溶液显酸性。(2)阴极得电子发生还原反应:2H++HOOC—COOH+2e-HOOC—CHO+H2O。(3)①加入酒精是为了降低草酸钠的溶解度,便于晶体析出。②二者反应后溶质为草酸氢钠,因为溶液显酸性,所以HC2的电离程度大于其水解程度,则离子浓度大小顺序为c(Na+)>c(HC2)>c(H+)>c(C2) >c(OH-)。(4)混合后所得溶液中c(Ca2+) =0.005 mol·L-1,Ksp(CaC2O4)=c(Ca2+)· c(C2)=2.5×10-9,则
c(C2)= mol·L-1=5×10-7 mol·L-1。
答案:(1)<
6
(2)2H++HOOC—COOH+2e-HOOC—CHO+H2O
(3)①降低草酸钠的溶解度,便于晶体析出
②c(Na+)>c(HC2)>c(H+)>c(C2) >c(OH-)
(4)5×10-7 mol·L-1
6