- 109.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
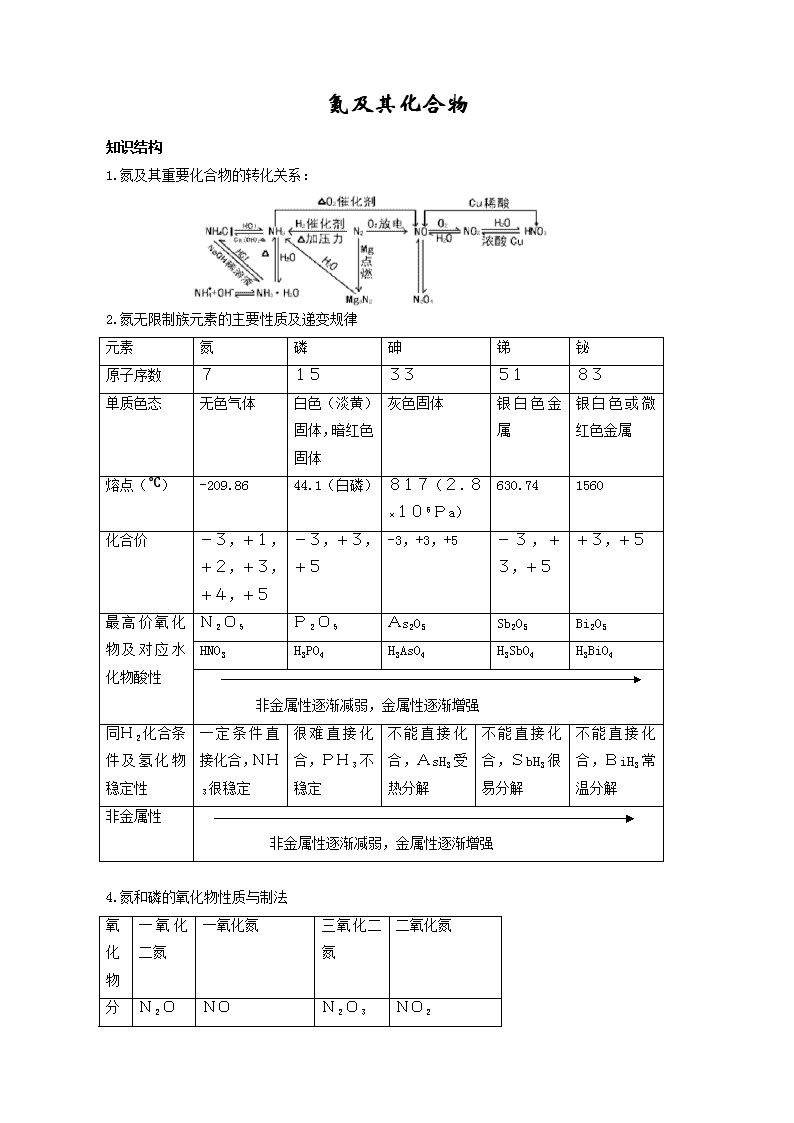
氮及其化合物
知识结构
1.氮及其重要化合物的转化关系:
2.氮无限制族元素的主要性质及递变规律
元素
氮
磷
砷
锑
铋
原子序数
7
15
33
51
83
单质色态
无色气体
白色(淡黄)固体,暗红色固体
灰色固体
银白色金属
银白色或微红色金属
熔点(℃)
-209.86
44.1(白磷)
817(2.8×106Pa)
630.74
1560
化合价
-3,+1,+2,+3,+4,+5
-3,+3,+5
-3,+3,+5
-3,+3,+5
+3,+5
最高价氧化物及对应水化物酸性
N2O5
P2O5
As2O5
Sb2O5
Bi2O5
HNO3
H3PO4
H3AsO4
H3SbO4
H3BiO4
非金属性逐渐减弱,金属性逐渐增强
同H2化合条件及氢化物稳定性
一定条件直接化合,NH3很稳定
很难直接化合,PH3不稳定
不能直接化合,AsH3受热分解
不能直接化合,SbH3很易分解
不能直接化合,BiH3常温分解
非金属性
非金属性逐渐减弱,金属性逐渐增强
4.氮和磷的氧化物性质与制法
氧化物
一氧化二氮
一氧化氮
三氧化二氮
二氧化氮
N2O
NO
N2O3
NO2
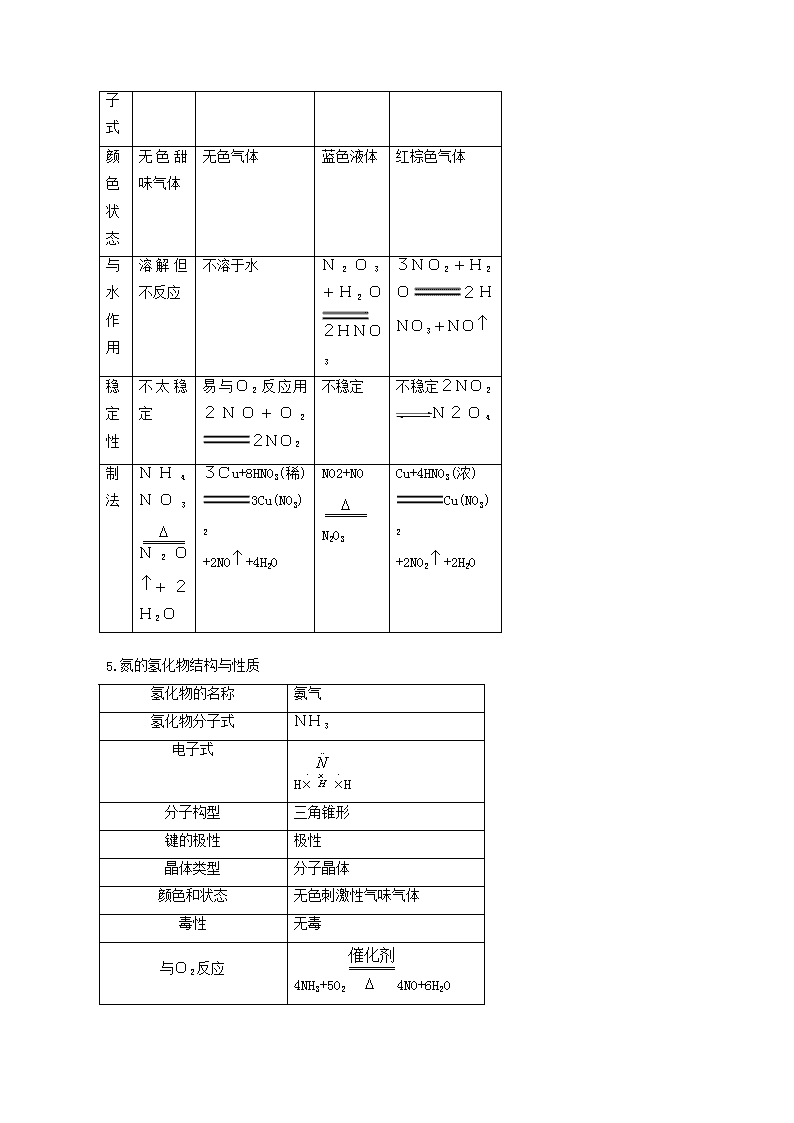
分子式
颜色状态
无色甜味气体
无色气体
蓝色液体
红棕色气体
与水作用
溶解但不反应
不溶于水
N2O3+H2O2HNO3
3NO2+H2O2HNO3+NO
稳定性
不太稳定
易与O2反应用2NO+O22NO2
不稳定
不稳定2NO2N2O4
制法
NH4NO3N2O+2H2O
3Cu+8HNO3(稀) 3Cu(NO3)2
+2NO+4H2O
NO2+NO
N2O3
Cu+4HNO3(浓)
Cu(NO3)2
+2NO2+2H2O
5.氮的氢化物结构与性质
氢化物的名称
氨气
氢化物分子式
NH3
电子式
HH
分子构型
三角锥形
键的极性
极性
晶体类型
分子晶体
颜色和状态
无色刺激性气味气体
毒性
无毒
与O2反应
4NH3+5O24NO+6H2O
4NH3+3O2 2N2+6H2O
与水反应
NH3+H2ONH3H2O
NH+4+OH-
与酸反应
NH3+HClNH4Cl
制法
N2+3H22NH3(工业)
2NH4Cl+Ca(OH)22NH3
+CaCl2+2H2O
6.硝酸性质
物质
硝酸
颜色状态
纯硝酸为无色易挥发液体,因溶解部分NO2呈黄色
挥发性
易挥发,有刺激性气体
水溶性
与水互溶,强酸,有酸的通性
稳定性
不稳定,见光或受热分解
4HNO34NO2+O2+2H2O
氧化性
能氧化Au、Pt外所有金属和部分非金属C+4HNO3浓CO2+2H2O+4NO2;Cu+4HNO3浓Cu(NO3)2+2NO2+2H2O
实验室制法
NaNO3+H2SO4浓NaHSO4+HNO3(HNO3易分解不能加热)
工业制法(氨氧化法)
4NH3+5O24NO+6H2O
2NO+O22NO2;3NO2+H2O2HNO3+NO
鉴别
铜与浓硝酸反应产生红棕色NO2气体
8.氨和铵盐的性质与制法
氨(NH3)
铵(NH+4)
名称与符号
颜色与状态
无以刺激性气味气体
白色晶体
化学键类型
共价键
共价键、离子键、配位键
晶体类型
分子晶体
离子晶体
水溶性
易溶于水,溶液为减性
均易溶于水,溶液多酸性
化学性质
① ① 水合反应:
NH3+H2ONH3H2ONH+4+OH-
② 同O2反应:4NH3+5O24NO+6H2O
③ 同酸反应:NH3+HNO3NH4NO3
① ① 同碱反应:
2NH4Cl+Ca(OH)3CaCl2+2NH3
+2H2O;NH+4+OH-NH3+H2O
② ② 受热分解
2NH4NO32N2+O2+4H2O
③水解NH+4+H2ONH3·H2O+H+
制法
2NH4Cl+Ca(OH)22NH3+CaCl2+2H2O
N2+3H2 2NH3
NH3+CO2+H2ONH4HCO3
2NH3+H2SO4(NH4)2SO4
鉴别
与HX冒白烟,湿红石芯试纸变蓝
与碱混合加热有使石蕊试纸变蓝气体
相互关系
NH3 NH+4
9.硝酸盐性质与鉴别
盐类
硝酸盐
颜色状态溶解性
一般为无(白)色晶体一般都
易溶于水
热稳定性
加热时都易分解,分解规律:K+Na+,Mg2+Cu2+,Ag+Au3+
鉴别
硝酸盐与浓H2SO4
铜片共热产生红棕色气体4NaNO3+2H2SO4(浓)+Cu2Na2SO4+Cu(NO3)2
+2NO2+2H2O
10.氧化还原反应:
基
本
概
念
氧化还原反应:有电子转移的反应。(特征元素化合物有变化)
氧化反应:原子或离子失电子反应。化合介升高
还原反应:原子或离子得电子反应。化合价降低
氧化剂:得电子物质。得电子能力越强氧化性越强
还原剂:失电子物质。失电子能力越强还原性越强
转
化
关
系
还原性
化合价升高
还原剂氧化反应氧化产物 产物
氧化剂还原反应还原产物
反应物
化合价降低
氧化性
电子转
移表示法
单箭号表示法 表示意义
二者主要区别 箭号起止
双箭号表示法 电子数目
方程式配平
依据原则:氧化剂化合价降低总数=还原剂化合价升高总数
方法 找出价态变化,看两剂分子式,确定升降总数
步骤 求最小公倍数,得两剂系数,观察配平其它。
有关计算
关键是依据氧化剂得电子总数与还原剂失电子总数相等,列出守恒关系式求解。
知识点、能力点提示
1.通过对基本概念的学习,使学生对氧化还原反应的特征、实质和转换关系有正确认识;能从具体反应中识别出氧化剂、还原剂、氧化产物、还原产物;会进行多个氧化还原反应的比较或者从物质化合价来确定氧化剂、还原剂相对强弱。
2.要求学生熟练地掌握“单线桥”法表示电子转移方向和数目。
3.根据氧化剂得电子总数等于还原剂失电子总数的原则,用化合价升降法熟练地配平氧化还 原反应方程式,了解最小公倍法(找出反应前后出现“个数”最多的原子,按最小公倍数进行配平)配平氧—还反应的方法;对有缺项不完整的反应式,能先根据反应物与生成物的差异正确判断缺项物质,然后加以配平。
4.通过综合归纳、总结,掌握氮族元素的变化规律。其中包含①周期表中的位置,单质化学 性质递变。②气态氢化物物理、化学性质及实验室制法(NH3、PH3)。③通过比较NO、NO 2、P2O5、HNO3、H3PO4掌握氧化物和酸的性质。④由常见无机盐性质对比对硝 酸盐、磷酸盐、磷酸氢盐、磷酸二氢盐溶解性、热稳定性及重要的化学性质(含磷酸盐与酸 式盐间转化)有正确的认识。⑤由N、P、As单质、氧化物和酸性质的学习,掌握非金属及氧 化物和酸的反应规律。⑥通过磷酸盐、磷酸氢盐、磷酸二氢盐性质学习,掌握酸式盐和弱酸 盐的反应规律。⑦由H2O同NO2,水同P2O5,水同NO+O2等有水参加的反应,认识到在化学反应中除水是重要的溶剂外还直接参与许多化学反应。⑧从P与O2(量不同)反应 ,Ca3(PO4)2同H2SO4(量不同)反应,H3PO4与Ca(OH)2反应(量不同),Cu与 HNO3反应(浓度不同),P2O5与水反应(温度不同)条件不同,产物不同;弄清反应条件 同反应产物的关系。
5.由概念辨析:能正确运用本章所学知识。例红磷、白磷性质对比及相互转化;“五水” 与其它“水”区别;从氮元素化合价态变化;分析氮元素的氧化性和还原性;选用一种试剂鉴别多种物质的方法,这些都要求掌握。
6.完成思维迁移,简答题要求叙述准确并会解信息给予题。解简答题一般要抓三点:①认真审题②分析题意③用简明文字配合方程式写出答案。解信息给予题必须紧紧抓住题干给予的信息知识,在类比推论中注意题干的信息及推论的科学依据,完成知识的迁移。
7.要求对本章涉及计算题能进行归类,并且会正确的推论辨认。如本章中有关NO、NO2、O2不同组合同水反应的计算,就要先对这类气体混合物作总体定性分析,然后归纳成三种情况进行求解。涉及H3PO4同碱反应的计算也应如此处理。对于鉴别推断题要从实验现象中特殊现象以及反应的特殊规律等为突破口展开推断,直至有关物质全部推出。
相关文档
- 2020届高考化学一轮复习化学能和热2021-07-0814页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0811页
- 2020届高考化学一轮复习化学反应速2021-07-0813页
- 2020版高考一轮复习化学通用版学案2021-07-0811页
- 2020届高考化学一轮复习化学反应速2021-07-0816页
- 2020届高考化学一轮复习化学平衡图2021-07-0825页
- 2020届高考化学一轮复习化学反应速2021-07-089页
- 2021届高考化学一轮复习化学平衡图2021-07-0811页
- 2020届高考化学一轮复习化学常用计2021-07-089页
- 2020届高考化学一轮复习化学能与热2021-07-087页