- 1.63 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第1讲 化学实验常用仪器及基本操作
学习指导意见
核心素养
1.了解化学实验室常用仪器的主要用途和使用方法。
2.掌握化学实验的基本操作,熟悉化学品安全使用标识,知道常见废弃物的处理方法及实验室突发事件的应对措施。
3.能运用实验基本操作实施实验方案。
1.科学探究与创新意识:能根据题给信息,明确探究实验的目的原理,设计实验方案,分析解决实验中出现的问题。
2.证据推理与模型认知:从实验的本质对实验题进行分类建模,能运用模型解释化学现象,依据答题模板快速准确的回答问题。
考点一 常用仪器的用途和使用
[学在课内]
1.加热仪器——酒精灯
(1)加热时用外焰加热;
(2)酒精灯中的酒精量不超过容积的2/3,不少于1/4;
(3)绝对禁止向燃着的酒精灯里添加酒精,以免失火;
(4)绝对禁止用燃着的酒精灯引燃另一只酒精灯;
(5)用完酒精灯,必须用灯帽盖灭,不可用嘴去吹。
2.可加热的仪器
(1)直接加热仪器
(2)需垫石棉网加热的仪器
仪器图形和名称
主要用途
使用方法及注意事项
配制、稀释溶液或作液体用量较多的反应容器;有时可代作水浴锅用
溶解固体或混合溶液时要轻轻搅拌,加热时盛液量不超过容积的2/3
不加热或加热情况下进行反应的容器;喷泉实验中充装气体的仪器
加热时盛液量不超过球部容积的1/2
液体的蒸馏
加热时,加碎瓷片(或沸石)防止暴沸,液体加入量不要超过容积的1/2,蒸馏(分馏)时,温度计水银球宜在支管口处
中和滴定的反应容器;蒸馏操作的承接器;也常代替烧瓶组装成气体发生装置
加热时盛液量不超过容积的1/2,滴定实验时液体不能太多,便于滴定时振荡
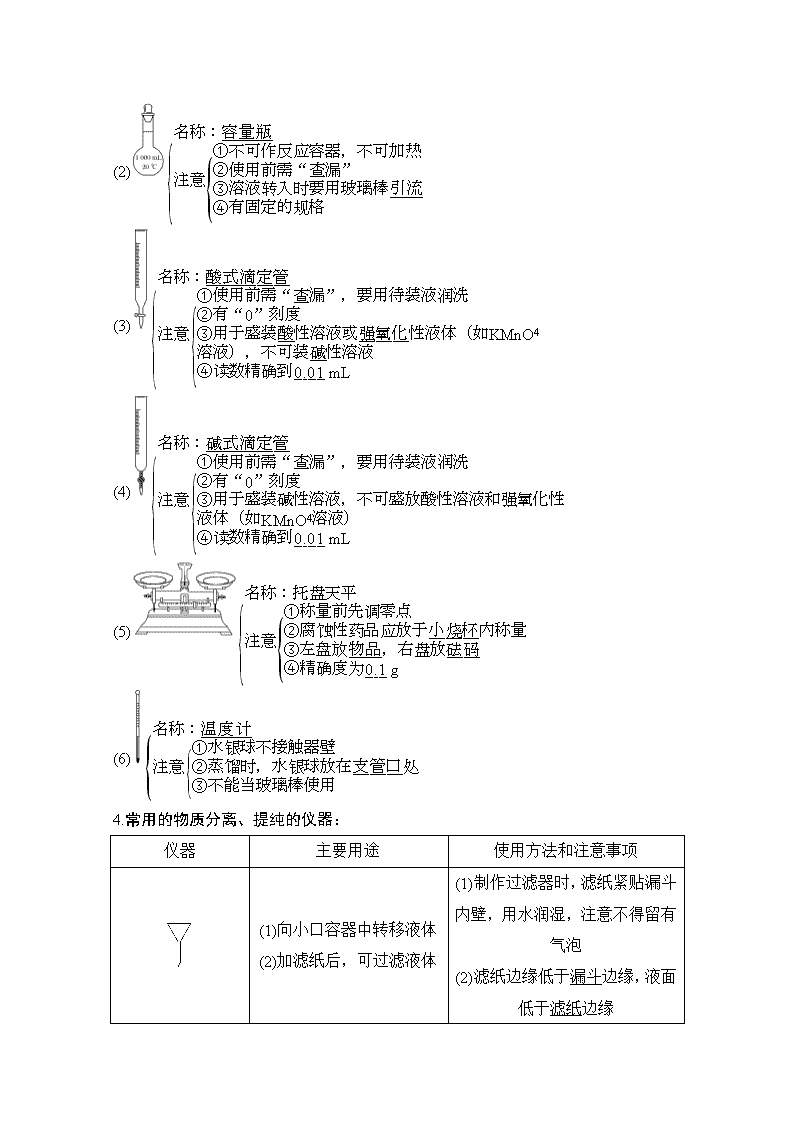
3.计量仪器
(1)
(2)
(3)
(4)
(5)
(6)
4.常用的物质分离、提纯的仪器:
仪器
主要用途
使用方法和注意事项
(1)向小口容器中转移液体
(2)加滤纸后,可过滤液体
(1)制作过滤器时,滤纸紧贴漏斗内壁,用水润湿,注意不得留有气泡
(2)滤纸边缘低于漏斗
边缘,液面低于滤纸边缘
(1)用于随时添加液体
(2)萃取、分液
(1)注意活塞不得渗漏
(2)分离液体时,下层液体由下口放出,上层液体由上口倒出
蒸发或浓缩溶液
可直接加热,加热时液体体积不超过其容积的2/3,当有大量固体出现时停止加热
组装蒸馏装置,将蒸气冷凝为液体
蒸气流的方向与冷却水流的方向相反
除去气体中的杂质,其中广口瓶可换作大试管或锥形瓶
(1)一般选择能与杂质气体反应的试剂作吸收剂
(2)装入液体量不宜超过容积的2/3
(3)气体的流向为A进B出
用于干燥或吸收某些气体,干燥剂为粒状,常用CaCl2、碱石灰
(1)注意干燥剂或吸收剂的选择
(2)一般为大口进气,小口出气
[考在课外]
教材延伸
判断正误
(1)高温焙烧时,用于盛放固体的仪器名称是蒸发皿(×)
(2)用10 mL量筒量取8.58 mL蒸馏水(×)
(3)洗净的锥形瓶和容量瓶可以放进烘箱中烘干(×)
(4)分离Br2和CCl4混合物的主要仪器是分液漏斗、烧杯(×)
(5)如图A配制250 mL 0.1 mol·L-1的盐酸(×)
(6)如图B用稀盐酸滴定NaOH溶液(×)
(7)用如图C装置可以准确量取一定体积的K2Cr2O7标准溶液(×)
(8)图D记录滴定终点读数为12.20 mL(×)
拓展应用
教材常见仪器的识别与使用
(1)图1中装置A的名称是________。
(2)图2中仪器D的名称是________。
(3)图3中仪器X的名称是________。
(4)图4中仪器B的名称是________。
(5)图5中的仪器名称:仪器A________,仪器B________。
(6)实验室过滤所需的玻璃仪器是________。
(7)浓缩硫酸锌、硫酸铜溶液使用的器皿名称是________。
(8)图1和图4实验装置中冷凝管的主要作用是________。
(9)制取KClO3实验结束后,取出含有KClO3溶液的试管,冷却结晶,过滤,洗涤,该实验操作过程需要的玻璃仪器有__________________________________
____________________________________________________________。
答案 (1)球形干燥管 (2)锥形瓶 (3)圆底烧瓶 (4)球形冷凝管 (5)坩埚 500 mL容量瓶 (6)漏斗、烧杯、玻璃棒 (7)蒸发皿 (8)冷凝回流 (9)烧杯、漏斗、玻璃棒、胶头滴管(不填“胶头滴管”也可)
思维探究
(1)下列实验中仪器的末端必须插入液面以下的是________。
①制备氢气的简易装置中用来加入稀硫酸的长颈漏斗
②实验室用MnO2和浓盐酸制备氯气装置中的分液漏斗
③用胶头滴管向盛有液体的试管中滴加液体
④用乙醇、浓H2SO4混合加热制乙烯实验中的温度计
答案 ①④
(2)球形冷凝管可用于组装反应装置而不能用于组装蒸馏装置的原因是____________________________________________________________
____________________________________________________________。
答案 蒸馏装置冷凝后的液体容易残留在球形区域内
(3)冷凝管中蒸馏水下进上出的原因是
____________________________________________________________。
答案 ①气水逆向,冷凝效果好;②下进上出可使蒸馏水充满整个冷凝管,冷凝效果好。
[基础点巩固]
1.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验中所选用的仪器合理的是( )
①用50 mL量筒量取5.2 mL稀硫酸 ②用分液漏斗分离苯和四氯化碳的混合物 ③用托盘天平称量11.7 g氯化钠晶体 ④用碱式滴定管取23.10 mL溴水 ⑤用瓷坩埚灼烧各种钠化合物 ⑥用250 mL容量瓶配制250 mL 0.2 mol·L-1的NaOH溶液
A.①②④ B.②③④⑥
C.③⑥ D.③⑤⑥
解析 ①量取5.2 mL稀硫酸用10 mL量筒,错误;②苯和四氯化碳互溶,不能用分液漏斗分离,错误;③托盘天平精确到0.1 g,可以称量11.7 g氯化钠,正确;④溴能腐蚀橡胶,量取溴水用酸式滴定管,错误;⑤瓷坩埚不能用来灼烧NaOH、Na2CO3等,错误;⑥配制250 mL 0.2 mol·L-1的NaOH溶液,选择250 mL容量瓶,正确。
答案 C
2.仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的的是( )
选项
实验目的
玻璃仪器
A
分离水和食用油
长颈漏斗、烧杯、玻璃棒
B
配制100 mL 0.2 mol·L-1的NaOH溶液
100 mL容量瓶、烧杯、玻璃棒
C
从食盐水中提取NaCl
酒精灯、蒸发皿、玻璃棒
D
分离水与泥沙
分液漏斗、烧杯
解析 A项,分离水和食用油,要采用分液的方法,要用到分液漏斗、烧杯;B项,缺胶头滴管;D项,要用过滤的方法分离,要用到漏斗、烧杯、玻璃棒。
答案 C
3.草酸晶体(H2C2O4·2H2O)100 ℃开始失水,101.5 ℃熔化,150 ℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是( )
解析 加热固体时,为防止水蒸气液化后倒流,试管口一般向下倾斜,但本题中考虑到草酸晶体在101.5 ℃时熔化,为了达到实验目的,需要持续加热到150 ℃左右,因此,选择装置D。
答案 D
4.过碳酸钠(Na2CO4
)是一种很好的供氧剂,其与稀盐酸反应的化学方程式为:2Na2CO4+4HCl===4NaCl+2CO2↑+O2↑+2H2O。市售过碳酸钠一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下方案实施:
按下图安装好实验装置,Q为一塑料气袋,随意取适量样品于其中,打开分液漏斗活塞,将稀盐酸滴入气袋中至充分反应。
(1)为测定反应生成气体的总体积,滴稀盐酸前必须关闭________,打开________(填“K1”“K2”或“K3”)。导管a的作用是________________________。
(2)当上述反应停止后,使K1、K3处于关闭状态,K2处于打开状态,再缓缓打开K1。B中装的固体试剂是________,为何要缓缓打开K1?
____________________________________________________________。
解析 (1)方案的原理为:Q为一塑料气袋,当Q里面产生气体后,压强会增大,气袋膨胀,赶出的气体经K3,用排水法由量筒Ⅰ测得其体积,此体积为反应生成的气体的总体积,即CO2和O2的总体积。由上述原理不难看出,滴加盐酸前,要关闭K1、K2,打开K3。
(2)当反应停止后,关闭K3,打开K2通入空气,同时打开K1,将Q中的气体赶出,经装置B后进入量筒Ⅱ,测得氧气的体积,所以必须要除去CO2,因此B中装的固体为碱石灰,缓缓打开K1是为了让Q中的气体缓慢地流出,让生成的CO2能充分被B中的碱石灰吸收,使量筒内收集到较纯的O2。
答案 (1)K1、K2 K3 平衡分液漏斗内和反应体系内压强,使稀盐酸顺利滴下,同时消除滴下稀盐酸的体积对气体体积的影响 (2)碱石灰 让生成的二氧化碳能充分被b中碱石灰吸收,使量筒内收集到较纯的O2
[名师点拨]
仪器的创新使用
在掌握实验仪器常规使用方法的基础上,能利用实验原理对仪器进行创新,如以下几种仪器或装置均进行了创新组合使用。
防倒吸吸收装置
简易启普发生器
用碱式滴定管改装的量气装置
防倒吸吸收装置
平衡气压的设计
破旧仪器的重新使用
[能力点提升]
5.下列有关实验装置进行的相应实验,能达到实验目的的是( )
A.用图①所示装置制取少量纯净的CO2气体
B.用图②所示装置验证镁和稀盐酸反应的热效应
C.用图③所示装置制取并收集干燥纯净的NH3
D.用图④所示装置制备Fe(OH)2并能保证较长时间观察到白色
解析 用图①所示装置制取少量CO2气体时,应用稀盐酸和CaCO3,A项错误;可以通过图②
装置U形管左右两端的液面差验证镁和稀盐酸反应的热效应,B项正确;氨气的密度比空气小,应用向下排空气法收集,C项错误;图④装置中酒精与水互溶,不能将FeSO4溶液与空气隔绝,D项错误。
答案 B
6.茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧和⑩
解析 灼烧茶叶需用仪器有坩埚、泥三角、酒精灯等,A项正确;溶解茶叶灰的过程中会用到烧杯、玻璃棒等仪器,容量瓶是配制一定体积、一定物质的量浓度溶液时的主要仪器,B项错误;过滤需用仪器有漏斗、烧杯、玻璃棒等,C项正确;检验Fe3+可用KSCN溶液,仪器为胶头滴管和试管,D项正确。
答案 B
7.根据下列装置回答问题:
(1)收集气体(如图A),若用排空气法收集CO2,则应从________口进气;若瓶中装满饱和食盐水,从________口进气,收集Cl2;也可用A装置除去Cl2 中的少量HCl,则广口瓶中应盛放________,从________口进气。
答案 b a 饱和食盐水 b
(2)装置E可用于贮存少量气体,若E中收集了少量H2,怎样排出H2?
____________________________________________________________。
答案 打开止水夹,向长颈漏斗中注入适量蒸馏水
(3)图中可用于测量气体体积的是________(填装置字母,下同),用作安全瓶的是________,接在气体连续制备的实验装置中间,用于控制气流平稳的装置是____________________________________________________________。
答案 C D B
(4)用于监控气体流速(如图F),广口瓶中盛有液体,从________端通入气体,根据液体中产生气泡的速率来监控通入气体的流速。
答案 a
[高考真题体验]
8.下列有关仪器使用或实验操作叙述错误的是( )
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D.向容量瓶转移液体时,引流用玻璃棒可以接触容量瓶内壁
解析 A.过滤操作中,漏斗的尖端应接触烧杯内壁,使液体顺利流下,正确;B.从滴瓶中取用试剂时,滴管的尖嘴接触试管内壁,容易造成试剂污染,错误;C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁,使残余在滴定管尖嘴处的液体进入到锥形瓶,正确;D.向容量瓶转移液体时,用玻璃棒引流可以接触容量瓶内壁,正确。故选B。
答案 B
9.下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( )
A.用装置甲灼烧碎海带
B.用装置乙过滤海带灰的浸泡液
C.用装置丙制备用于氧化浸泡液中I-的Cl2
D.用装置丁吸收氧化浸泡液中I-后的Cl2尾气
解析 灼烧应在坩埚中进行,A项错误;海带灰浸泡液通过过滤可得海带灰和滤液,B项正确;浓HCl与MnO2反应制备Cl2时需要加热,C项错误;Cl2在饱和NaCl溶液中的溶解度小,应用碱液吸收,D项错误。
答案 B
10.下列选用的仪器和药品能达到实验目的的是( )
A
B
C
D
制乙炔的发生装置
蒸馏时的接收装置
除去SO2中的少量HCl
准确量取一定体积K2Cr2O7标准溶液
解析 A项,长颈漏斗的下端未插入溶液中,不能形成密封环境,且电石与水反应过快,应采用分液漏斗滴加饱和食盐水来控制反应速率,错误;B项,锥形瓶与接收器之间应与环境相通,以平衡压强,这样构成密闭环境使液体无法流下,会造成危险,错误;C项,HCl可与饱和NaHSO3溶液反应而除去,SO2不反应,正确;D项,K2Cr2O7标准溶液具有强氧化性,会腐蚀碱式滴定管下端的乳胶管,应盛放在酸式滴定管中,错误。
答案 C
考点二 化学实验的基本操作
[学在课内]
1.药品取用
(1)根据药品的性状和用量选择取用方法
(2)图示向仪器中加入药品的操作方法
①向容器内加固体药品
②向容器内加液体药品
2.常见试纸的使用
(1)试纸的类型和使用范围
(2)试纸的使用方法
①检验液体:取一小块试纸放在表面皿或玻璃片上,用洁净玻璃棒蘸取待测液点在试纸的中部,观察试纸颜色的变化。
②检验气体:一般先将试纸用蒸馏水湿润,粘在玻璃棒的一端,并使其接近出气口,观察颜色的变化。
3.物质的溶解
(1)固体的溶解
常用仪器:烧杯、试管、玻璃棒等。
促溶方法:加热、研细、搅拌或振荡等。
(2)气体物质的溶解或吸收
①溶解度不大的气体,如CO2、Cl2、H2S等,用如图a所示装置;
②极易溶于水的气体,如NH3、HCl等,用如图b所示装置。
(3)液体物质的溶解(稀释):一般把密度较大的液体加入到密度较小的液体中,如浓硫酸的稀释、浓硫酸与浓硝酸的混合。
4.仪器的洗涤
常见残留物的洗涤
残留物
洗涤剂
容器里附有的油污
NaOH溶液或热的纯碱溶液
容器壁上附着的硫
CS2或热的NaOH溶液
试管上的银镜
稀HNO3
AgCl
氨水
容器内残留的MnO2
热的浓盐酸
5.仪器的安装、连接
(1)安装顺序:一般从热源开始,按先下后上、从左到右的顺序。
(2)连接顺序:洗气时,“长进短出”,如图a;量气装置“短进长出”,如图b;干燥管除杂时“大进小出”,如图c。
[考在课外]
教材延伸
判断正误
(1)向试管中滴加少量液体时,胶头滴管呈垂直悬空,不能插入试管中(√)
(2)用药匙将锌片放入试管中(×)
(3)过滤时,使用玻璃棒引流(√)
(4)可通过漏斗向酒精灯添加酒精(√)
(5)过滤时,玻璃棒与三层滤纸的一边接触(√)
(6)过滤时,漏斗下端紧贴烧杯内壁(√)
(7)酒精灯不慎着火,应立即吹熄(×)
拓展应用
指出下图操作中的错误。
(1)____________________________________________________________。
(2)____________________________________________________________。
(3)____________________________________________________________。
答案 (1)块状固体直接落入试管底部,易砸破试管
(2)①瓶塞正放在桌面上;②试剂瓶标签未面向手心;③试剂瓶瓶口未紧靠试管口;④试管未倾斜45°
(3)胶头滴管伸入试管内
思维探究
(1)指出下列仪器使用或实验的第一步操作
①气体的制取与性质探究实验_______________________________。
②点燃氢气或甲烷等可燃性气体____________________________。
③用淀粉碘化钾试纸检验氯气______________________________。
④用托盘天平称量固体烧碱__________________________________。
⑤使用时第一步操作必须检查是否漏水的常见仪器有____________________________________________________________。
答案 ①检查装置的气密性 ②检验气体的纯度 ③润湿 ④调零 ⑤分液漏斗、酸式滴定管、碱式滴定管、容量瓶
(2)浓硫酸稀释时应将浓硫酸缓缓加入水中的原因:
____________________________________________________________。
答案 ①密度大的液体加入密度小的液体中有利于二者混合;②浓硫酸的量少,放出的热量少,以免暴沸
[基础点巩固]
1.实验是化学研究的基础,下图装置或操作正确的是( )
A.用①制备氢气并检验H2的可燃性
B.用装置②制备Cl2
C.用装置③陶瓷坩埚高温煅烧CaCO3固体
D.关闭活塞a,从b处加水,以检查装置④的气密性
解析 点燃可燃性气体前必须验纯,故A错误;氯气密度比空气大,应用向上排空气法收集,图中进气管太短,出气管太长,故B错误;高温下碳酸钙会腐蚀陶瓷坩埚,故C错误;关闭活塞a,从b处加水,如U形管两侧形成液面差且在一段时间内不变化,可说明气密性良好,能达到实验目的,故D正确。
答案 D
2.用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)( )
A.用装置甲检验溶液中是否有K+
B.用装置乙验证牺牲阳极的阴极保护法
C.用装置丙进行中和热的测定
D.用装置丁加热熔融NaOH固体
解析 A.观察K的焰色反应需要透过蓝色的钴玻璃,由图可知,缺少蓝色的钴玻璃,故A错误;B.Fe为正极,锌为负极,铁被保护,属于牺牲阳极的阴极保护法,故B正确;C.为了使反应物充分反应,需要环形玻璃搅拌棒,由图可知,缺少环形玻璃搅拌棒,故C错误;D.瓷坩埚中的二氧化硅与NaOH反应,仪器选择不合理,应使用铁坩埚,故D错误;故选B。
答案 B
3.下列是一些装置气密性检查的方法,其中正确的是( )
解析 A、C、D中都未形成封闭体系。
答案 B
[名师点拨]
实验中的“第一步”
1.检查是否漏水——滴定管、容量瓶、分液漏斗等有活塞或瓶塞的玻璃仪器。
2.验纯——点燃可燃性气体。
3.润湿——用红色石蕊试纸、蓝色石蕊试纸、淀粉KI试纸检验某些气体,但用pH试纸测溶液的pH时不能润湿。
4.调平衡——托盘天平的使用。
5.取样,溶解——用化学方法检验、鉴别固体物质。
[能力点提升]
4.TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
实验室利用反应TiO2(s)+CCl4(g)TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
有关物质性质如下表:
物质
熔点/℃
沸点/℃
其他
CCl4
-23
76
与TiCl4互溶
TiCl4
-25
136
遇潮湿空气产生白雾
仪器A的名称是________。装置E中的试剂是________。反应开始前依次进行如下操作:
组装仪器、________、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为________(填序号)。欲分离D中的液态混合物,所采用操作的名称是________。
答案 干燥管 浓H2SO4 检查装置气密性 ②③① 分馏(或蒸馏)
5.某兴趣小组探究亚硝酸钠与硫酸反应的气体产物成分。
已知:①NO+NO2+2OH-===2NO+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃
(1)反应前应打开弹簧夹,先通入一段时间氮气,目的是
____________________________________________________________。
(2)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):A、C、________、________、________。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,装置A中产生红棕色气体。
①确认装置A中产生的气体含有NO,依据的现象是
____________________________________________________________。
②装置B的作用是___________________________________________。
答案 (1)排尽装置中的空气,防止生成的NO被氧化,干扰气体产物的检验
(2)E D B
(3)①D中通入氧气后,气体由无色变为红棕色 ②尾气处理,吸收氮氧化物,防止空气污染
[高考真题体验]
6.下列实验操作不当的是( )
A.用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率
B.用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂
C.用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+
D.常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二
解析 加几滴CuSO4溶液后,Zn与CuSO4反应生成Cu,从而形成无数微小的原电池,加快了生成H2的速率,A项不符合题意;酚酞的变色范围为8.2
相关文档
- 2020届高考化学一轮复习化学能和热2021-07-0814页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0811页
- 2020届高考化学一轮复习化学反应速2021-07-0813页
- 2020版高考一轮复习化学通用版学案2021-07-0811页
- 2020届高考化学一轮复习化学反应速2021-07-0816页
- 2020届高考化学一轮复习化学平衡图2021-07-0825页
- 2020届高考化学一轮复习化学反应速2021-07-089页
- 2021届高考化学一轮复习化学平衡图2021-07-0811页
- 2020届高考化学一轮复习化学常用计2021-07-089页
- 2020届高考化学一轮复习化学能与热2021-07-087页