- 401.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
电能转化为化学能——电解
一、选择题
1.下列各装置中,在铜电极上不能产生气泡的是( )
解析 A中装置是原电池,Zn作负极,Cu作正极,所以H2在Cu电极上产生;B中装置是电解池,Cu是阳极,发生反应Cu-2e-===Cu2+,Ag是阴极,发生反应2H++2e-===H2↑,所以Cu电极上没有气泡产生;C中装置是原电池,Fe是负极,Cu是正极,H2在Cu电极上产生;D中装置是电解池,Ag是阳极,Cu是阴极,H+在Cu电极上放电产生H2,所以Cu电极上有气泡产生。
答案 B
2.某电解池内盛有CuSO4溶液,插入两根电极,接通直流电源后,欲达到如下要求:①阳极质量不变;②阴极质量增加;③电解液pH减小,则应选用的电极是( )
A.阴阳两极不都是石墨
B.铜作阳极,铁作阴极
C.铁作阳极,铜作阴极
D.铂作阳极,铜作阴极
解析 由题干要求可知,该电解过程为阳极以惰性电极电解CuSO4溶液,阳极OH-放电,产生氧气,pH减小。
答案 D
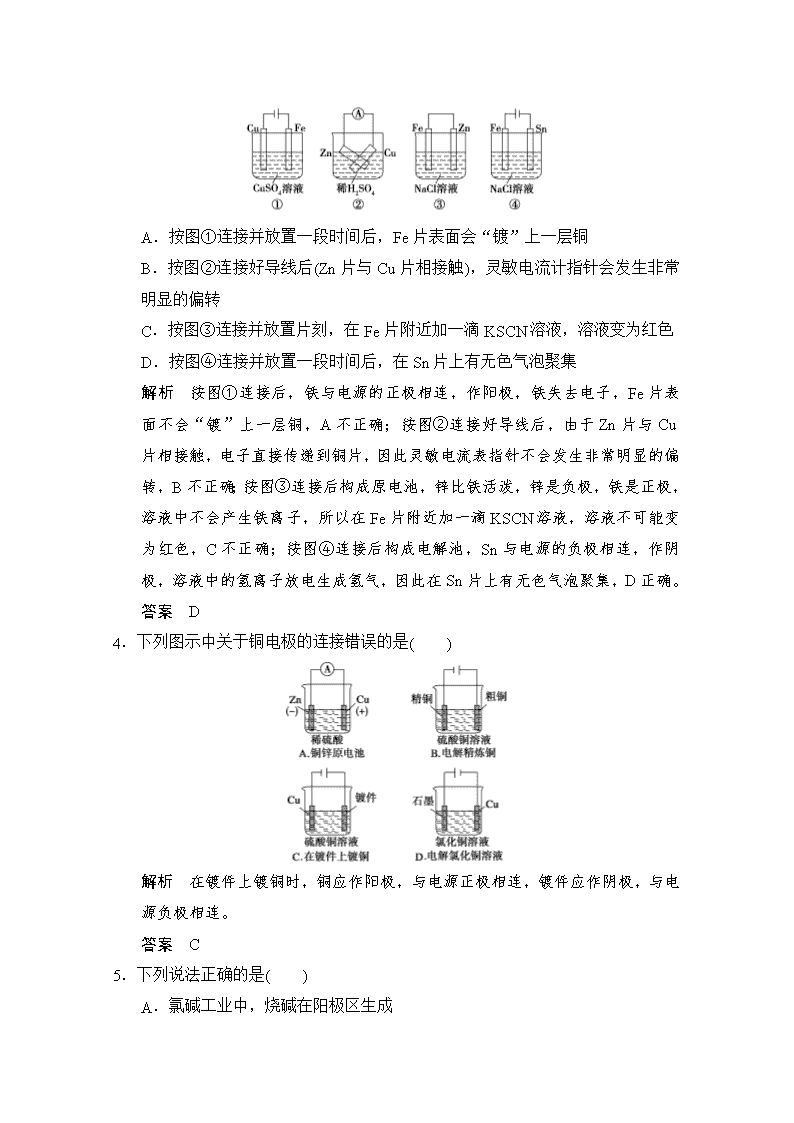
3.根据图示判断下列叙述符合事实的是( )
A.按图①连接并放置一段时间后,Fe片表面会“镀”上一层铜
B.按图②连接好导线后(Zn片与Cu片相接触),灵敏电流计指针会发生非常明显的偏转
C.按图③连接并放置片刻,在Fe片附近加一滴KSCN溶液,溶液变为红色
D.按图④连接并放置一段时间后,在Sn片上有无色气泡聚集
解析 按图①连接后,铁与电源的正极相连,作阳极,铁失去电子,Fe片表面不会“镀”上一层铜,A不正确;按图②连接好导线后,由于Zn片与Cu片相接触,电子直接传递到铜片,因此灵敏电流表指针不会发生非常明显的偏转,B不正确;按图③连接后构成原电池,锌比铁活泼,锌是负极,铁是正极,溶液中不会产生铁离子,所以在Fe片附近加一滴KSCN溶液,溶液不可能变为红色,C不正确;按图④连接后构成电解池,Sn与电源的负极相连,作阴极,溶液中的氢离子放电生成氢气,因此在Sn片上有无色气泡聚集,D正确。
答案 D
4.下列图示中关于铜电极的连接错误的是( )
解析 在镀件上镀铜时,铜应作阳极,与电源正极相连,镀件应作阴极,与电源负极相连。
答案 C
5.下列说法正确的是( )
A.氯碱工业中,烧碱在阳极区生成
B.电解熔融氯化铝冶炼金属铝
C.电镀时,用镀层金属作阳极
D.将钢闸门与外电源正极相连,可防止其腐蚀
解析 A项,水中的H+在阴极放电,烧碱在阴极区生成,错误;B项,氯化铝是共价化合物,熔融状态不导电,错误;C项,电镀时,镀层金属作阳极,镀件作阴极,正确;D项,由外加电流的阴极保护法知,被保护的金属应与电源的负极相连,错误。
答案 C
6.某化学小组设计的电解饱和食盐水的装置如图所示,通电后两极均有气泡产生。下列说法正确的是( )
A.观察到铜电极附近有黄绿色气体产生
B.通电后,石墨电极附近溶液立即变红色
C.溶液中的Na+向石墨电极移动
D.铜电极上发生还原反应
解析 根据电解饱和食盐水的装置,如果通电后两极均有气泡产生,则金属铜电极一定是阴极,该电极上的反应为2H++2e-===H2↑,阳极上氯离子失电子,发生的电极反应为2Cl--2e-===Cl2↑。铜电极上产生的H2为无色气体,A项说法错误;石墨电极是阳极,该电极上发生的反应为2Cl--2e-===Cl2↑,可以观察到黄绿色气体产生,由于阳极反应不产生OH-,而阴极反应产生的OH-迁移至阳极附近需要一段时间,故通电后,石墨电极附近溶液不能立即变红色,B项说法错误;电解池中,阳离子移向阴极,即Na+移向铜电极,C项说法错误;金属铜电极是阴极,阴极发生还原反应,D项说法正确。
答案 D
7.某小组进行电化学研究,甲同学设计图甲的原电池装置,乙同学利用甲设计的装置及图乙提供的药品与材料,不能完成的实验是( )
图甲 图乙
A.使甲同学的正极变为负极
B.设计一个新的原电池
C.在石墨电极上镀锌
D.使锌电极受到保护
解析 A项,将铜与石墨相连,以AgNO3溶液作电解质溶液,铜为负极,正确;B项,铝-铜-AgNO3溶液、铝-铜-CuSO4溶液等均可以组成新的原电池,正确;C项,镀锌是电解池,缺少含锌离子的电解质溶液。错误;D项,锌、铝作电极,锌作正极,受到保护,正确。
答案 C
8.关于下列装置的说法正确的是( )
A.装置①中盐桥内的K+向CuSO4溶液移动
B.①是将电能转变成化学能的装置
C.若装置②用于铁棒镀铜,则N极为铁棒
D.若装置②用于电解精炼铜,溶液中Cu2+浓度保持不变
解析 装置①为原电池,将化学能转化为电能,Cu为正极,溶液中的Cu2+得电子生成Cu,c(Cu2+)减小,盐桥内的K+移向CuSO4溶液补充电荷,A正确,B错误;C项,若铁棒镀铜,铁作阴极(M),铜作阳极(N),错误;D项,精炼铜,阳极除铜外还有比铜活泼的金属如Zn、Fe放电,而阴极只有Cu2+放电,所以Cu2+浓度会减小,错误。
答案 A
9.用如图所示装置Ⅰ通电10分钟后,去掉直流电源,连接成如图所示装置Ⅱ,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。下列说法正确的是( )
A.同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多
B.用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-===Fe(OH)2
C.用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-===H2↑
D.装置Ⅰ通电10分钟后铁电极周围溶液pH降低
解析 装置Ⅰ中石墨电极上生成Cl2,铁电极上生成H2,因Cl2能溶解在水中,且与H2O发生反应:Cl2+H2O===HCl+HClO,而H2不溶于水,故石墨电极上方得到的气体比铁电极上方得到的气体少,A错误;装置Ⅱ是原电池装置,Fe为负极,失去电子生成Fe2+,Fe2+再与溶液中的OH-反应生成Fe(OH)2,即电极反应为Fe-2e-+2OH-===Fe(OH)2,B正确;装置Ⅱ中石墨为正极,正极发生的是Cl2得到电子的反应,故石墨电极的电极反应为Cl2+2e-===2Cl-,C错误;装置Ⅰ中铁电极上产生H2,电极反应为2H2O+2e-===H2↑+2OH-,由于有OH-生成,故溶液的pH升高,D错误。
答案 B
10.如图a、b、c、d均为石墨电极,通电进行电解(电解液足量)下列说法正确的是( )
A.向乙中加入适量盐酸,溶液组成可以恢复
B.电解时向乙中滴入酚酞溶液,c电极附近变红
C.当b极有64 g Cu析出时,c电极产生2 g气体
D.甲中a极上的电极反应式为:4OH--4e-===O2↑+2H2O
解析
由图可知a为阳极,b为阴极,c为阳极,d为阴极。乙池的总反应为2NaCl+2H2O2NaOH+H2↑+Cl2↑,脱离溶液的是H2和Cl2,恢复组成通HCl,A项错误;c为阳极,溶液中的Cl-放电生成Cl2,d为阴极,水中的H+放电:2H2O+2e-===H2↑+2OH-,乙池中滴入酚酞,d极附近变红,B项错误;当b极有64 g Cu析出,由Cu2++2e-===Cu,可知转移2 mol e-,c极发生反应:2Cl--2e-===Cl2↑,生成1 mol Cl2,质量为71 g,C项错误;a极为阳极,溶液中的OH-放电,正确。
答案 D
11.研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中正确的是( )
A.由TiO2制得1 mol金属Ti,理论上外电路通过2 mol 电子
B.阳极的电极反应式为C+2O2--4e-===CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
解析 A选项,由TiO2制得1 mol金属Ti,Ti由+4价变到0价,理论上外电路通过4 mol电子,A错误;B选项,阳极反应式为C+2O2--4e-===CO2↑,B正确;C选项,制备钛时,发生反应:2CaO+C2Ca+CO2↑,2Ca+TiO2Ti+2CaO,由此可知,CaO的量不变,C错误;D选项,若用铅蓄电池作该装置的供电电源,“+”接线柱应连接PbO2电极,D错误。
答案 B
12.在固态金属氧化物电解池中,高温共电解H2O、CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
A.X是电源的负极
B.阴极的电极反应式是:H2O+2e-===H2+O2-、CO2+2e-===CO+O2-
C.总反应可表示为:H2O+CO2H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1∶1
解析 由水和二氧化碳生成氢气和一氧化碳发生还原反应,此极上得到电子,应为阴极,故X极为电源的负极,A、B项正确;C项,根据电极上的反应物和生成物,可知总反应方程式正确;D项,因阳极电极反应式为2O2--4e-===O2↑,结合电子得失相等,可知阴、阳两极生成气体的物质的量之比为2∶1,错误。
答案 D
二、填空题
13.某课外活动小组的同学在学习了电化学相关知识后,用如图装置进行实验,请回答下列问题:
(1)实验一:将开关K与a连接,则乙为 极,电极反应式为 。
(2)实验一结束后,该研究小组的同学决定在乙电极表面上镶嵌下列金属中的一种以防止铁被腐蚀,正确的选择是 (填字母编号)。
A.Cu B.Zn C.Sn D.Ag
(3)实验二:开关K与b连接,则乙 极,总反应的离子方程式为 。
(4)对于实验二,下列说法正确的是 (填字母编号)。
A.溶液中Na+向甲极移动
B.从甲极处逸出的气体能使湿润的淀粉-KI试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.反应在结束后,甲电极和乙电极上收集到的气体体积一定相等
(5)该研究小组的同学在进行实验二结束的溶液中滴加酚酞溶液,发现 (填“甲”或“乙”)极附近变红。若标准状况下乙电极产生22.4 mL,转移电子的物质的量为 mol;若剩余溶液体积为200 mL,则该溶液的pH为 。
解析 (1)K与a相连构成原电池,铁作为原电池的负极,失去电子发生氧化反应:Fe-2e-===Fe2+
。(2)在Fe上镀的金属必须比铁活泼,所以选择Zn。(3)K与b相连构成电解池,乙与电源负极相连,所以作为电解池的阴极。(4)A项,电解池中阳离子向阴极移动,错误;B项,甲极Cl-放电生成Cl2,Cl2可使湿润的淀粉-KI试纸变蓝,正确;C项,两电极生成的是等量的H2和Cl2,应通入HCl,若加入盐酸会引进H2O,使溶液浓度变稀,错误;D项,阴极Cl-放电结束后,OH-放电得到O2,错误。(5)乙电极是H+放电,所以该电极处产生了大量的OH-,加入酚酞溶液变红;乙电极反应式为2H++2e-===H2↑,n(e-)=2n(H2)=2×22.4 mL÷22.4 mol·L-1=0.002 mol c(OH-)====0.01 mol·L-1,所以pH=12。
答案 (1)负 Fe-2e-===Fe2+ (2)B
(3)阴 2Cl-+2H2O2OH-+H2↑+Cl2↑
(4)B (5)乙 0.002 12
14.已知铅蓄电池的工作原理为Pb+PbO2+2H2SO42PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题:
(1)A是铅蓄电池的 极,铅蓄电池正极反应式为 ,放电过程中电解液的密度 (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是 ,
该电极的电极产物共 g。
(3)Cu电极的电极反应式是 ,
CuSO4溶液的浓度 (填“减小”、“增大”或“不变”)。
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示 。
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
解析 根据在电解过程中铁电极质量的减少可判断A是电源的负极,B是电源的正极,电解时Ag作阴极,电极反应式为2H++2e-===H2↑,Fe作阳极,电极反应式为Fe-2e-===Fe2+,左侧U形管中总反应式为Fe+2H+===Fe2++H2↑。右侧U形管相当于电镀装置,Zn电极作阴极,电极反应式为Cu2++2e-===Cu,Cu电极作阳极,电极反应式为Cu-2e-===Cu2+,电镀过程中CuSO4溶液的浓度保持不变,根据上述分析可得答案。
答案 (1)负 PbO2+4H++SO+2e-===PbSO4+2H2O 减小
(2)2H++2e-===H2↑ 0.4
(3)Cu-2e-===Cu2+ 不变 (4)b
15.如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,乙装置中X为阳离子交换膜。
根据要求回答下列相关问题:
(1)通入氧气的电极为 (填“正极”或“负极”),写出负极的电极反应: 。
(2)铁电极为 (填“阳极”或“阴极”),石墨电极的电极反应为 。
(3)反应一段时间后,乙装置中生成的氢氧化钠主要在 (填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银等杂质,则丙装置中阳极上的电极反应为
,反应一段时间,硫酸铜溶液的浓度将 (填“增大”、“减小”或“不变”)。
(5)若在标准状况下有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下的体积为 ;丙装置中阴极析出铜的质量为 。
解析 (1)燃料电池是将化学能转化为电能的装置,属于原电池,通入燃料的电极是负极,通入氧气的电极是正极,所以该燃料电池中通入氧气的电极是正极,负极上甲醚失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为CH3OCH3-12e-+16OH-===2CO+11H2O。
(2)乙池属于电解池,铁电极连接原电池的负极,所以铁电极是阴极,则石墨电极是阳极,阳极上氯离子失电子生成氯气,电极反应为2Cl--2e-===Cl2↑。(3)乙池中阴极是铁,阳极是石墨,阳极上氯离子放电生成氯气,阴极上氢离子放电,导致阴极附近氢氧根离子浓度大于氢离子浓度使溶液呈碱性,所以乙装置中生成的氢氧化钠主要在铁极区。(4)如果粗铜中含有锌、银等杂质,则阳极上铜、锌失电子进入溶液,阳极反应为Zn-2e-===Zn2+、Cu-2e-===Cu2+,根据得失电子数相等知,阳极上溶解的铜少于阴极上析出的铜,所以丙装置中反应一段时间后,硫酸铜溶液的浓度将减小。(5)根据串联电池中转移电子数相等得氧气、氢气和铜的关系式为O2~2H2~2Cu,设生成氢气的体积为x,生成铜的质量是y,则
O2 ~ 2H2 ~ 2Cu
22.4 L 44.8 L 128 g
2.24 L x y
解得x=4.48 L,y=12.8 g。
答案 (1)正极 CH3OCH3-12e-+16OH-===2CO+11H2O (2)阴极 2Cl--2e-===Cl2↑ (3)铁极 (4)Zn-2e-===Zn2+、Cu-2e-===Cu2+ 减小
(5)4.48 L 12.8 g