- 834.90 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高三化学电解池习题有答案
+反应热习题有答案+硅习题+海水中的元素习题
电解池(附参考答案)
一、选择题
1.下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反
应
B.用惰性电极电解 Na2SO4 溶液,阴、阳两极产物的物质的量
之比为 1∶2
C.用惰性电极电解饱和 NaCl 溶液,若有 1 mol 电子转移,则
生成 1 mol NaOH
D.酸、碱、盐溶液电解后 pH 都增大
【解析】 原电池的负极及电解池的阳极均发生氧化反应,A 错;
电解 Na2SO4 溶液,实际是电解水,阴极生成 H2,阳极生成 O2,二者
物 质 的 量 之 比 为 2∶1, B 错 ; 电 解 饱 和 NaCl 溶 液 : 2NaCl +
2H2O=====电解 2NaOH+H2↑+Cl2↑,每转移 1 mol 电子,则生成 1 mol
NaOH,C 对;H2SO4、NaOH、Na2SO4 溶液电解后 pH 会分别减小、
增大、不变。
【答案】 C
2 . (2012· 山 东 省 实 验 中 学 第 三 次 测 试 ) 能 够 使 反 应 Cu +
2H2O===Cu(OH)2+H2↑发生的是( )
A.铜片作负极,碳棒作正极,氯化钠作电解质溶液
B.铜锌合金在潮湿空气中发生电化学腐蚀
C.用铜片作阴、阳电极,电解硫酸铜溶液
D.用铜片作阴、阳电极,电解硫酸钠溶液
【解析】 Cu 和 H2O 不反应,该反应必须通过电解才能实现。
【答案】 D
3.(2010·海南高考稍改动)利用电解法可将含有 Fe、Zn、Ag、Pt
等杂质的粗铜提纯,下列叙述正确的是( )
A.电解时以精铜作阳极
B.电解时阴极发生氧化反应
C.粗铜连接电源负极,其电极反应是 Cu-2e-===Cu2+
D.电解后,电解槽底部会形成含少量 Ag、Pt 等金属的阳极泥
【答案】 D
4.用惰性电极进行下列电解,有关说法正确的是( )
①电解稀硫酸 ②电解 CuSO4 溶液 ③电解 KOH 溶液 ④电解
NaCl 溶液
A.电解进行一段时间后四份溶液的 pH 均增大
B.反应②中电解一段时间后,向溶液中加入适量的 CuO 固体可
使溶液恢复电解前的情况
C.反应③中阳极消耗 OH-,故溶液浓度变小
D.反应④中阴、阳两极上产物的物质的量之比为 2∶1
【解析】 依据惰性电极电解规律,可知①为电解水,pH 减小;
②为放 O2 生酸型,pH 减小,加入 CuO 可恢复电解前情况;③为电
解水,pH 增大,溶液浓度增大;④为放 H2 生碱型。阴极产生 H2,
阳极产生 Cl2,其物质的量之比为 1∶1。
【答案】 B
5.(2010·福建高考)铅蓄电池的工作原理为:Pb+PbO2 +
2H2SO4===2PbSO4+2H2O,研读下图,下列判断不正确的是( )
A.K 闭合时,d 电极反应式:PbSO4+2H2O-2e-===PbO2+4H
++SO2-
4
B.当电路中转移 0.2 mol 电子时,Ⅰ中消耗的 H2SO4 为 0.2 mol
C.K 闭合时,Ⅱ中 SO 2-
4 向 c 电极迁移
D.K 闭合一段时间后,Ⅱ可单独作为原电池,d 电极为正极
【解析】 C 项,当 K 闭合时Ⅰ为原电池、Ⅱ为电解池,Ⅱ中 c
电极上的 PbSO4 转化为 Pb 和 SO2-
4 ,d 电极上的 PbSO4 转化为 PbO2
和 SO2-
4 ,阴离子移向阳极,即 d 电极。
【答案】 C
6.(2012·淄博质检)下列描述中,不符合生产实际的是( )
A.电解法精炼粗铜,用纯铜作阴极
B.在镀件上电镀锌,用锌作阳极
C.用如图 1 装置生产家用消毒液(NaClO)
D.用如图 2 装置为铅蓄电池充电
【解析】 用石墨作电极电解饱和NaCl 溶液发生的反应是2NaCl
+2H2O=====电解 2NaOH+Cl2↑+H2↑,伴随电解过程所发生的副反应
是 2NaOH+Cl2===NaCl+NaClO+H2O,从而制得有较强杀菌能力的
NaClO、NaCl 混合溶液,故 C 项正确;蓄电池中 PbO2 为正极,Pb
为负极,给蓄电池充电时,应遵循“正接正,负接负”的原则连接,
D 项错误。
【答案】 D
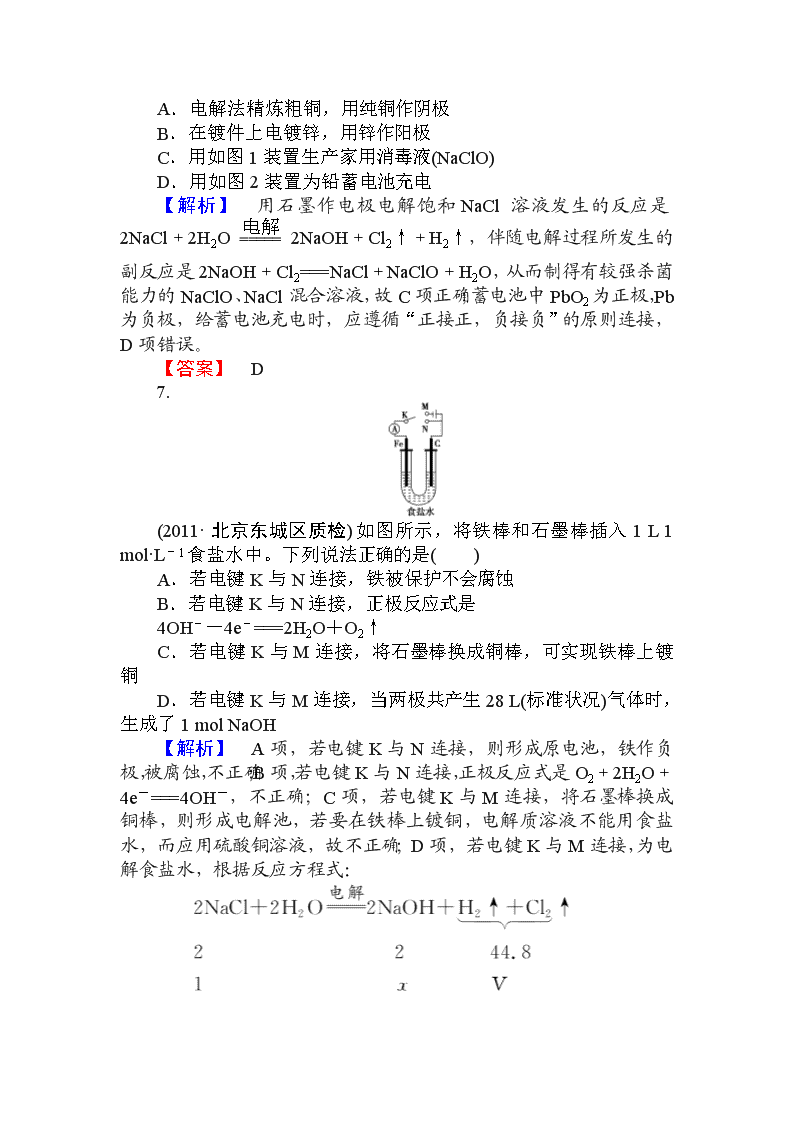
7.
(2011·北京东城区质检)如图所示,将铁棒和石墨棒插入 1 L 1
mol·L-1 食盐水中。下列说法正确的是( )
A.若电键 K 与 N 连接,铁被保护不会腐蚀
B.若电键 K 与 N 连接,正极反应式是
4OH--4e-===2H2O+O2↑
C.若电键 K 与 M 连接,将石墨棒换成铜棒,可实现铁棒上镀
铜
D.若电键 K 与 M 连接,当两极共产生 28 L(标准状况)气体时,
生成了 1 mol NaOH
【解析】 A 项,若电键 K 与 N 连接,则形成原电池,铁作负
极,被腐蚀,不正确;B 项,若电键 K 与 N 连接,正极反应式是 O2
+2H2O+4e-===4OH-,不正确;C 项,若电键 K 与 M 连接,将石
墨棒换成铜棒,则形成电解池,若要在铁棒上镀铜,电解质溶液不能
用食盐水,而应用硫酸铜溶液,故不正确;D 项,若电键 K 与 M 连
接,为电解食盐水,根据反应方程式:
解得 x=1,V=22.4 L,即 1 mol 氯化钠全部被电解完,产生 1 mol
氢氧化钠,而现在产生气体为 28 L,表明电解完氯化钠后继续电解水,
但生成氢氧化钠的量不变,即生成了 1 mol NaOH。
【答案】 D
8.下列离子方程式书写正确的是( )
A.用 Cu 片作阳极电解饱和食盐水
2Cl-+2H2O=====电解 Cl2↑+H2↑+2OH-
B.用两个铜片作电极电解 AgNO3 溶液:
Cu+2Ag+=====电解 2Ag+Cu2+
C.用石墨作电极电解 AlCl3 溶液:
2Cl-+2H2O=====电解 Cl2↑+H2↑+2OH-
D.用石墨作电极电解 CuCl2 溶液
2Cu2++2H2O=====电解 2Cu+O2↑+4H+
【解析】 A 项,用 Cu 作阳极电解饱和食盐水,Cu 电极本身失
电子 Cu-2e-===Cu2+。阴极 2H2O+2e-===H2↑+2OH-
二者相加得 Cu+2H2O=====电解 Cu(OH)2+H2↑,无离子方程式;
C 项,阴极 6H2O+6e-===3H2↑+6OH-
阳极 6Cl--6e-===3Cl2↑
6Cl-+6H2O===3Cl2↑+3H2↑+6OH-
6Cl-对应 2Al3+
2Al3++6OH-===2Al(OH)3↓
所以离子方程式为
2Al3++6Cl-+6H2O 电解,3Cl2↑+3H2↑+2Al(OH)3↓
D 项,阴极 Cu2++2e-===Cu
阳极 2Cl--2e-===Cl2↑
离子方程式为
Cu2++2Cl-电解,Cu+Cl2↑。
【答案】 B
9.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程
如下:用 NaOH 调 NiCl2 溶液 pH 至 7.5,加入适量硫酸钠后进行电解。
电解过程中产生的 Cl2 在弱碱性条件下生成 ClO-,把二价镍氧化为三
价镍。以下说法正确的是( )
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的 pH 升高
C.阳极反应式为:2Cl--2e-===Cl2↑
D.1 mol 二价镍全部转化为三价镍时,外电路中通过了 2 mol
电子
【解析】 因为电解后需要生成 Cl2,因此不可用铁作阳极材料,
A 错;电解过程中阳极发生反应:2Cl--2e-===Cl2,Cl2 溶于水显酸
性,阳极附近溶液的 pH 降低,B 错;因为 ClO-氧化 Ni2+发生的反应
为:2Ni2++ClO-+H2O===2Ni3++Cl-+2OH-;因此 1 mol Ni2+全部
转化为 Ni3+时,外电路通过了 1 mol 电子,D 错。
【答案】 C
二、非选择题
10.
用惰性电极电解 NaCl 与 NaHCO3 的混合溶液,测得溶液的 pH
变化如图所示。
(1)在 0→t1 时间内,两个电极上的电极反应式为:
阳极
____________________________________________;
阴极
_______________________________________________。
(2)用离子方程式表示 0→t1 时间内,溶液 pH 升高比较缓慢的原
因:
_________________________________________________。
【解析】 由于 HCO-
3 、Na+均不易放电,故阳极反应式为:2Cl
--2e-===Cl2↑;阴极反应式为:2H++2e-===H2↑。随着反应的进
行[OH-]增大,HCO-
3 +OH-===CO2-
3 +H2O,故而开始 pH 变化缓慢,
当 HCO -
3 完全反应后,pH 增幅加大。
【答案】 (1)2Cl--2e-===Cl2↑ 2H++2e-===H2↑
(2)HCO-
3 +OH-===CO2-
3 +H2O
11.
(2012·单县质检)太阳能电池可用做电解的电源(如图)。
(1)若 c、d 均为惰性电极,电解质溶液为硫酸铜溶液,电解过程
中,c 极先无气体产生,后又生成气体,则 c 极为________极,在电
解过程中,溶液的 pH________(填“增大”、“减小”或“不变”),
停 止 电 解 后 , 为 使 溶 液 恢 复 至 原 溶 液 应 加 入 适 量 的
___________________________________________________________
_____________。
(2)若 c、d 均为铜电极,电解质溶液为氯化钠溶液,则电解时,
溶液中氯离子的物质的量将________(填“增大”、“减小”或“不
变”)。
(3)若用石墨、铁作电极材料,可组装成一个简易污水处理装置。
其原理是:加入试剂调节污水的 pH 在 5.0~6.0 之间。接通电源后,
阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作
用;阳极产生的有色沉淀具有吸附性,吸附污物而沉积,起到凝聚净
化 作 用 。 该 装 置 中 , 阴 极 的 电 极 反 应 式 为
___________________________________________________________
_____________;
阳极区生成的有色沉淀是____________。
【解析】 (1)用惰性电极电解硫酸铜溶液,c 极上先无气体生成,
后又产生气体,说明 c 极为阴极(先生成 Cu,后生成 H2),电解 CuSO4
溶液最终生成 H2SO4,溶液的 pH 减小。电解过程分两个阶段:第一
阶段,阴极生成 Cu,阳极生成 O2,溶液中减少的相当于 CuO;第二
阶段,阴极生成 H2,阳极生成 O2,溶液中减少的是 H2O。
(2)若 c、d 为铜电极时,阳极:Cu-2e-===Cu2+,电解质溶液中
Cl-不放电,故其物质的量不变。
(3)若用石墨、铁作电极材料,阴极产生气体,阴极发生的反应只
能是 2H++2e-===H2↑,阳极生成有色沉淀,则阳极为铁放电,Fe
-2e-===Fe2+,该有色沉淀是 Fe(OH)3。
【答案】 (1)阴 减小 CuO 和 H2O (2)不变
(3)2H++2e-===H2↑ Fe(OH)3
12.如图是一个用铂丝作电极,电解稀的 MgSO4 溶液的装置,
电解液中加有中性红色指示剂,此时溶液呈红色。(指示剂的 pH 变色
范围:6.8-8.0,酸色-红色,碱色-黄色)回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是
________(填编号);
①A 管溶液由红变黄 ②B 管溶液由红变黄 ③A 管溶液不变色
④B 管溶液不变色
(2)写出 A 管中发生反应的反应式:
_______________________________________________________
________________________________________________________;
(3)写出 B 管中发生反应的反应式:
_______________________________________________________
_______________________________________________________;
(4)检验 a 管中气体的方法是
_____________________________________________________;
(5)检验 b 管中气体的方法是
_____________________________________________________;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现
象是
_____________________________________________。
【解析】 A 为阴极,电极反应式为 2H++2e-===H2↑,a 管收
集的是 H2,B 为阳极,电极反应式为 4OH--4e-===2H2O+O2↑,b
管中收集的是 O2,因 H+放电,A 中溶液中的 Mg2+与 OH-结合,生
成 Mg(OH)2 白色沉淀。
【答案】 (1)①④
(2)2H++2e-===H2↑(写 2H2O+2e-===2OH-+H2↑同样也可),
Mg2++2OH-===Mg(OH)2↓
(3)4OH--4e-===2H2O+O2↑(写 2H2O-4e-===4H++O2↑同样
也可)
(4)用拇指按住管口,取出试管,靠近火焰,放开拇指,有爆鸣声,
管口有蓝色火焰
(5)用拇指按住管口,取出试管,放开拇指,将带有火星的木条伸
入试管内会复燃
(6)溶液呈红色,白色沉淀溶解(或大部分溶解)
13.(2010·山东高考)对金属制品进行抗腐蚀处理,可延长其使用
寿命。
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒
出,原因是
_______________________________________________________
(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最
好向槽液中加入下列试剂中的________。
a.NH3 b.CO2
c.NaOH d.HNO3
②以铝材为阳极,在 H2SO4 溶液中电解,铝材表面形成氧化膜,
阳极电极反应式为
_______________________________________________________
_________________。
取少量废电解液,加入 NaHCO3 溶液后产生气泡和白色沉淀,产
生沉淀的原因是
_______________________________________________________
_________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原
因是
_______________________________________________________
_________________。
(3)利用如图装置,可以模拟铁的电化学防护。若 X 为碳棒,为
减缓铁的腐蚀,开关 K 应置于________处。
【答案】 (1)①2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑(或:
2Al+2OH-+2H2O===2AlO-
2 +3H2↑) b
②2Al+3H2O-6e-===Al2O3+6H+
HCO -
3 与 H+反应使 H+的浓度减小,产生 Al(OH)3 沉淀
(2)补充溶液中消耗的 Cu2+,保持溶液中 Cu2+浓度恒定
(3)N
电解质(附参考答案)
一、选择题
1.(2012·日照模拟)在下列溶液中一定能大量共存的离子组是
( )
A.pH=2 的溶液:Fe2+、NH+
4 、Cl-、NO-
3
B.能使 pH 试纸变深蓝色的溶液:Na+、[Al(OH)4]-、S2-、CO2-
3
C.含有大量 Fe3+的溶液:SCN-、I-、K+、Br-
D.澄清透明的无色溶液:ClO-、MnO-
4 、Al3+、SO2-
4
【解析】 A 项 pH=2 时,Fe2+被氧化;C 项 Fe3+与 SCN-不能
共存;D 项 MnO -
4 呈紫红色;B 项正确。
【答案】 B
2.下列电解质在水溶液中电离方程式错误的是( )
A.NaHCO3===Na++H++CO2-
3
B.NaHSO4===Na++H++SO2-
4
C.MgCl2===Mg2++2Cl-
D.Ba(OH)2===Ba2++2OH-
【答案】 A
3.下列说法正确的是( )
A.液态 HCl、固态 NaCl 均不导电,所以 HCl、NaCl 是非电解
质
B.NH3、CO2、Cl2 的水溶液均能导电,所以 NH3、CO2、Cl2 均
是电解质
C.蔗糖、酒精在熔融状态和水溶液里均不导电,所以它们是非
电解质
D.铜、石墨均导电,所以它们是电解质
【解析】 HCl、NaCl 溶于水后可以导电,因此二者均为电解质;
NH3、CO2 溶于水后因分别生成了 NH3·H2O、H2CO3 而导电,但溶液
中离子并不是 NH3、CO2 自身电离产生的,因此 NH3、CO2 属于非电
解质;Cl2、铜、石墨为单质,既不是电解质,也不是非电解质。
【答案】 C
4.(2010·全国高考Ⅱ)在溶液中进行的下列反应中,可用离子方
程式 H++OH-===H2O 表示的是( )
A.NH4Cl+NaOH=====△ NaCl+NH3↑+H2O
B.Mg(OH)2+2HCl ===MgCl2+2H2O
C.NaOH+NaHCO3===Na2CO3+H2O
D.NaOH+HNO3===NaNO3+H2O
【解析】 H++OH-===H2O 表示强酸和强碱反应生成可溶性盐
和水的反应,D 项符合题意。
【答案】 D
5.下列离子方程式中,只能表示一个化学反应的是( )
A.只有③ B.②③
C.③⑤ D.①④
【解析】 离子方程式可表示一类反应,如①可表示金属铁与可
溶性铜盐反应,②可表示硫酸或硫酸氢盐与氢氧化钡反应,④可表示
可溶性碳酸盐与强酸反应,⑤可表示可溶性银盐和盐酸盐或盐酸反
应。
【答案】 A
6.在溶液中加入足量 Na2O2 后仍能大量共存的离子组是( )
A.NH+
4 、Ba2+、Cl-、NO-
3
B.K+、[Al(OH)4]-、Cl-、SO2-
4
C.Ca2+、Mg2+、NO-
3 、HCO-
3
D.Na+、Cl-、CO2-
3 、SO2-
3
【解析】 在溶液中加入 Na2O2 固体,Na2O2 首先和水反应生成
NaOH 和 O2,A 中,NH +
4 和 OH-因发生反应生成 NH3·H2O 而不能大
量共存;C 中 Ca2+、Mg2+、HCO -
3 和 OH-都不能大量共存;D 中 SO2-
3
具有还原性,和 Na2O2、O2 都会发生氧化还原反应。
【答案】 B
7.(2012·无棣质检)下列离子组一定能大量共存的是( )
A.甲基橙呈黄色的溶液中:I-、Cl-、NO-
3 、Na+
B.石蕊呈蓝色的溶液中:Na+、[Al(OH)4]-、NO-
3 、HCO-
3
C.含大量 Al3+的溶液中:K+、Na+、NO-
3 、ClO-
D.含大量 OH-的溶液中:CO2-
3 、Cl-、F-、K+
【解析】 使甲基橙呈黄色的溶液 pH 大于 4.4,当其处于 4.4~
7 之间时,NO -
3 表现强氧化性,将 I-氧化为 I2,排除 A;石蕊呈蓝色
的溶液 pH 大于 8,溶液呈碱性,OH-能和 HCO -
3 反应,排除 B;含
大量 Al3+的溶液中,Al3+与 ClO-会发生水解相互促进反应,排除 C。
【答案】 D
8.(2012·山东省实验中学质检)下列对应的离子方程式正确的是
( )
A.Fe2(SO4)3 的酸性溶液中通入足量硫化氢:Fe3++H2S===Fe2+
+S↓+2H +
B.碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO-
3 +OH
-===CaCO3↓+H2O
C.氯化铝溶液中加入过量氨水:Al3++3OH-===Al(OH)3↓
D.澄清石灰水中通入过量 CO2:OH-+CO2===HCO-
3
【解析】 A 中电荷不守恒,A 错误;过量的 OH-能将 HCO -
3 完
全转化为 CO2-
3 ,其正确的离子方程式为:Ca2++2HCO-
3 +2OH-
===CaCO3↓+CO2-
3 +2H2O,B 错误;NH3·H2O 为弱电解质,不能拆
为离子形式,C 错误。
【答案】 D
9.(2012·厦门测试)在下列溶液中,能大量共存的离子组是( )
A.能使 pH 试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br-
B.常温下 cH+
cOH-
=1012 的溶液中:Fe2+、Mg2+、NO-
3 、Cl-
C.含有大量 Fe3+的溶液中:SCN-、I-、K+、Br-
D.能使石蕊试液显红色的溶液中:K+、SO2-
4 、S2-、CO2-
3
【解析】 使 pH 试纸显蓝色的溶液呈碱性,A 项正确;结合水
的离子积常数可求出溶液的 pH=1,此种情况下,NO -
3 能氧化 Fe2+,
B 项错误;Fe3+与 SCN-不能大量共存,C 项错误;能使石蕊试液显
红色的溶液呈酸性,CO2-
3 、S2-不能大量存在,D 项错误。
【答案】 A
10.下列是某同学对相应反应的离子方程式所作的评价,其中评
价合理的是( )
编号 化学反应 离子方程式 评价
A
碳酸钙与醋酸
反应
CO2-
3 +
2CH3COOH===2CH3
COO-+H2O+
CO2↑
错误,碳酸钙
是弱电解质,
不拆写
B
氢氧化钠溶液
中通入过量
CO2
OH-+CO2===
HCO-
3
错误,CO2 过
量应生成
CO2-
3
C
碳酸氢钠的水
解
HCO-
3 +H2O H3O+
+CO2-
3
正确
D
等物质的量的
FeBr2 和 Cl2 反
应
2Fe2++2Br-+
2Cl2===2Fe3++Br2
+4Cl-
正确
【解析】 CaCO3 是不溶于水的强电解质,在离子方程式中不能
拆为离子,A 项不符合题意;B 项评价错误;C 项是 HCO -
3 的电离方
程式。
【答案】 D
二、非选择题
11.(2012·微山一中第二次质检)现有 A、B、C、D、E 五种强电
解质,它们在水中可电离产生下列离子(各种离子不重复)。
阳离
子
H+、Na+、Al3+、Ag+、Ba2
+
阴离
子 OH-、Cl-、CO2-
3 、NO-
3 、SO2-
4
已知:①A、B 两溶液呈碱性;C、D、E 溶液呈酸性。
②A 溶液与 E 溶液反应既有气体又有沉淀产生;A 溶液与 C 溶
液反应只有气体产生(沉淀包括微溶物,下同)。
③D 溶液与另外四种溶液反应都能产生沉淀;
C 只能与 D 反应产生沉淀。
试回答下列问题:
(1)写出化学式:A________;B________;D________。
(2)E 溶液呈酸性的原因是:(用离子方程式表示)
_______________________________________________________
_________________。
(3)将 C 溶液逐滴加入等体积、等物质的量浓度的 A 溶液中,反
应 后 溶 液 中 各 种 离 子 浓 度 由 大 到 小 的 顺 序 为 :
___________________________________________________________
___________________________________________________________
__________________________。
(4)在 100 mL 0.1 mol·L-1 E 溶液中,逐滴加入 35 mL 2 mol·L-1
NaOH 溶液,最终得到沉淀物质的量为________mol。
【答案】 (1)Na2CO3 Ba(OH)2 AgNO3
(2)Al3++3H2O Al(OH)3+3H+
(3)c(Na+)>c(Cl-)>c(HCO-
3 )>c(OH-)>c(H+)>c(CO2-
3 )
(4)0.01 mol
12.某厂的酸性工业废水中含有一定量的 Na+、Al3+、Fe3+、Cu2
+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、
酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、
NaCl 晶体和金属铜,产生了很好的社会经济效益。
请填写下列空白:
(1)图中试剂 1 是________,试剂 2 是________。
(2) 步 骤 1 和 步 骤 2 所 用 到 的 玻 璃 仪 器 是
___________________________________________________________
_____________。
(3) 步 骤 1 反 应 的 离 子 方 程 式 为
___________________________________________________________
___________________________________________________________
__________________________。
(4) 步 骤 3 反 应 的 离 子 方 程 式 为
___________________________________________________________
___________________________________________________________
__________________________。
(5)从节约药品和环保方面考虑,步骤 5 所发生反应的离子方程式
应为
_______________________________________________________
_________________。
【解析】 所加试剂的关键是有效地将 Na+、Al3+、Fe3+、Cu2+、
Cl-分离并得到相应产品。若试剂 1 为足量的废铁屑,Fe 与 Cu2+、Fe3
+反应经过滤后得到含有 Fe、Cu 的沉淀 A,向 Fe、Cu 混合物中加入
足量的稀盐酸得到 Cu 和 FeCl2,FeCl2 再与 H2O2 反应得到 FeCl3:2Fe2
++H2O2+2H+===2Fe3++2H2O。溶液 A 中含有 Na+、Al3+、Fe2+、
Cl-,利用 Al(OH)3 的两性实现 Fe2+、Al3+的分离,所以试剂 3 为过
量的 NaOH 溶液,沉淀 C 为 Fe(OH)2,其与盐酸反应生成 FeCl2,再
经步骤 3 可得 FeCl3,溶液 C 为 NaCl、NaOH、Na[Al(OH)4]的混合液,
向该溶液中通入过量的廉价 CO2,可将[Al(OH)4]-转化为 Al(OH)3 沉
淀,将得到的 Al(OH)3 沉淀加热即得到 Al2O3,所得溶液 D 中含有
NaCl、NaHCO3,再用盐酸调节其 pH 得到 NaCl 溶液,NaCl 溶液经
蒸发、结晶得到 NaCl 晶体。
【答案】 (1)废铁屑 稀盐酸
(2)漏斗、玻璃棒、烧杯
(3)Fe+Cu2+===Cu+Fe2+,Fe+2Fe3+===3Fe2+
(4)2Fe2++H2O2+2H+===2Fe3++2H2O
(5)[Al(OH)4]-+CO2===Al(OH)3↓+HCO-
3
13.(2012·成武质检)某无色溶液,由 Na+、Ag+、Ba2+、Al3+、
[Al(OH)4]-、MnO-
4 、CO2-
3 、SO 2-
4 中的若干种组成,取该溶液进行如
下实验:
①取适量试液,加入过量盐酸,有气体生成,并得到溶液;
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时
析出白色沉淀甲;
③在②所得溶液中加入过量 Ba(OH)2 溶液,也有气体生成,并有
白色沉淀乙析出。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是
_______________________________________________________
___________________________________________________________
______________________________。
(2)一定存在的离子是
_______________________________________________________
_________________。
(3)判断沉淀乙成分的方法是
_______________________________________________________
___________________________________________________________
______________________________。
【解析】 因无色溶液排除 MnO -
4 的存在,由①知溶液中一定含
有 CO2-
3 ,同时排除 Ag+、Ba2+、Al 3+的存在;由②知溶液必须含有
[Al(OH)4]-才能产生沉淀甲,且甲为 Al(OH)3;由③知,加入过量
Ba(OH)2 溶液后,OH-与②溶液中过量的 NH +
4 反应生成 NH3,与 HCO-
3
反应生成 CO2-
3 ,同时溶液呈碱性,CO 2-
3 与 Ba2+生成 BaCO3 沉淀,
沉淀乙中一定含有 BaCO3,但也有可能含有 BaSO4。
【答案】 (1)Ag+、Ba2+、Al3+、MnO-
4
(2)Na+、[Al(OH)4]-、CO2-
3
(3)加入盐酸,观察沉淀是否全部溶解,若全部溶解,说明只有
BaCO3,否则还含有 BaSO4
14.有一混合物水溶液,可能含有以下离子中的若干种:K+、
NH+
4 、Cl-、Mg2+、Fe3+、CO2-
3 、SO2-
4 ,现各取 100 mL 溶液三份进
行实验。
(1)向第一份加入 AgNO3 溶液,有白色沉淀产生;
(2)向第二份加入足量 NaOH 溶液后加热,收集气体 0.896 L(标
准状况);
(3)向第三份加入足量的 BaCl2 溶液,得到沉淀 6.27 g,沉淀经足
量盐酸洗涤后,剩余 2.33 g。
试回答下列问题:
(1)肯定存在的离子有____________________,肯定不存在的离
子有________。
(2)可能存在的离子是________,为确定该离子是否存在,可取少
许原试液,然后
_______________________________________________________
___________________________________________________________
______________________________(填实验操作)。
(3)试分别确定肯定存在的离子在原溶液中各自的物质的量浓
度。
【解析】 由(1)知溶液中可能含 Cl-、CO2-
3 、SO2-
4 ,由(2)知溶
液中一定含 NH+
4 ,且 n(NH+
4 )=0.04 mol,由(3)知溶液中一定含 CO2-
3 、
SO2-
4 ,则一定不含 Mg2+、Fe3+(二者与 CO 2-
3 不能大量共存),且 n(SO2-
4 )
= 2.33 g
233 g·mol-1
=0.01 mol,n(CO2-
3 )=6.27-2.33 g
197 g·mol-1
=0.02 mol, 所以溶
液中 NH +
4 浓度为 0.4 mol·L-1,SO 2-
4 浓度为 0.1 mol·L-1,CO 2-
3 浓度
为 0.2 mol·L-1,由电荷守恒知溶液中一定含 K+,可能含 Cl-,据 c(K
+)+c(NH+
4 )=2c(CO2-
3 )+2c(SO2-
4 )+c(Cl-),c(K+)+0.4 mol·L-1=
2×0.2 mol·L-1+2×0.1 mol·L-1+c(Cl-),c(K+)=0.2 mol·L-1+c(Cl
-)≥0.2 mol·L-1。
【答案】 (1)NH+
4 、CO2-
3 、SO2-
4 、K+ Mg2+、Fe3+
(2)Cl- 加入足量的稀硝酸和硝酸钡溶液,过滤,向滤液中滴入
AgNO3 溶液,有白色沉淀证明有 Cl-存在
(3)c(NH+
4 )=0.4 mol·L-1 c(CO2-
3 )=0.2 mol·L-1
c(SO2-
4 )=0.1 mol·L-1 c(K+)≥0.2 mol·L-1
反应热(附参考答案)
一、选择题
1.
右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎
块混合,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
( )
A.硝酸铵 B.生石灰
C.氯化镁 D.食盐
【解析】 水袋破裂时,水与固体混合时杯内温度逐渐上升,说
明该固体遇水会放出热量。
【答案】 B
2.(2010·重庆高考)已知 H2(g)+Br2(l)===2HBr(g);ΔH=-72
kJ·mol-1,蒸发 1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如
下表:
H2(g) Br2(g) HBr(g)
1 mol 分子中的化学键断
裂时需要吸收的能量/kJ 436 a 369
则表中 a 为( )
A.404 B.260 C.230 D.200
【解析】 本题考查了化学键与化学反应中能量变化的关系,同
时兼顾了盖斯定律的应用。由题意知:
H2(g)+Br2(l)===2HBr(g);ΔH=-72 kJ·mol-1①
Br2(l)===Br2(g);ΔH=+30 kJ·mol-1 ②
由盖斯定律知:①-②可得 H2(g)+Br2(g)===2HBr(g);
ΔH=-102 kJ·mol-1,
故-102 kJ·mol-1=436 kJ·mol-1+a kJ·mol-1-2×369 kJ·mol-1
所以 a=200。
【答案】 D
3.N2H4 是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧
生成氮气和气态水时,放出 133.5 kJ 热量。则下列热化学方程式中正
确的是( )
A.1
2N2H4(g)+1
2O2(g)===1
2N2(g)+H2O(g)
ΔH=267 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(l)
ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=534 kJ·mol-1
D.N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=-534 kJ·mol-1
【解析】 热化学方程式中ΔH>0 表示吸热,ΔH<0 表示放热,
选项 A、C 中ΔH 的符号错误。热化学方程式中化学式前面的化学计
量数仅表示物质的量,0.25 mol N2H4(g)燃烧放热 133.5 kJ,故 1 mol
N2H4(g)燃烧放热 4×133.5 kJ,选项 D 正确,B 错误。
【答案】 D
4.(2010·广东高考)在 298 K、100 kPa 时,已知:
2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3 与ΔH1 和ΔH2 间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
【解析】 令 2H2O(g)===O2(g)+2H2(g) ΔH1①
Cl2(g)+H2(g)===2HCl(g) ΔH2②
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3③
根据盖斯定律,将反应①+反应②×2 即可求得反应③,因此有
ΔH3=ΔH1+2ΔH2,故 A 项正确。
【答案】 A
5 . (2012· 夏 津 质 检 ) 已 知 反 应 : ①101 kPa 时 , 2C(s) +
O2(g)===2CO(g) ΔH=-221 kJ·mol-1。
②稀溶液中,H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ·mol-1。
下列结论正确的是( )
A.1 mol 碳完全燃烧放出的热量大于 110.5 kJ
B.①的反应热为 221 kJ·mol-1
C.稀硫酸与稀 NaOH 溶液反应生成 1 mol 水时放出热量为-57.3
kJ·mol-1
D. 稀醋酸与稀 NaOH 溶液反应生成 1 mol 水,放出 57.3 kJ 热量
【解析】 1 mol 碳燃烧转化为 CO 放出热量为 110.5 kJ,则 1 mol
碳燃烧转化为二氧化碳放出的热量将大于此数值,故 A 正确。①的
反应热应为-221 kJ·mol-1。C 项放出的热量应为正值,且单位为 kJ,
C 说法错误。由于醋酸是弱酸,放出的热量小于 57.3 kJ,故 D 说法
错误。
【答案】 A
6.已知(1)H2(g)+1
2O2(g)===H2O(g) ΔH1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ·mol-1
(3)H2(g)+1
2O2(g)===H2O(l) ΔH3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ·mol-1
下列关系式正确的是( )
A.ad>0
C.2a=b<0 D.2c=d>0
【解析】 H2 在 O2 中燃烧为放热反应,a、b、c、d 都小于 0,
所以 B、D 均不正确;(1)式-(3)式得 H2O(l)===H2O(g) ΔH=ΔH1-
ΔH3=(a-c)kJ·mol-1,而ΔH>0,即 a-c>0,a>c,A 项不正确,比较
(1)(2)两个热化学方程式得 b=2a。
【答案】 C
7.已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)
ΔH1=-870.3 kJ·mol-1
(2)C(s)+O2(g)===CO2(g)
ΔH2=-393.5 kJ·mol-1
(3)H2(g)+1
2O2(g)===H2O(l)
ΔH3=-285.8 kJ·mol-1。
则反应 2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变ΔH 为( )
A.488.3 kJ·mol-1 B.-244.15 kJ·mol-1
C.244.15 kJ·mol-1 D.-488.3 kJ·mol-1
【解析】 根据盖斯定律:(2)×2+(3)×2-(1)得:2C(s)+2H2(g)
+O2(g)===CH3COOH(l),ΔH=ΔH2×2+ΔH3×2-ΔH1 =-393.5
kJ·mol-1×2+(-285.8 kJ·mol- 1)×2-(-870.3 kJ·mol-1)=-488.3
kJ·mol-1。
【答案】 D
8.(2010·新课标全国高考)已知:HCN(aq)与 NaOH(aq)反应的ΔH
=-12.1 kJ·mol-1;HCl(aq)与 NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。
则 HCN 在水溶液中电离的ΔH 等于( )
A.-67.7 kJ·mol-1 B.-43.5 kJ·mol-1
C.+43.5 kJ·mol-1 D.+67.7 kJ·mol-1
【解析】 题述反应的离子方程式依次为:HCN(aq)+OH -
(aq)===CN-(aq)+H2O(l) ΔH=-12.1 kJ·mol-1 ①,H+(aq)+OH-
(aq)===H2O(l) ΔH=-55.6 kJ·mol-1 ②,①-②得:HCN(aq)===H
+(aq)+CN-(aq) ΔH=+43.5 kJ·mol-1。
【答案】 C
9.白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下
列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、
P===O c kJ·mol-1、O===O d kJ·mol-1。
根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的
是( )
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
【解析】 1 mol P4 中有 6 mol P—P 键,1 mol P4O10 中有 4 mol
P===O 键,12 mol P—O 键,1 mol O2 中有 1 mol O===O 键,因此 P4
+5O2===P4O10 的焓变为ΔH=(6a+5d-4c-12b) kJ·mol-1。
【答案】 A
二、非选择题
10.下表中的数据是破坏 1 mol 物质的化学键所消耗的能量:
物质 Cl2 Br2 I2 HCl HBr HI H2
能量(kJ) 243 193 151 432 366 298 436
根据上述数据回答(1)~(6)题。
(1)下列物质本身具有的能量最低的是( )
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是( )
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X 代表 Cl、Br、I)的反应是________(填“吸
热”或“放热”)反应。
(4)相同条件下,X2(X 代表 Cl、Br、I)分别与氢气反应,消耗等
物质的量的氢气时,放出或吸收热量最多的是________。
(5)若无上表中的数据,你能正确回答出问题(4)吗?
答:________。你的根据是
_______________________________________________________
___________________________________________________________
______________________________。
(6)写出 H2 和 Cl2 反应的热化学方程式:
_______________________________________________________
___________________________________________________________
______________________________。
【解析】 本题考查物质自身所含的能量与稳定性的关系及热化
学方程式的书写等知识。
(1)物质本身具有的能量越低,物质越稳定,断键时需要的能量越
高,答案应选 A。
(2)断裂 1 mol H—Cl 键消耗的能量最多,因此 HCl 最稳定。
(3)代入数据计算可知 X2 与 H2 的化合反应是放热反应。
(4)无上表中的数据,可以根据同主族元素性质的递变规律判断。
【答案】 (1)A (2)A (3)放热 (4)Cl2
(5)能 同主族元素性质的递变规律
(6)H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
11 . (1)① 根 据 下 列 图 示 , 写 出 反 应 的 热 化 学 方 程 式
___________________________________________________________
___________________________________________________________
__________________________。
②根据如图所示情况,判断下列说法中正确的是( )
A.其热化学方程式为:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH
=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.当 H2O 为液态时,其反应热值小于 41 kJ·mol-1
(2)已知 16 g 固体硫完全燃烧时放出 148.4 kJ 的热量,该反应的
热 化 学 方 程 式 是
___________________________________________________________
___________________________________________________________
__________________________。
(3)如图是某温度下,N2 与 H2 反应过程中能量变化的曲线图。该
反 应 的 热 化 学 方 程 式 为 :
___________________________________________________________
___________________________________________________________
__________________________。
a、 b 两条曲线产生区别的原因很可能是
_______________________________________________________
_________________。
【解析】 (1)②以图示形式将反应 CO2(g)+H2(g)===CO(g)+
H2O(g)的质变与能变呈现出来,并要求判断反应类型及ΔH 情况。根
据所给图示可知,A 选项将反应的反应物与生成物弄反了,故不对;
生成物的能量比反应物的能量高,故该反应为吸热反应,B 选项正确,
则 C 选项错误;D 选项未限定 H2O 的物质的量,故不对。答案为 B。
(3)b 反应中使用催化剂,可以降低反应的活化能,但反应的热效
应不会改变。
【答案】 (1)①CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41
kJ·mol-1 ②B
(2)S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1
(3)N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1
a 不使用催化剂,b 使用了催化剂
12.(2012·德州质检)21 世纪是钛的世纪。下面是利用钛白粉(TiO2)
生产海绵钛(Ti)的一种工艺流程。
已知:①Mg(s)+Cl2(g)===MgCl2(s) ΔH=-641 kJ·mol-1
②Cl2(g)+1/2Ti(s)===1/2TiCl4(l) ΔH=-385 kJ·mol-1
(1)钛白粉是利用 TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧
沉淀制得的。TiO2+发生水解的离子方程式为
_______________________________________________________
_________________。
(2)反应Ⅰ在 800 ℃~900 ℃下进行,还生成一种可燃性无色气
体,该反应的化学方程式为
_______________________________________________________
___________________________________________________________
______________________________;
反应Ⅱ的热化学方程式为
_______________________________________________________
___________________________________________________________
______________________________。
(3)该工艺流程中,可以循环利用的物质是
_______________________________________________________
_________________。
【解析】 (1)TiO2+的水解反应是 TiO2+结合 H2O 电离出的 OH-,
生成 H2TiO3。
(2)反应Ⅰ的反应物是 TiO2、C 和 Cl2,产物为 TiCl4 和 CO;反应
Ⅱ的化学方程式为 2Mg+TiCl4===2MgCl2+Ti,该反应的热化学方程
式可通过①式-②式求得。
(3)生产流程中的 Mg 和 Cl2 可循环利用。
【答案】 (1)TiO2++2H2O===H2TiO3↓+2H+
(2)TiO2+2Cl2+2C=====高温 TiCl4+2CO
Mg(s)+1
2TiCl4(l)===MgCl2(s)+1
2Ti(s)
ΔH=-256 kJ·mol-1
(3)Cl2 和 Mg
13.(2012·烟台模拟)将煤转化为水煤气的主要化学反应为 C(s)
+H2O(g)=====高温 CO(g)+H2(g);C(s)、CO(g)和 H2(g)完全燃烧的热化学
方程式为:
C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+1
2O2(g)===H2O(g) ΔH2=-242.0 kJ·mol-1
CO(g)+1
2O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出 C(s)与水蒸气反应的热化学反应方程式:
___________________________________________________________
_____________。
(2)比较反应热数据可知,1 mol CO(g)和 1 mol H2(g)完全燃烧放
出的热量之和比 1 mol C(s)完全燃烧放出的热量多。甲同学据此认为
“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯
定律做出下列循环图
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧
放出的热量相等”。
请分析:甲、乙两同学观点正确的是________(填“甲”或
“乙”);判断的理由是
_______________________________________________________
___________________________________________________________
______________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,
请列举其中的两个优点
_______________________________________________________
___________________________________________________________
______________________________。
【解析】 本题考查盖斯定律,ΔH1-ΔH2-ΔH3 即为 C(s)与水
蒸气反应的焓变。因此 C(s)与水蒸气反应的热化学方程式为:
C(s)+H2O(g)===CO(g)+H2(g) ΔH=131.5 kJ·mol-1。
(2)根据盖斯定律,煤转化为水煤气再燃烧放出的热量与煤直接
燃烧放出的热量应相等,甲同学的错误在于忽视了煤转化为水煤气时
要吸收热量。
【答案】 (1)C(s)+H2O(g)===CO(g)+H2(g)
ΔH=131.5 kJ·mol-1
(2)乙 甲同学忽略了煤转化为水煤气要吸收热量(或ΔH1=ΔH2
+ΔH3 且ΔH2>0)
(3)①减少污染;②燃烧充分;③方便输送(任填两个)
硅习题 (附参考答案)
一、选择题
1.(2012·潍坊三县联考)下列叙述合理的是( )
A.构成普通钢和不锈钢的主要元素都是铁,因此它们的化学性
质完全相同
B.金属材料都是导体,非金属材料都是绝缘体
C.我国规定商家不得无偿提供塑料袋,目的是减少“白色污
染”
D.光导纤维非常细,导光能力非常强,能同时传输大量信息,
光导纤维是由硅晶体制成的
【答案】 C
2.关于硅的化学性质的叙述中,不正确的是( )
A.在常温下,不与任何酸反应
B.在常温下,可与强碱溶液反应
C.在加热条件下,能与氧气反应
D.单质硅的还原性比碳的还原性强
【答案】 A
3.(2012·潍坊四县一校质检)“信息”、“材料”和“能源”被
称为新科技革命的三大支柱。下列有关资讯错误的是( )
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要
能源
B.目前中、美、日等国掌握的陶瓷发动机技术,大大提高了发
动机的能量转化效率
C.2011 年 9 月 29 日成功发射的“天宫一号”目标飞行器使用
了大量的复合材料
D.合成高分子材料的广泛应用是有百利而无一害
【答案】 D
4.(2012·乐陵质检)下列物质的变化,不能通过一步化学反应完
成的是( )
A.CO2→H2CO3 B.SiO2→Na2SiO3
C.SiO2→H2SiO3 D.Na2SiO3→H2SiO3
【 解 析 】 A 项 , CO2 + H2O H2CO3 ; B 项 , SiO2 +
2NaOH===Na2SiO3+H2O;D 项,Na2SiO3+CO2+H2O===Na2CO3+
H2SiO3↓;C 项,SiO2 与 H2O 不反应,不能一步完成。
【答案】 C
5.下列叙述正确的是( )
A.因为 CaCO3+SiO2=====高温 CaSiO3+CO2↑,所以硅酸的酸性比
碳酸强
B.碳和硅都是ⅣA 族的元素,所以二氧化碳和二氧化硅的物理
性质相似
C.二氧化硅既溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅
是两性氧化物
D.二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不能和水
反应生成硅酸
【解析】 根据酸盐之间复分解反应进行的方向判断酸性强弱一
般是在常温湿态下适用,在高温干态下不适用,事实是碳酸酸性比硅
酸强,故 A 项错误;CO2 和 SiO2 属不同类型晶体,在物理性质方面
有很大差异,故 B 项错误;SiO2 能与氢氟酸反应,但不与一般的酸
反应,SiO2 不是碱性氧化物,故 C 项错误;SiO2 虽属于酸性氧化物,
但不能直接与 H2O 反应生成 H2SiO3,D 项正确。
【答案】 D
6.下列离子方程式不.正确的是( )
A.石英与烧碱反应:SiO2+2OH-===SiO2-
3 +H2O
B.硅与烧碱反应:Si+2OH-===SiO2-
3 +H2↑
C.硅酸钠溶液中通入少量 CO2:
SiO2-
3 +CO2+H2O===CO2-
3 +H2SiO3↓
D.往水玻璃中加入盐酸:2H++SiO2-
3 ===H2SiO3↓
【解析】 硅与烧碱溶液反应时,H2O 参与反应,
Si+2OH-+H2O===SiO2-
3 +2H2↑。
【答案】 B
7.(2012·博兴质检)将陶瓷和黏结金属研磨,混合均匀,成型后
在不活泼气氛中烧结,就可以制得金属陶瓷。金属陶瓷兼有金属和陶
瓷的优点,其密度小,硬度高、耐磨、导热性好,不会因骤冷或骤热
而炸裂。实验室中有一金属陶瓷制成的容器,可以用来盛放下列哪种
物质( )
A.NaOH 溶液 B.KNO3 溶液
C.氢氟酸 D.盐酸
【解析】 金属陶瓷有金属和陶瓷的优点,但其成分中 SiO2 与
NaOH 和 HF 反应,其中的金属易与盐酸反应。
【答案】 B
8.将足量 CO2 气体通入水玻璃(Na2SiO3 溶液)中,然后加热蒸干,
再在高温下充分灼烧,最后得到的固体物质是( )
A.Na2SiO3 B.Na2CO3、Na2SiO3
C.Na2CO3、SiO2 D.SiO2
【解析】 将足量 CO2 气体通入水玻璃中,发生反应:2CO2+
Na2SiO3+2H2O===H2SiO3↓+2NaHCO3;加热蒸干高温灼烧时发生
反应:H2SiO3=====△ H2O+SiO2;2NaHCO3=====△ Na2CO3+CO2↑+
H2O;Na2CO3+SiO2=====高温 Na2SiO3+CO2↑,所以最后所得固体物质
是 Na2SiO3,故选 A 项。
【答案】 A
9.国家质检总局称,在我国销售的德国 NUK 牌婴儿爽身粉含
有一级致癌物“滑石粉”。已知滑石粉的化学式为 Mg3(Si4O10)(OH)2,
色白、滑爽、柔软、具有耐火性。下列有关说法不正确的是( )
A.滑石粉属于无机硅酸盐类物质
B.滑石粉组成可表示为 3MgO·4SiO2·H2O
C.爽身粉中添加滑石粉是利用它的滑爽、柔软、耐火性
D.滑石粉可能与氢氟酸、NaOH 溶液发生反应
【解析】 题干中指出滑石粉是致癌物,故爽身粉中不应添加滑
石粉。
【答案】 C
10.下表各组物质中,满足下图物质一步转化关系的选项是
( )
选项 X Y Z
A. Na NaOH NaHCO3
B. Cu CuSO4 Cu(OH)2
C. C CO CO2
D. Si SiO2 H2SiO3
【解析】 A 项,NaHCO3 无法直接转化为 Na;B 项 Cu(OH)2
无法直接转化为 Cu;D 项,SiO2 无法直接转化为 H2SiO3,H2SiO3 也
无法直接转化为 Si。
【答案】 C
二、非选择题
11.(2012·石家庄测试)含硅材料有广泛用途。
(1)硅酸盐材料是传统无机非金属材料,下列属于硅酸盐产品的
是________。
①玻璃 ②陶瓷 ③石英玻璃 ④硅芯片 ⑤光导纤维
⑥水泥 ⑦砖瓦
(2)某硅酸盐样品中锌的质量分数为 58.6%,其化学组成用氧化物
形式可表示为 nZnO·SiO2,则 n 值等于________。
(3)磷酸钙陶瓷是一种新型无机非金属材料,可用于制造人造骨
骼,这是利用了这类材料的________。
A.耐高温的特性 B.电学特性
C.光学特性 D.生物功能
【答案】 (1)①②⑥⑦ (2)2 (3)D
12.欲除去下表中各粉末状混合物中的杂质(括号内为杂质),请
填写所用试剂、操作名称及化学方程式。
样品 所用试剂 操作名称 化学方程式
SiO2(CaCO3) 过滤
CaCO3(SiO2)
SiO2(Si)
SiO2(H2SiO3)
【答案】
样品 所用试剂 操作名称 化学方程式
SiO2(CaCO3) 盐酸
CaCO3+
2HCl=== CaCl2
+H2O+CO2↑
CaCO3(SiO2) NaOH 溶
液 过滤
2NaOH+
SiO2=== Na2SiO3
+H2O
SiO2(Si) 氧气 加热 Si+
O2=====△ SiO2
SiO2(H2SiO3) - 加热 H2SiO3=====△ SiO
2+H2O
13.A、B、C、D、E 代表单质或化合物,它们之间的相互转换关
系如下所示。A 为地壳中含量仅次于氧的非金属元素的单质,其晶体
结构与金刚石相似。
请填空:
(1)单质 A 的原子结构示意图为____________,它的最高化合价
为________。
(2)B 的化学式为__________,B 和碳反应生成 A 和 E 的化学方
程式是___________________________________________________
______________________________________________________。
(3)C 的化学式为________,D 的化学式为________。
【解析】 由“A 为地壳中含量仅次于氧的非金属单质,晶体结
构与金刚石相似”推知 A 为 Si,根据 B――→加碳
高温 A+E,B ――→加氧化钙
高温 C,
B ――→加氢氧化钠
加热 D+H2O,不难推知 B 为 SiO2,C 为 CaSiO3,D 为 Na2SiO3。
【答案】
(2)SiO2 SiO2+2C=====高温 Si+2CO↑
(3)CaSiO3 Na2SiO3
14.有一种矿石,测定其含有的镁、硅、氧三种元素的质量比为
12∶7∶16。
(1)用盐的组成表示其化学式:___________________________;
(2)用氧化物的组成表示其化学式:_______________________;
(3)该矿石的成分属于________(填物质的分类)。
【解析】 硅酸盐用氧化物的形式表示时,必须遵循各元素化合
价不变的原则。矿石中 Mg、Si、O 三种元素原子个数比为12
24
∶ 7
28
∶16
16
=2∶1∶4。故其化学式为 Mg2SiO4。
【答案】 (1)Mg2SiO4 (2)2MgO·SiO2 (3)硅酸盐
海水中的元素(附参考答案)
一、选择题
1.海水是一个巨大的化学资源宝库,下列有关海水综合利用的
说法正确的是( )
A.从海水中可以得到 NaCl,电解熔融 NaCl 可制备 Cl2
B.海水蒸发制海盐的过程中只发生了化学变化
C.海水中含有钾元素,只需经过物理变化就可以得到钾单质
D.利用潮汐发电是将化学能转化为电能
【答案】 A
2.在盛有溴水的三支试管中分别加入少量苯、四氯化碳和酒精,
振荡后静置,出现下列现象,正确的结论是( )
A.①加 CCl4 ②加苯 ③加酒精
B.①加酒精 ②加 CCl4 ③加苯
C.①加苯 ②加 CCl4 ③加酒精
D.①加苯 ②加酒精 ③加 CCl4
【答案】 C
3.下列溶液能与镁反应生成氢气的是( )
A.氯化铵溶液 B.氢氧化钠溶液
C.碳酸钾溶液 D.硝酸溶液
【解析】 Mg 是排在氢之前的活泼金属,所以遇到显酸性的溶
液会放出 H2,氯化铵溶液因为 NH+
4 +H2O NH3·H2O+H+,铵根
离子的水解显酸性,所以放出 H2;NaOH 溶液呈碱性,不能与 Mg
反应;K2CO3 溶液因 CO 2-
3 的水解呈碱性,与 Mg 不反应;硝酸与金
属反应,+5 价的氮得到电子被还原,H+不得电子,故不能生成 H2。
【答案】 A
4.(2012·莱西质检)在溴水中加入或通入下列物质:
① 镁 粉 ②SO2 ③H2S ④AgNO3 溶 液 ⑤NaHCO3 溶 液
⑥NH3 ⑦KI,能使溶液退色的是( )
A.全部 B.④⑦
C.除⑦外 D.②③④⑤
【解析】 KI 与溴水反应后生成 I2,I2 溶于水形成碘水,碘水仍
然有颜色。
【答案】 C
5.许多国家十分重视海水资源的综合利用。不需要化学变化就
能够从海水中获得的物质是( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水
【解析】 本题考查海水资源的综合利用。获得 Cl2、NaOH、
H2 需要电解饱和食盐水;获得 Na、Mg、Al 需电解相应熔融物,Br2、
I2 需由 Br-、I-氧化得到;食盐、淡水分别通过海水蒸发、蒸馏即可
得到。
【答案】 D
6.(2012·日照模拟)某学生做如下实验:第一步,在淀粉 KI 溶液
中,滴入少量 NaClO 溶液,并加入少量稀硫酸,溶液立即变蓝;第
二步,在上述蓝色溶液中,滴加足量的 Na2SO3 溶液,蓝色逐渐消失。
下列叙述中该同学对实验原理的解释和所得结论不正确的是( )
A.第一步反应的离子方程式为:ClO-+2I-+2H+===I2+Cl-+
H2O
B.淀粉 KI 溶液变蓝是因为 I-被氧化为 I2,I2 遇淀粉变蓝色
C.蓝色逐渐消失的原因是 Na2SO3 溶液具有漂白性
D.微粒的氧化性由强到弱的顺序是:ClO->I2>SO2-
4
【解析】 NaClO 将 I-氧化生成 I2,I2 遇淀粉变蓝色,说明 ClO
-具有强氧化性,加入 Na2SO3 溶液后,蓝色逐渐消失,说明 I2 又被还
原成了 I-,Na2SO3 具有还原性,两步实验可知微粒的氧化性 ClO
->I2>SO2-
4 。
【答案】 C
7.(2012·三明质检)取体积相同的 KI、Na2SO3、FeBr2 溶液,分
别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量
相同,则 KI、Na2SO3、FeBr2 溶液的物质的量浓度之比为( )
A.2∶1∶2 B.2∶1∶3
C.6∶3∶2 D.3∶7∶1
【解析】 由于三种溶质与足量 Cl2 反应,1 mol KI→I2 失去 1 mol
e-、1 mol Na2SO3→Na2SO4 失去 2 mol e-、1 mol FeBr2→Fe3+和 Br2
失去 3 mol e-,当反应的 n(Cl2)相同时,即三种溶质失去相同的电子
数。假设均失去 1 mol e-,则需要:KI 为 1 mol、Na2SO3 为1
2 mol、
FeBr2 为1
3 mol,则所求为:1∶1
2
∶1
3
=6∶3∶2,故选 C 项。
【答案】 C
8.将 0.03 mol Cl2 缓缓通入含有 0.02 mol H2SO3 和 0.02 mol HBr
的混合液中,则溶液中 H+的浓度与通入的氯气的物质的量的关系是
下列图中的(纵坐标都表示氢离子的物质的量浓度)( )
【解析】 因 H2SO3 的还原性比 HBr 强,故向二者的混合液中
通入氯气时,H2SO3 先被氧化,此时溶液中 n(H+)、n(Cl-)及溶液中自
由移动的离子的浓度将增大,直至 H2SO3 被消耗完全;继续通入氯气,
则发生反应:Cl2+2HBr===2HCl+Br2,此时溶液中 n(Cl-)将继续增
大,而 c(Br-)则减小,但溶液中 H+的浓度基本不变。
【答案】 B
9.溴是海水中重要的非金属元素。地球上 90%的溴元素以 Br-
的形式存在于海水中,所以人们称溴为“海洋元素”。下列有关说法
中正确的是( )
A.从海水中提取溴时,一定不涉及氧化还原反应
B.苯与溴水反应生成溴苯
C.可以用 CCl4 萃取溴水中的溴
D.向 FeBr2 溶液中通入 Cl2 时,一定会发生如下反应:
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
【解析】 从海水中提取溴,一般要经历浓缩、氧化和提取三个
步骤,故 A 不正确。苯只能与液溴在催化剂作用下发生取代反应,
故 B 不正确。FeBr2 与 Cl2 反应时,因 Cl2 的量不同,生成物不同,
题目中没有说明 Cl2 与 FeBr2 的量的关系。
【答案】 C
10.(2012·潍坊三县联考)海洋中有丰富的食品、矿产、能源、药
物和水产资源等(如图所示)。
下列有关说法不正确的是( )
A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化
为化学能的过程
B.过程②中结晶出的 MgCl2·6H2O 要在 HCl 氛围中加热脱水制
得无水 MgCl2
C.在过程③⑤中溴元素均被氧化
D.过程①中除去粗盐中的 SO2-
4 、Ca2+、Mg2+、Fe3+等杂质,加
入化学药品的顺序为:Na2CO3 溶液→NaOH 溶液→BaCl2 溶液→过滤
后加盐酸
【解析】 A 正确;为防止水解,MgCl2·6H2O 要在 HCl 氛围中
加热脱水,B 正确;由 Br 元素化合价变化可知 C 正确;过程①中除
去粗盐中的 SO2-
4 、Ca2+、Mg2+、Fe3+等杂质,Na2CO3 溶液要放到 BaCl2
溶液后面,这样才能将过量的 Ba2+除去,D 不正确。
【答案】 D
二、非选择题
11.某校同学为探究 Br2、I2 和 Fe3+的氧化性强弱,进行了如下
实验。
①取少量 KI 溶液于试管中,先加入溴水,振荡,再加入 CCl4,
振荡后静置,观察到下层液体呈紫红色;
②取少量 FeSO4 溶液于试管中,先加入溴水,振荡,再继续滴加
两滴 KSCN 溶液,振荡,观察到溶液呈红色。
(1)写出实验②中发生反应的离子方程式:___________________
______________________________________________________。
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是(填
序号)__________。
A.Br2>I2 B.Fe3+>Br2
C.Br2>Fe3+ D.I->Br-
(3)已知 Fe3+的氧化性强于 I2,请你从所给试剂中选择所需试剂,
设计一个实验证明。
①FeCl3 溶液 ②碘水 ③KI 溶液 ④稀 H2SO4
⑤淀粉溶液
_______________________________________________________
______________________________________________________。
【 答 案 】 (1)2Fe2 + + Br2===2Fe3 + + 2Br - 、 Fe3 + + 3SCN -
===Fe(SCN)3
(2)A、C
(3)取少量 FeCl3 溶液于试管中,依次加入 KI 溶液和淀粉溶液,
振荡 溶液变蓝,说明生成了 I2,从而证明 Fe3+的氧化性强于 I2
12.A 和 B 均为钠盐的水溶液,A 呈中性,B 呈碱性并具有氧化
性。下述为相关实验步骤和实验现象:
请回答:
(1)写出 A、B、C 的化学式:
A________,B________,C________。
(2)依次写出A→D、D→E(E 中含有某+5价元素的含氧酸根离子)
和 B→F 的离子方程式:___________________________________;
______________________________________________________。
(3)写出将足量 F 通入 FeBr2 溶液中的离子方程式:_____________
______________________________________________________。
【解析】 钠盐 A 能和 AgNO3 溶液反应生成一种难溶于稀硝酸
的黄色沉淀,可确定 A 为 NaI,C 为 AgI;黄绿色气体 F 是 Cl2;F
和 NaOH 溶液反应生成钠盐 B,根据 B 呈碱性并具有强氧化性,可
知 B 为 NaClO,NaClO 具有强氧化性,能氧化 NaI,少量 NaClO 能
将 NaI 氧化成 I2,进一步反应生成 NaIO3,其中 I 为+5 价;Cl2 氧化
NaBr 生成 Br2,Br2 又能氧化 NaI 生成 I2。
【答案】 (1)NaI NaClO AgI
(2)2I-+ClO-+H2O===I2+Cl-+2OH-
I2+5ClO-+2OH-===2IO-
3 +5Cl-+H2O
ClO-+Cl-+2H+===Cl2↑+H2O
(3)3Cl2+2Fe2++4Br-===2Fe3++2Br2+6Cl-
13.(2012·广州六校联考)从海水中可提取多种化工原料,如图是
工业上对海水的几项综合利用的示意图:
请回答下列问题:
(1)写出用海滩上的贝壳制取 Ca(OH)2 的化学方程式:_________
______________________________________________________。
(2)写出电解饱和氯化钠溶液的化学方程式:________________
______________________________________________________。
(3)写出电解熔融氯化镁制取镁的化学方程式:______________
_____________________________________________________。
(4)将电解生成的氯气通入氢氧化钠溶液中可得到一种消毒液,
写出反应的化学方程式:_____________________________________
______________________________________________________。
(5)从经济效益角度看,该化工厂的厂址应选择在________。
【解析】 贝壳的主要成分是碳酸钙,煅烧碳酸钙可制得氧化钙,
氧化钙与水反应即可制得氢氧化钙;Cl2 与 NaOH 反应可制得具有漂
白作用的 NaClO;该工厂需用到大量海水,所以厂址应选在海边。
【答案】 (1)CaCO3=====高温 CaO+CO2↑,
H2O+CaO===Ca(OH)2
(2)2NaCl+2H2O=====通电 2NaOH+H2↑+Cl2↑
(3)MgCl2=====通电 Mg+Cl2↑
(4)2NaOH+Cl2===NaCl+NaClO+H2O
(5)海边
14.(2011·潍坊模拟)某化学研究性学习小组在实验室中模拟海水
提取溴的过程,其实验流程如下:
(1)取 24 L 除去悬浮杂质后的海水,浓缩至 2 L;
(2)向其中通入足量 Cl2,反应的离子方程式:_________________
_____________________________________,通入热空气的目的:
______________;
(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、NaBrO3和CO2,
反应的化学方程式:_____________________________________,
产生的 CO2 通入足量澄清石灰水中,得到 1 g 白色沉淀;
(4)请计算海水中溴的浓度为________g·L-1。
【解析】 通过反应 Cl2+2Br-===Br2+2Cl-置换出溴单质后,
一般用热空气或水蒸气将 Br2 吹出;根据各步反应,可确定如下关系:
Br2~CO2~CaCO3,根据 CaCO3 的质量可求出原 24 L 海水中 Br2 的
质量为160 g·mol-1×1 g
100 g·mol-1
=1.6 g,则海水中溴的浓度为1.6 g
24 L
≈0.07 g·L
-1。
【答案】 (2)Cl2+2Br-===Br2+2Cl- 将 Br2 吹出
(3)3Br2+3Na2CO3===5NaBr+NaBrO3+3CO2↑ (4)0.07