- 3.44 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题
3
化学
Ⅱ
卷中的各类计算填空专项突破
建议课时:
2
课时
(
一讲一练
)
专项突破一 解答化学
Ⅱ
卷计算题的常用方法
1
.
利用守恒思想计算
【典例
1
】
(2017·
江苏化学,
18)
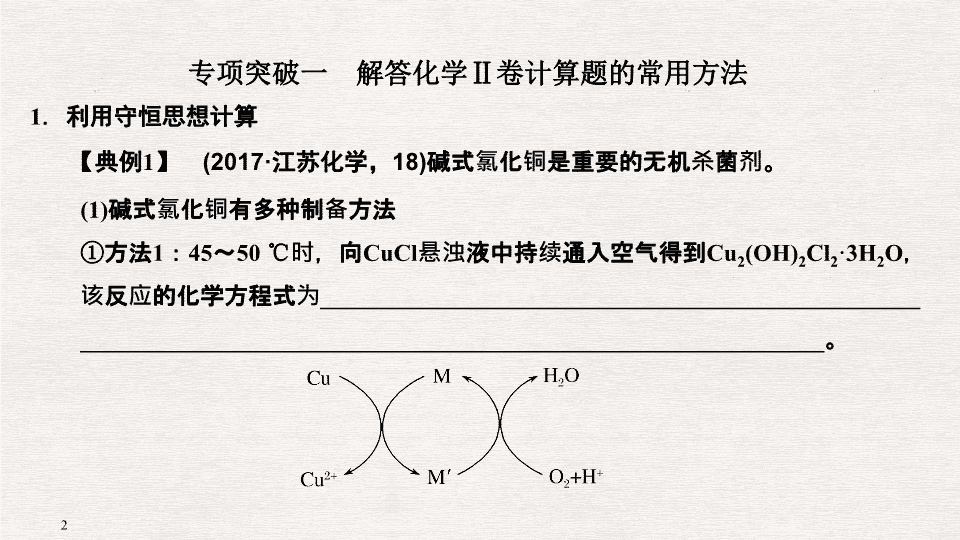
碱式氯化铜是重要的无机杀菌剂。
(1)
碱式氯化铜有多种制备方法
①
方法
1
:
45
~
50
℃
时,向
CuCl
悬浊液中持续通入空气得到
Cu
2
(OH)
2
Cl
2
·3H
2
O
,该反应的化学方程式为
__________________________________________________
______________________________________________________________
。
②
方法
2
:先制得
CuCl
2
,再与石灰乳反应生成碱式氯化铜。
Cu
与稀盐酸在持续通入空气的条件下反应生成
CuCl
2
,
Fe
3
+
对该反应有催化作用,其催化原理如图所示。
M′
的化学式为
________
。
(2)
碱式氯化铜有多种组成,可表示为
Cu
a
(OH)
b
Cl
c
·
x
H
2
O
。为测定某碱式氯化铜的组成,进行下列实验:
①
称取样品
1.116 0 g
,用少量稀
HNO
3
溶解后配成
100.00 mL
溶液
A
;
②
取
25.00 mL
溶液
A
,加入足量
AgNO
3
溶液,得
AgCl 0.172 2 g
;
③
另取
25.00 mL
溶液
A
,调节
pH 4
~
5
,用浓度为
0.080 00 mol·L
-
1
的
EDTA(Na
2
H
2
Y·2H
2
O)
标准溶液滴定
Cu
2
+
(
离子方程式为
Cu
2
+
+
H
2
Y
2
-
===CuY
2
-
+
2H
+
)
,滴定至终点,消耗标准溶液
30.00 mL
。通过计算确定该样品的化学式。
[
解决方案
]
1
.三大守恒思想
2
.电子守恒解题的思维模板
特别提醒
对于多步连续进行的氧化还原反应,只要中间各步反应过程中没有损耗,可直接找出起始物和最终产物,删去中间产物,建立二者之间的电子守恒关系,快速求解。
【对点训练】
1
.
(
转移电子守恒
)
(1)
[2016·
新课标
Ⅰ
,
28(5)]
“
有效氯含量
”
可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化
能力相当于多少克
Cl
2
的氧化能力。
NaClO
2
的有效氯含量为
________
。
(
计算结果保留两位小数
)
。
答案
1.57
答案
0.5
2
.
(
电荷守恒
)
为节约成本,工业上用
NaClO
3
氧化酸性
FeCl
2
废液得到
FeCl
3
。
答案
2
若酸性
FeCl
2
废液中
c
(Fe
2
+
)
=
2.0
×
10
-
2
mol·L
-
1
,
c
(Fe
3
+
)
=
1.0
×
10
-
3
mol·L
-
1,
c
(Cl
-
)
=
5.3
×
10
-
2
mol·L
-
1
,则该溶液的
pH
约为
________
。
3
.
(
质量守恒
)
(1)LiPF
6
产品中通常混有少量
LiF
。取样品
w
g
,测得
Li
的物质的量为
n
mol
,则该样品中
LiPF
6
的物质的量为
________ mol(
用含
w
、
n
的代数式表示
)
。
(2)
在空气中煅烧
CoC
2
O
4
生成钴氧化物和
CO
2
,测得充分煅烧后固体质量为
2.41 g
,
CO
2
的体积为
1.344 L(
标准状况
)
,则钴氧化物的化学式为
________
。
答案
Co
3
O
4
2
.
利用方程式之间的关系计算
【典例
2
】
(2017·
课标全国
Ⅱ
,
28)
水中溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
问题:取
100.00 mL
水样经固氧、酸化后,用
a
mol·L
-
1
Na
2
S
2
O
3
溶液滴定,以淀粉溶液作指示剂,
若消耗
Na
2
S
2
O
3
溶液的体积为
b
mL
,则水样中溶解氧的含量为
________ mg·L
-
1
。
[
解题思路
]
根据反应过程确定关系式
过程
对应反应
氧的固定
2Mn(OH)
2
+
O
2
===2MnO(OH)
2
MnO(OH)
2
还原为
Mn
2
+
MnO(OH)
2
+
2I
-
+
4H
+
===Mn
2
+
+
I
2
+
3H
2
O
滴定过程
2S
2
O
+
I
2
===2I
-
+
S
4
O
关系式:
O
2
~
2MnO(OH)
2
~
2I
2
~
4Na
2
S
2
O
3
答案
80
ab
【典例
3
】
[2015·
全国卷
Ⅰ
,
36(6)]
氯化亚铜
(CuCl)
广泛应用于化工、印染、电镀等行业。
CuCl
难溶于醇和水,可溶于氯离子浓度较大的体系。在潮湿空气中易水解氧化。以海绵铜
(
主要成分是
Cu
和少量
CuO)
为原料,采用硝酸铵氧化分解技术生产
CuCl
的工艺过程如下:
回答下列问题:
[
解决方案
]
利用关系式法解题的思维模板
【对点训练】
4
.
ClO
2
易溶于水,用水吸收
ClO
2
得到
ClO
2
溶液。为测定所得溶液中
ClO
2
的含量,进行了下列实验:
步骤
1
:准确量取
ClO
2
溶液
10.00 mL
,稀释成
100.00 mL
试样;量取
V
1
mL
试样加入到锥形瓶中;
步骤
2
:调节试样的
pH
≤
2.0
,加入足量的
KI
晶体,静置片刻;
步骤
3
:加入淀粉指示剂,用
c
mol·L
-
1
Na
2
S
2
O
3
溶液滴定至终点,消耗
Na
2
S
2
O
3
溶液
V
2
mL
。
(
已知
2Na
2
S
2
O
3
+
I
2
===Na
2
S
4
O
6
+
2NaI)
原
ClO
2
溶液的浓度为
________ g/L(
用步骤中的字母代数式表示
)
。
答案
135
cV
2
/
V
1
5
.实验室可由软锰矿
(
主要成分为
MnO
2
)
制备
KMnO
4
,方法如下:软锰矿与过量固体
KOH
和
KClO
3
在高温下反应,生成锰酸钾
(K
2
MnO
4
)
和
KCl
;用水溶解,滤去残渣,滤液酸化后,
K
2
MnO
4
转变为
MnO
2
和
KMnO
4
;滤去
MnO
2
沉淀,浓缩滤液,结晶得到深紫色的针状
KMnO
4
。
问题:若用
16.3 g
软锰矿
(
含
MnO
2
80%)
进行上述实验最终生成的
KMnO
4
与
Na
2
C
2
O
4
反应,则消耗
Na
2
C
2
O
4
的物质的量为
________
。
答案
0.25 mol
专项突破二
Ⅱ
卷化学计算题分题型突破
1.
实验中的计算
类型及方法总结
类型
解题方法
物质含量计算
①
根据关系式法、得失电子守恒法、滴定法等,得出混合物中某一成分的量。
②
由
①
中求出量,除以样品的总量,即可得出其含量
确定物质化学式的计算
①
根据题给信息,计算出可求粒子的物质的量。
②
根据电荷守恒,确定出未知粒子的物质的量。
③
根据质量守恒,确定出结晶水的物质的量。
④
各粒子的物质的量之比,即为物质化学式的下标比
【典例
4
】
(2017·
课标全国
Ⅰ
,
26
节选
)
凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:
NH
3
+
H
3
BO
3
===NH
3
·H
3
BO
3
;
NH
3
·H
3
BO
3
+
HCl===NH
4
Cl
+
H
3
BO
3
。
回答下列问题:
仪器清洗后,
g
中加入硼酸
(H
3
BO
3
)
和指示剂,铵盐试样由
d
注入
e
,随后注入氢氧化钠溶液,用蒸馏水冲洗
d
,关闭
K
1
,
d
中保留少量水,打开
K
1
,加热
b
,使水蒸气进入
e
。
取某甘氨酸
(C
2
H
5
NO
2
)
样品
m
克进行测定,滴定
g
中吸收液时消耗浓度为
c
mol·L
-
1
的盐酸
V
mL
,则样品中氮的质量分数为
________%
,样品的纯度
≤
________%
。
【对点训练】
6
.已知
CaO
2
在
350
℃
迅速分解生成
CaO
和
O
2
。下图是实验室测定产品中
CaO
2
含量的装置
(
夹持装置省略
)
。
若所取产品质量是
m
g
,测得气体体积为
V
mL(
已换算成标准状况
)
,则产品中
CaO
2
的质量分数为
________(
用字母表示
)
。
过氧化钙的含量也可用重量法测定,需要测定的物理量有
________
。
2
.
无机综合
(
工艺流程
)
中的计算
类型及方法总结
多步滴
定计算
复杂的滴定可分为两类:
①
连续滴定法:第一步滴定反应生成的产物,还可以继续参加第二步的滴定。根据第二步滴定的消耗量,可计算出第一步滴定的反应物的量
②
返滴定法:第一步用的滴定剂是过量的,然后第二步再用另一物质返滴定计算出过量的物质。根据第一步加入的量减去第二步中过量的量,即可得出第一步所求物质的物质的量
电化学
计算
根据得失电子守恒关系建立起已知量与未知量之间的桥梁,构建计算所需的关系式。
如以通过
4 mol e
-
为桥梁可构建如下关系式:
(
式中
M
为金属,
n
为其离子的化合价数值
)
根据溶
度积常
数进行
计算
1.
表达式
(1)
溶度积
K
sp
(A
m
B
n
)
=
c
m
(A
n
+
)·
c
n
(B
m
-
)
,式中的浓度都是平衡浓度
(2)
离子积
Q
c
(A
m
B
n
)
=
c
m
(A
n
+
)·
c
n
(B
m
-
)
,式中的浓度都是任意浓度
判断在一定条件下沉淀能否生成或溶解
2
.应用
①
Q
c
>
K
sp
:溶液过饱和,有沉淀析出
②
Q
c
=
K
sp
:溶液饱和,处于平衡状态
③
Q
c
<
K
sp
:溶液未饱和,无沉淀析出
【典例
5
】
草酸钴是制备钴氧化物的重要原料。下图为二水合草酸钴
(CoC
2
O
4
·2H
2
O)
在空气中受热的质量变化曲线,曲线中
300
℃
及以上所得固体均为钴氧化物。
(1)
通过计算确定
C
点剩余固体的成分为
________(
填化学式
)
。试写出
B
点对应的物质与
O
2
在
225
~
300
℃
条件下发生反应的化学方程式:
___________________________
_______________________________________________________
。
(2)
取一定质量的二水合草酸钴分解后的钴氧化物
(
其中
Co
的化合价为+
2
、+
3
价
)
,用
480 mL 5 mol·L
-
1
盐酸恰好完全溶解固体,得到
CoCl
2
溶液和
4.48 L(
标准状况
)
黄绿色气体。试确定该钴氧化物中
Co
、
O
的物质的量之比
(
写出计算过程
)________ ______________________________________________
。
【对点训练】
7
.碱式碳酸铝镁
[Mg
a
Al
b
(OH)
c
(CO
3
)
d
·
x
H
2
O]
常用作塑料阻燃剂。
为确定碱式碳酸铝镁的组成,进行如下实验:
①
准确称取
3.390 g
样品与足量稀盐酸充分反应,生成
CO
2
0.560 L(
已换算成标准状况下
)
。
②
另取一定量样品在空气中加热,样品的固体残留率
(
固体样品的剩余质量
/
固体样品的起始质量
×
100%)
随温度的变化如图所示
(
样品在
270
℃
时已完全失去结晶水,
600
℃
以上残留固体为金属氧化物的混合物
)
。
8
.
(2018·
高考押题卷
)
(
工艺流程图略
)
硼氢化物
NaBH
4
(B
元素的化合价为+
3
价
)
燃料电池,其工作原理如图所示,放电时,每转移
2 mol
电子,理论上需要消耗
________ g NaBH
4
。
答案
9.5
3
.
化学原理综合中的计算
类型
解题方法
反应热
的计算
(1)
几种物质的能量
(kJ·mol
-
1
)
如表所示
(
在标准状态下,规定单质的能量为
0
,测得其他物质生成时放出的热量为其具有的能量
)
:
物质
CO
2
(g)
H
2
(g)
CH
2
===CH
2
(g)
H
2
O(g)
能量
/kJ·mol
-
1
-
394
0
52
-
242
Δ
H
=
________ kJ·mol
-
1
。
(2)
几种化学键的键能
(kJ·mol
-
1
)
。
a
=
________
。
[
思路点拨
]
从宏观的角度讲,反应热是生成物自身的总能量与反应物自身总能量的差值,根据第
(1)
问中所给出的各物质所具有的能量,可以计算反应的热效应。从微观的角度讲,反应热是旧化学键断裂吸收的能量与新化学键形成放出的能量的差值,已知反应的热效应和部分化学键的键能,可求某一化学键的键能。
化学键
C===O
H—H
C===C
H—C
H—O
键能
/kJ·mol
-
1
803
436
615
a
463
解析
(1)Δ
H
=生成物的总能量-反应物的总能量=
(52
-
242
×
4
-
0
+
394
×
2)kJ·mol
-
1
=-
128 kJ·mol
-
1
。
(2)Δ
H
=断裂化学键的总键能-形成化学键的总键能=
(803
×
4
+
436
×
6
-
615
-
4
a
-
463
×
8)kJ·mol
-
1
=-
128 kJ·mol
-
1
,解得
a
=
409.25
。
答案
(1)
-
128
(2)409.25
【对点训练】
9
.
[2016·
全国卷
Ⅱ
,
26(3)]
联氨
(
又称肼,
N
2
H
4
,无色液体
)
是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
①
2O
2
(g)
+
N
2
(g)===N
2
O
4
(l)
Δ
H
1
②
N
2
(g)
+
2H
2
(g)===N
2
H
4
(l)
Δ
H
2
③
O
2
(g)
+
2H
2
(g)===2H
2
O(g)
Δ
H
3
④
2N
2
H
4
(l)
+
N
2
O
4
(l)===3N
2
(g)
+
4H
2
O(g)
Δ
H
4
上述反应热效应之间的关系式为
Δ
H
4
=
________________________________
。
答案
2Δ
H
3
-
2Δ
H
2
-
Δ
H
1
10
.已知下列热化学方程式
Fe
2
O
3
(s)
+
3CO(g)===2Fe(s)
+
3CO
2
(g)
Δ
H
1
=-
25 kJ·mol
-
1
①
3Fe
2
O
3
(s)
+
CO(g)===2Fe
3
O
4
(s)
+
CO
2
(g)
Δ
H
2
=-
47 kJ·mol
-
1
②
Fe
3
O
4
(s)
+
CO(g)===3FeO(s)
+
CO
2
(g)
Δ
H
3
=+
19 kJ·mol
-
1
③
计算
FeO(s)
+
CO(g)===Fe(s)
+
CO
2
(g)
Δ
H
=
________
。
答案
-
11 kJ·mol
-
1
①
t
℃
时,反应达到平衡时
n
(CO)
∶
n
(CO
2
)
=
________
。
②
若在
1 L
密闭容器中加入
0.02 mol FeO(s)
,并通入
x
mol CO
,
t
℃
时反应达到平衡。此时
FeO(s)
转化率为
50%
,则
x
=
________
。
答案
4
0.05
①
列式计算实验
a
从反应开始至达到平衡时的反应速率
v
(AX
5
)
=
________
。
②
用
p
0
表示开始时总压强,
p
表示平衡时总压强,
α
表示
AX
3
的平衡转化率,则
α
的表达式为
____________________________________________
;
实验
a
和
c
的平衡转化率:
α
a
为
________
,
α
c
为
________
。