- 2.02 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
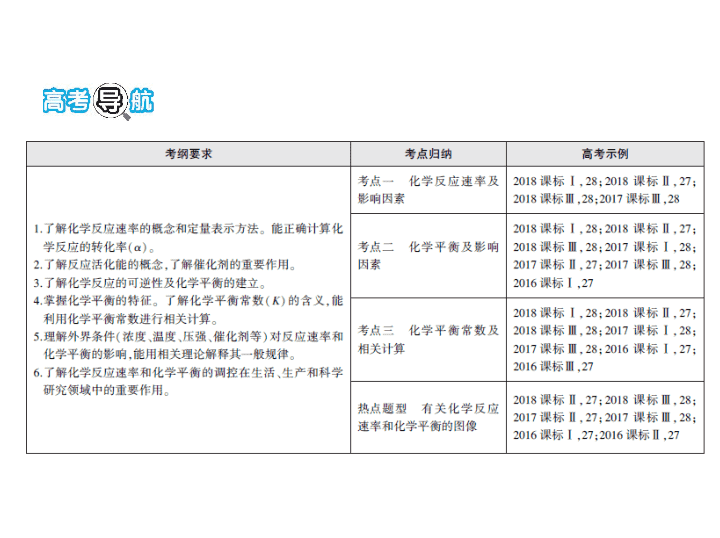
专题六 化学反应速率和化学平衡
总纲目录
考点一 化学反应速率及影响因素
考点二 化学平衡及影响因素
考点三 化学平衡常数及相关计算
热点题型突破
4
有关化学反应速率和化学平衡的图像
考点一 化学反应速率及影响因素
1.
判断正误(正确的划“√”,错误的划“
✕
”)。
(1)化学反应速率为0.8 mol·L
-1
·s
-1
是指反应1 s时某物质的浓度为
0.8 mol·L
-1
( )
(2)根据化学反应速率的大小可推知化学反应的快慢
( )
(3)对于一个化学反应来说,其反应速率越大,反应现象就越明显
( )
(4)对于反应Zn+H
2
SO
4
ZnSO
4
+H
2
↑,增加Zn的质量(不考虑表
面积变化),生成H
2
的速率加快
( )
(5)加入少量CH
3
COONa晶体可以减小Zn与稀硫酸反应的速率,但
不影响产生H
2
的总量
( )
答案
(1)
✕
(2)√ (3)
✕
(4)
✕
(5)√
2.
某温度时,在2 L密闭容器中X、Y、Z三种物质随时间的变化关
系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为
。
(2)反应开始至2 min,Z的平均反应速率为
。
(3)反应开始至2 min,用X、Y表示的平均反应速率分别为
、
。
(4)5 min后,Z的生成速率
(填“大于”“小于”或“等
于”)Z的分解速率。
答案
(1)3X+Y
2Z (2)0.05 mol·L
-1
·min
-1
(3)0.075 mol·L
-1
·min
-1
0.025 mol·L
-1
·min
-1
(4)等于
解析
(1)由图像可知反应的化学方程式为Y+3X
2Z。(2)
v
(Z)=
=
=0.05 mol·L
-1
·min
-1
。(3)据
v
(X)∶
v
(Y)∶
v
(Z)=3∶1∶2可知:
v
(X)=
v
(Z)=
×
0.05 mol·L
-1
·min
-1
=0.075 mol·L
-1
·
min
-1
,
v
(Y)=
v
(Z)=
×
0.05 mol·L
-1
·min
-1
=0.025 mol·L
-1
·min
-1
。(4)5
min后反应达到平衡状态,故Z的生成速率与分解速率相等。
题组一 化学反应速率的计算
1.
将一定量的气体A、B置于容积为2 L的密闭容器中,发生如下
反应:A(g)+4B(g)
2C(g),反应进行到4 s末,测得A为0.5 mol,B
为0.4 mol,C为0.2 mol。则用反应物B浓度的减少表示该反应的
速率为
( )
A.0.025 mol·L
-1
·s
-1
B.0.012 5 mol·L
-1
·s
-1
C.0.05 mol·L
-1
·s
-1
D.0.1 mol·L
-1
·s
-1
答案
C 4 s末C浓度为0.2 mol,
v
(C)=
=0.025 mol·L
-1
·s
-1
,
根据速率之比等于化学计量数之比,有
v
(B)=2
v
(C)=0.025 mol·L
-1
·
S
-1
×
2=0.05 mol·L
-1
·s
-1
。
2.
一定温度下,10 mL 0.40 mol/L H
2
O
2
溶液发生催化分解。不同时
刻测得生成O
2
的体积(已折算为标准状况)如下表。
t
/min
0
2
4
6
8
10
V
(O
2
)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述
不正确
的是(溶液体积变化忽略不计)
( )
A.0~6 min的平均反应速率:
v
(H
2
O
2
)
≈
3.3
×
10
-2
mol/(L·min)
B.6~10 min的平均反应速率:
v
(H
2
O
2
)<3.3
×
10
-2
mol/(L·min)
C.反应至6 min时,
c
(H
2
O
2
)=0.30 mol/L
D.反应至6 min时,H
2
O
2
分解了50%
答案
C A项,0~6 min,产生
n
(O
2
)=1
×
10
-3
mol,消耗
n
(H
2
O
2
)=2
×
10
-3
mol,则
v
(H
2
O
2
)=
=
≈
3.3
×
10
-2
mol/(L·min),故A正确;
B项,依照A项解题步骤,可知B项正确;C项,反应至6 min时,消耗
n
(H
2
O
2
)为2
×
10
-3
mol,剩余
c
(H
2
O
2
)=
=0.2 mol/L,故C项不正确;D项,反应至6 min时,消耗
n
(H
2
O
2
)为2
×
10
-3
mol,占起始物质的量的50%,故D项正确。
归纳总结
(1)公式法求算化学反应速率
v
(B)=
=
(2)比值法求算化学反应速率
同一化学反应,各物质的反应速率之比等于方程式中各物质的化
学计量数之比。对于反应:
m
A(g)+
n
B(g)
p
C(g)+
q
D(g)来说,则
有
=
=
=
。
题组二 化学反应速率的影响因素
3.
(2018福建龙岩教学质量检查)某温度下,镍和镁分别在O
2
中发
生反应,两种金属表面形成氧化膜厚度的实验记录如下:
反应时间
t
/h
1
4
9
16
25
MgO层厚
Y
/nm
0.05
a
0.20
a
0.45
a
0.80
a
1.25
a
NiO层厚
Y
'/nm
b
2
b
3
b
4
b
5
b
表中
a
和
b
均为与温度有关的常数。
下列判断
错误
的是
( )
A.可用氧化膜生成速率表示金属氧化速率
B.相同条件下,镁比镍耐氧化腐蚀
C.温度越高,
a
、
b
的值越大
D.金属氧化的本质为M-
n
e
-
M
n
+
答案
B 结合数据可知,氧化膜的厚度随时间延长而增加,A项
正确;因
a
、
b
关系不确定,无法比较,B项错误;温度升高,反应速率
加快,C项正确;金属氧化的本质是金属失电子发生氧化反应,D项
正确。
4.
(2017江苏单科,10,2分)H
2
O
2
分解速率受多种因素影响。实验测
得70 ℃时不同条件下H
2
O
2
浓度随时间的变化如图所示。下列说
法正确的是
( )
A.图甲表明,其他条件相同时,H
2
O
2
浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H
2
O
2
分解速率越快
C.图丙表明,少量Mn
2+
存在时,溶液碱性越强,H
2
O
2
分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn
2+
对H
2
O
2
分解速率的影响大
答案
D 本题考查依据影响化学反应速率的因素识图的能
力。A项,从图甲看出,相同时间内,起始
c
(H
2
O
2
)越大,H
2
O
2
的浓度
变化量越大,即分解速率越快,错误;B项,从图乙看出,NaOH溶液浓
度越大,即pH越大,H
2
O
2
分解速率越快,错误;C项,从图丙看出,0.1
mol·L
-1
NaOH与1.0 mol·L
-1
NaOH所示曲线相比,0.1 mol·L
-1
NaOH
对应曲线表示的H
2
O
2
分解速率快,错误;D项正确。
5.
在不同浓度(
c
)、温度(
T
)条件下,蔗糖水解的瞬时速率(
v
)如下
表。下列判断
的是
( )
A.
a
=6.00
B.同时改变反应温度和蔗糖的浓度,
v
可能不变
C.
b
<318.2
D.不同温度时,蔗糖浓度减少一半所需的时间相同
答案
D 根据题表信息可知,相同温度时,随着浓度以等差数列
递减,其瞬时速率也以等差数列递减,故
a
=6.00;同时改变反应温
度和反应物浓度,瞬时速率有可能不变;相同浓度时,温度越高,反
应速率越快,故
b
<318.2;温度升高,瞬时速率加快,故蔗糖浓度减少
一半时,所用时间并不相等,D项错误。
归纳总结
利用“控制变量法”的解题策略
1.
确定变量:解答这类题目时首先要认真审题,理清影响实验探究
结果的因素有哪些。
2.
定多变一:在探究时,应该先确定其他因素不变,只改变一种因
素,看这种因素与探究的问题存在怎样的关系;这样确定一种以
后,再确定另一种,通过分析每种因素与所探究问题之间的关系,
得出所有影响因素与所探究问题之间的关系。
3.
数据有效:解答时注意选择数据(或设置实验)要有效,且变量统
一,否则无法做出正确判断。
考点二 化学平衡及影响因素
1.
判断正误(正确的划“√”,错误的划“
✕
”)。
(1)减小反应物的用量,化学反应速率一定减小,平衡一定向逆反
应方向移动
( )
(2)降低温度,正反应速率的变化要根据反应的热效应来判断
( )
(3)化学平衡向右移动,一定是正反应速率增大或逆反应速率减小
( )
(4)任何可逆反应达到平衡后,改变温度,平衡一定发生移动
(
)
(5)对于可逆反应2SO
2
+O
2
2SO
3
,改变条件使平衡向右移动,
SO
2
的转化率可能增大,也可能减小
( )
(6)化学平衡向正反应方向移动,反应物的转化率一定增大
( )
答案
(1)
✕
(2)
✕
(3)
✕
(4)√ (5)√ (6)
✕
2.
在一定温度下的定容容器中,当下列物理量不再发生变化时:
a.混合气体的压强
b.混合气体的密度
c.混合气体的总物质的量
d.混合气体的平均相对分子质量
e.混合气体的颜色
f.各反应物或生成物的浓度之比等于化学计量数之比
g.某种气体的百分含量
(1)能说明2SO
2
(g)+O
2
(g)
2SO
3
(g)达到平衡状态的是
。
(2)能说明I
2
(g)+H
2
(g)
2HI(g)达到平衡状态的是
。
(3)能说明2NO
2
(g)
N
2
O
4
(g)达到平衡状态的是
。
(4)能说明C(s)+CO
2
(g)
2CO(g)达到平衡状态的是
。
答案
(1)acdg (2)eg (3)acdeg (4)abcdg
题组一 化学平衡状态的判断
1.
工业上可采用CO和H
2
合成甲醇,发生的反应为CO(g)+2H
2
(g)
CH
3
OH(g) Δ
H
<0,若该反应在绝热、恒容的密闭容器中进
行,下列示意图正确且能说明反应在进行到
t
1
时刻达到平衡状态
的是
( )
答案
C
t
1
时刻
v
正
最大,之后随反应进行速率发生变化,说明反
应未达到平衡,A错误;容器的容积不变,气体的总质量不变,则混
合气体的密度始终不变,B错误;该反应的正反应为放热反应,在绝
热容器中随反应进行,体系温度升高,化学平衡常数减小,达到平
衡后,温度不变,平衡常数不变,C正确;对于固定的反应,焓变是固
定的,
t
1
时刻不一定为平衡状态,D错误。
B.混合气体的密度保持不变
C.
c
(N
2
)∶
c
(H
2
O)∶
c
(NH
3
)=4∶6∶4
D.单位时间内断裂4 mol N—H键的同时断裂4 mol
键
2.
4NH
3
(g)+4NO(g)+O
2
(g)
4N
2
(g)+6H
2
O(g) Δ
H
=-1 646 kJ·
mol
-1
,在一定温度下的恒压密闭容器中,能表示上述反应达到化学
平衡状态的是
( )
A.4
v
逆
(N
2
)=
v
正
(O
2
)
答案
B A项,当
v
逆
(N
2
)=4
v
正
(O
2
)时,反应达到平衡状态;B项,反应
过程中,气体体积可变,气体质量不变,则密度可变,当气体密度不
变时,反应达到平衡;C项,不能说明
v
正
=
v
逆
,故不能判断反应是否达
到平衡;D项,单位时间内断裂12 mol N—H键的同时断裂4 mol
键,反应才达到平衡状态。
3.
(2017课标Ⅲ,28节选)298 K时,将20 mL 3
x
mol·L
-1
Na
3
AsO
3
、20
mL 3
x
mol·L
-1
I
2
和20 mL NaOH溶液混合,发生反应:As
(aq)+I
2
(aq)+2OH
-
(aq)
As
(aq)+2I
-
(aq)+H
2
O(l)。溶液中
c
(As
)与
反应时间(
t
)的关系如图所示。
(1)下列可判断反应达到平衡的是
(填标号)。
a.溶液的pH不再变化
b.
v
(I
-
)=2
v
(As
)
c.
c
(As
)/
c
(As
)不再变化
d.
c
(I
-
)=
y
mol·L
-1
(2)
t
m
时,
v
正
v
逆
(填“大于”“小于”或“等于”)。
(3)
t
m
时
v
逆
t
n
时
v
逆
(填“大于”“小于”或“等于”),理由
是
。
(4)若平衡时溶液的pH=14,则该反应的平衡常数
K
为
。
答案
(1)a、c (2)大于 (3)小于
t
m
时生成物浓度较低
(4)
(mol·L
-1
)
-1
解析
(1)平衡时,各物质浓度保持不变,故a、c正确。由于未标明
v
(I
-
)和
v
(As
)的方向,所以b错误。d项,
c
(I
-
)=2
c
(As
)=2
y
mol·L
-1
时才可说明反应达平衡状态。
(2)
t
m
时,反应尚未达到平衡,且反应正向进行,故
v
正
>
v
逆
。
(3)随着反应正向进行,生成物浓度逐渐增大,故
v
逆
逐渐增大,则
t
m
时
v
逆
小于
t
n
时
v
逆
。
(4)根据题给信息,原溶液混合后体积扩大为原来的3倍,故
c
(As
)、
c
(I
2
)均为
x
mol·L
-1
。根据三段式:
As
(aq)+I
2
(aq)+2OH
-
(aq)
As
(aq)+2I
-
(aq)+H
2
O(l)
c
始
/mol·L
-1
x
x
0 0
c
转
/mol·L
-1
y
y
y
2
y
c
平
/mol·L
-1
x
-
y
x
-
y
y
2
y
再结合pH=14,代入平衡常数表达式得:
K
=
=
(mol·L
-1
)
-1
。
归纳总结
判断化学平衡状态的方法——“逆向相等,变量不变”
题组二 化学平衡的移动
4.
(2018天津理综,5,6分)室温下,向圆底烧瓶中加入1 mol C
2
H
5
OH
和含1 mol HBr的氢溴酸,溶液中发生反应:C
2
H
5
OH+HBr
C
2
H
5
Br+H
2
O,充分反应后达到平衡。已知常压下,C
2
H
5
Br和C
2
H
5
OH的
沸点分别为38.4 ℃和78.5 ℃。下列有关叙述
错误
的是
( )
A.加入NaOH,可增大乙醇的物质的量
B.增大HBr浓度,有利于生成C
2
H
5
Br
C.若反应物均增大至2 mol,则两种反应物平衡转化率之比不变
D.若起始温度提高至60 ℃,可缩短反应达到平衡的时间
答案
D 本题考查化学平衡的影响因素。加入NaOH会中和
HBr,平衡逆向移动,乙醇的物质的量增大,A正确;增大HBr浓度,平
衡正向移动,有利于生成C
2
H
5
Br,B正确;只要投料比符合化学计量
数之比,两种反应物平衡转化率之比始终是1∶1,C正确;若起始温
度提高至60 ℃,则反应生成的C
2
H
5
Br会被及时蒸出,反应很难建
立平衡,D错误。
5.
下图表示可逆反应A(g)+3B(g)
2C(g) Δ
H
<0达到平衡后,
改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下
列说法中正确的是
( )
A.
t
1
时降低了温度,平衡向正反应方向移动
B.
t
1
时增大了压强,平衡向正反应方向移动
C.
t
1
时增大了A的浓度,同时减小了C的浓度,平衡向正反应方向移动
D.
t
1
时可能使用了催化剂
答案
C 根据图像可知,
t
1
时刻正反应速率突然增大,达到新平
衡后正反应速率比原平衡时小,说明
t
1
时刻逆反应速率减小,不可
能是改变了温度、压强或使用了催化剂。
6.
(2018河南洛阳第一次统考)温度为
T
时在2 L密闭容器中使X(g)
与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变
化如图1所示;若保持其他条件不变,温度分别为
T
1
和
T
2
(
T
2
>
T
1
)时,Y
的体积分数与时间的关系如图2所示。则下列结论正确的是
( )
A.容器中发生的反应可表示为4X(g)+Y(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率
v
(X)=0.3 mol/(L·min)
C.升高温度,反应的化学平衡常数
K
增大
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大
压强
答案
C 根据图1可知,反应达到平衡时,X、Y分别减少了0.6
mol和0.2 mol,Z增加了0.4 mol,在反应中反应物减少,生成物增加,
且反应物减少的物质的量和生成物增加的物质的量之比等于化
学计量数之比,所以该反应的化学方程式为3X(g)+Y(g)
2Z
(g),A项错误;根据
v
=
可计算出反应速率
v
(X)=
=0.1
mol/(L·min),B项错误;根据图2可知,
T
2
>
T
1
,当升高温度时,Y的体积
分数减小,则平衡正向移动,所以平衡常数增大,C项正确;比较图1
和图3可知,图3时平衡没有移动,但反应速率加快,由于该反应是
体积减小的反应,增大压强,平衡会正向移动,故改变的条件应为
使用催化剂,D项错误。
归纳总结
分析条件改变对化学平衡影响的思维模式
考点三 化学平衡常数及相关计算
1.
化学平衡常数的应用
(1)判断可逆反应进行程度的大小
(2)判断可逆反应是否平衡及不平衡时反应进行的方向
对于可逆反应
m
A(g)+
n
B(g)
p
C(g)+
q
D(g),在一定温度下的任
意时刻:
Q
c
=
(3)判断反应的热效应
(4)计算反应物的转化率
依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起
始浓度),从而计算反应物的转化率。
答案
(1)越大 越大 越小 越小 (2)< = >
(3)吸热 放热 放热 吸热
2.
正误判断,正确的划“√”,错误的划“
✕
”。
(1)化学平衡发生移动,化学平衡常数一定改变
( )
(2)其他条件不变,使用不同的催化剂,反应的平衡常数不变
( )
(3)反应A(g)+3B(g)
2C(g)达平衡后,温度不变,增大压强,平衡
正向移动,平衡常数
K
值增大
( )
(4)H
2
(g)+I
2
(g)
2HI(g)平衡常数为
K
1
,HI(g)
H
2
(g)+
I
2
(g)
平衡常数为
K
2
,则
K
1
·
K
2
=1
( )
(5)化学平衡常数只受温度影响,与反应物或生成物的浓度变化无
关;温度越高,化学平衡常数越大
( )
(6)
K
=
,温度升高,
K
增大,则CO
2
(g)+H
2
(g)
CO(g)+
H
2
O(g) Δ
H
>0
( )
答案
(1)
✕
(2)√ (3)
✕
(4)
✕
(5)
✕
(6)
✕
题组一 化学平衡常数的计算及应用
1.
(2018湖南郴州第一次质量检测)一定条件下,CO
2
(g)+3H
2
(g)
H
2
O(g)+CH
3
OH(g) Δ
H
=-53.7 kJ·mol
-1
;向2 L恒容恒温密闭
容器中充入1 mol CO
2
和2.8 mol H
2
反应,图中过程Ⅰ、Ⅱ是在两
种不同催化剂作用下建立平衡的过程中CO
2
的转化率[
α
(CO
2
)]随
时间(
t
)的变化曲线。下列说法中不正确的是
( )
A.
m
点:
v
(正)>
v
(逆)
B.活化能:过程Ⅱ>过程Ⅰ
C.
n
点时该反应的平衡常数
K
=50
D.过程Ⅰ,
t
2
时刻改变的反应条件可能是升高温度
答案
C
m
点CO
2
的转化率不是最大,反应向正反应方向进行,因
此
v
(正)>
v
(逆),A项正确;过程Ⅰ首先达到平衡状态,说明反应速率
快,因此活化能:过程Ⅱ>过程Ⅰ,B项正确;
n
点时CO
2
的转化率是8
0%,则根据方程式可知
CO
2
(g)+3H
2
(g)
H
2
O(g)+CH
3
OH(g)
起始浓度(mol·L
-1
) 0.5 1.4 0 0
转化浓度(mol·L
-1
) 0.4 1.2 0.4 0.4
平衡浓度(mol·L
-1
) 0.1 0.2 0.4 0.4
所以该反应的平衡常数
K
=
=200,C项错误;过程Ⅰ,
t
2
时刻
CO
2
的转化率降低,说明反应向逆反应方向进行,由于正反应放热,
因此改变的反应条件可能是升高温度,D项正确。
2.
(2018山东烟台自主练习)已知NO和O
2
经反应①和反应②转化
为NO
2
,其能量变化随反应过程的图示如下。
①2NO(g)
N
2
O
2
(g) Δ
H
1
,平衡常数
K
1
②N
2
O
2
(g)+O
2
(g)
2NO
2
(g) Δ
H
2
,平衡常数
K
2
下列说法中不正确的是 ( )
A.ΔH1<0,ΔH2<0
B.2NO(g)+O
2
(g)
2NO
2
(g)的平衡常数
K
=
K
1
/
K
2
C.表示2NO(g)+O
2
(g)
2NO
2
(g)的Δ
H
=Δ
H
1
+Δ
H
2
D.反应②的速率大小决定2NO(g)+O
2
(g)
2NO
2
(g)的反应速率
答案
B 由题图可知反应①和反应②的反应物总能量高于生
成物总能量,所以Δ
H
1
<0,Δ
H
2
<0,A项正确;反应①+反应②得2NO
(g)+O
2
(g)
2NO
2
(g),所以
K
=
K
1
×
K
2
,B项错误;反应①+反应②得2
NO(g)+O
2
(g)
2NO
2
(g),所以Δ
H
=Δ
H
1
+Δ
H
2
,C项正确;反应速率
主要取决于慢反应的反应速率,反应②的活化能大于反应①,所以
反应②的反应速率小于反应①,故反应②的速率大小决定2NO(g)
+O
2
(g)
2NO
2
(g)的反应速率,D项正确。
3.
(2018江西百所名校第一次联考)已知反应2NO(g)+2H
2
(g)
N
2
(g)+2H
2
O(g)生成N
2
的初始速率与NO、H
2
的初始浓度的关系为
v
=
kc
x
(NO)·
c
y
(H
2
),
k
为速率常数。在800 ℃时测得的相关数据如下
表所示。
实验
数据
初始浓度
生成N
2
的初始
速率/mol·L
-1
·s
-1
c
(NO)/mol·L
-1
c
(H
2
)/mol·L
-1
1
2.00
×
10
-3
6.00
×
10
-3
1.92
×
10
-3
2
1.00
×
10
-3
6.00
×
10
-3
4.80
×
10
-4
3
2.00
×
10
-3
3.00
×
10
-3
9.60
×
10
-4
下列说法中不正确的是
( )
A.关系式中
x
=1、
y
=2
B.800 ℃时,
k
的值为8
×
10
4
C.若800 ℃时,初始浓度
c
(NO)=
c
(H
2
)=4.00
×
10
-3
mol·L
-1
,则生成N
2
的初始速率为5.12
×
10
-3
mol·L
-1
·s
-1
D.当其他条件不变时,升高温度,速率常数将增大
答案
A 由实验数据1和2可知,
c
(H
2
)不变,
c
(NO)扩大1倍,反应
速率扩大为原来的
=4倍,则
x
=2,由实验数据1和3可知,
c
(NO)不变,
c
(H
2
)扩大1倍,反应速率扩大为原来的
=2倍,则
y
=1,A项错误;根据数据1可知800 ℃时,
k
的值为
=
=8
×
10
4
,B项正确;若800 ℃时,初始浓度
c
(NO)=
c
(H
2
)=4.00
×
10
-3
mol·L
-1
,则生成N
2
的初始速率
v
=
k
×
c
2
(NO)
×
c
(H
2
)=[8
×
10
4
×
(4.00
×
10
-3
)
2
×
(4.00
×
10
-3
)] mol·L
-1
·s
-1
=5.12
×
10
-3
mol
-1
·L
-1
·s
-1
,C项正确;温度升高,反应速率加快,则当浓度和其他条件不变
时,升高温度,速率常数一定是增大的,D项正确。
归纳总结
化学平衡常数的应用
(1)化学平衡常数只与温度有关,与反应物或生成物的浓度无关。
(2)化学平衡常数表示反应进行的程度,不表示反应的快慢,即化
学反应速率快,
K
值不一定大。
(3)关系
反应①,平衡常数为
K
1
反应②,平衡常数为
K
2
a.若反应③与反应①互为逆反应,则
K
3
=
b.若反应④=反应①×2,则
K
4
=
c.若反应⑤=反应①+反应②,则
K
5
=
K
1
×
K
2
d.若反应⑥=反应①-反应②,则
K
6
=
题组二 转化率的计算
4.
(2018湖北黄冈调研)已知反应:CH
2
CHCH
3
(g)+Cl
2
(g)
CH
2
CHCH
2
Cl(g)+HCl(g)。在一定压强下,按
ω
=
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分
数(
φ
)与温度(
T
)、
ω
的关系,图乙表示逆反应的平衡常数与温度的
关系。则下列说法中错误的是
( )
A.图甲中,
ω
2
>1
B.图乙中,A线表示逆反应的平衡常数
C.温度为
T
1
、
ω
=2时,Cl
2
的转化率为50%
D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体
压强将增大
答案
C 根据图甲中信息可知,增大
n
(Cl
2
),
ω
增大,平衡正向移
动,丙烯的体积分数(
φ
)减小,故
ω
2
>1,A项正确;根据图甲可知,升高
温度,丙烯的体积分数增大,说明平衡逆向移动,逆反应为吸热反
应,正反应为放热反应,则升高温度,正反应的平衡常数减小,逆反
应的平衡常数增大,图乙中,A线表示逆反应的平衡常数,B项正确;
由图乙知,温度为
T
1
时,正、逆反应的平衡常数相等,又因两者互为
倒数,则平衡常数
K
=1,
ω
=2时,设CH
2
CHCH
3
和Cl
2
的物质的量分
别为
a
、2
a
,参加反应的Cl
2
的物质的量为
b
,利用三段式可列关系
式
=1,解得
=
,则Cl
2
的转化率为33.3%,C项错误;该
反应为反应前后气体体积不变的放热反应,反应向正反应方向进
行,体系温度升高,气体膨胀,达到平衡时,装置内的气体压强将增
大,D项正确。
5.
(2017课标Ⅰ,28节选)H
2
S与CO
2
在高温下发生反应:H
2
S(g)+CO
2
(g)
COS(g)+H
2
O(g)。在610 K时,将0.10 mol CO
2
与0.40 mol
H
2
S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H
2
S的平衡转化率
α
1
=
%,反应平衡常数
K
=
。
(2)在620 K重复实验,平衡后水的物质的量分数为0.03,H
2
S的转化
率
α
2
α
1
,该反应的Δ
H
0。(填“>”“<”或“=”)
(3)向反应器中再分别充入下列气体,能使H
2
S转化率增大的是
(填标号)。
A.H
2
S B.CO
2
C.COS D.N
2
答案
(1)2.5 2.8
×
10
-3
(2)> > (3)B
解析
(1)反应前后气体体积不变,则平衡后水的物质的量为(0.10
mol+0.40 mol)
×
0.02=0.01 mol,利用三段式:
H
2
S(g) + CO
2
(g)
COS(g) + H
2
O(g)
起始 0.40 mol 0.10 mol 0 0
转化 0.01 mol 0.01 mol 0.01 mol 0.01 mol
平衡 0.39 mol 0.09 mol 0.01 mol 0.01 mol
则H
2
S的平衡转化率
α
1
=
×
100%=2.5%。
平衡常数
K
=
≈
2.8
×
10
-3
。
(2)由610 K到620 K,水的物质的量分数增大,说明平衡正向移动,
则H
2
S的转化率增大,正反应吸热,Δ
H
>0。
(3)A项,再充入H
2
S,H
2
S转化率会减小,错误;B项,再充入CO
2
,平衡
正向移动,H
2
S转化率增大,正确;C项,充入COS,平衡逆向移动,H
2
S
转化率减小,错误;D项,充入N
2
,平衡不移动,H
2
S转化率不变,错
误。
6.
(2016课标Ⅰ,27节选)Cr
和Cr
2
在溶液中可相互转化。室
温下,初始浓度为1.0 mol·L
-1
的Na
2
CrO
4
溶液中
c
(Cr
2
)随
c
(H
+
)的
变化如图所示。
(1)用离子方程式表示Na
2
CrO
4
溶液中的转化反应
。
(2)由图可知,溶液酸性增大,Cr
的平衡转化率
(填“增
大”“减小”或“不变”)。根据A点数据,计算出该转化反应的
平衡常数为
。
(3)升高温度,溶液中Cr
的平衡转化率减小,则该反应的Δ
H
0(填“大于”“小于”或“等于”)。
解析
(1)Na
2
CrO
4
溶液中的转化反应为2Cr
+2H
+
Cr
2
+H
2
O。(2)酸性增大,平衡右移,Cr
的平衡转化率增大。由题图知,
A点
c
(Cr
2
)=0.25 mol·L
-1
,
c
(Cr
)=(1.0-0.25
×
2)mol·L
-1
=0.5 mol·L
-1
,
c
(H
+
)=1.0
×
10
-7
mol·L
-1
,则平衡常数
K
=
=
=1.0
×
10
14
。(3)升温,Cr
的平衡转化率减小,说明
平衡左移,即正反应为放热反应,Δ
H
<0。
答案
(1)2Cr
+2H
+
Cr
2
+H
2
O
(2)增大 1.0
×
10
14
(
3
)小于
归纳总结
化学平衡计算的思维模式
(1)解题步骤
①写出有关化学平衡的化学方程式。
②确定各物质的起始量、转化量、平衡量。
③根据已知条件列方程式进行相关计算。
(2)解题模式——“三段式思维法”
如反应
m
A(g)+
n
B(g)
p
C(g)+
q
D(g),令A、B的起始物质的量
分别为
a
mol、
b
mol,达到平衡后,A的消耗量为
mx
mol,容器容积
为
V
L。
m
A(g) +
n
B(g)
p
C(g) +
q
D(g)
n
始
/mol
a
b
0 0
n
转
/mol
mx
nx
px
qx
n
平
/mol
a
-
mx
b
-
nx
px
qx
则有:
①
K
=
②
c
平
(A)=
mol·L
-1
③
α
(A)=
×100%,
α
(A)∶
α
(B)=
∶
=
mb
∶
na
④
φ
(A)=
×100%
⑤
=
⑥
=
g·L
-1
⑦
=
g·mol
-1
热点题型突破4 有关化学反应速率和化学平衡的图像
以化学反应速率与化学平衡图像为载体考查化学平衡的相
关知识是历年课标高考的压轴题型, 题目难度一般较大,所占分
值较高。此类试题常以图像的形式给出部分条件,主要考查化学
反应速率的定量计算、外界条件对化学反应速率及化学平衡的
影响、化学平衡常数的计算及应用、转化率的计算等。
①343 K时反应的平衡转化率
α
=
%。平衡常数
K
343 K
=
(保留2位小数)。
典例
(2018课标Ⅲ,28节选)对于反应2SiHCl
3
(g)
SiH
2
Cl
2
(g)+
SiCl
4
(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343
K时SiHCl
3
的转化率随时间变化的结果如图所示。
;要缩短反应达到平衡的时间,可采取的措施有
、
。
③比较a、b处反应速率大小:
v
a
v
b
(填“大于”“小于”
或“等于”)。反应速率
v
=
v
正
-
v
逆
=
k
正
-
k
逆
,
k
正
、
k
逆
分
别为正、逆向反应速率常数,
x
为物质的量分数,计算a处的
=
(保留1位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是
破题关键
(1)利用“三段式”列出起始量、转化量、平衡量。
(2)明确反应的特点,分析温度、压强对化学平衡的影响。
(3)③根据已知表达式表示出v正和v逆,利用达到化学平衡时v正=v逆
计算出
,然后结合“三段式”即可求出
。
答案
①22 0.02
②及时移去产物 改进催化剂 提高反应物压强(浓度)
③大于 1.3
解析
①反应2SiHCl
3
(g)
SiH
2
Cl
2
(g)+SiCl
4
(g) Δ
H
1
=48 kJ·
mol
-1
,由于Δ
H
1
>0,升高温度,化学平衡正向移动,SiHCl
3
的转化率增
大,故曲线a表示343 K,观察图像知,343 K时反应的平衡转化率为
22%;设起始时SiHCl
3
的物质的量浓度为
c
,列出“三段式”:
2SiHCl
3
(g)
SiH
2
Cl
2
(g)+SiCl
4
(g)
起始
c
0 0
变化 0.22
c
0.11
c
0.11
c
平衡 0.78
c
0.11
c
0.11
c
故
K
343 K
=
=
≈
0.02。
②已知2SiHCl
3
(g)
SiH
2
Cl
2
(g)+SiCl
4
(g) Δ
H
1
=48 kJ· mol
-1
,该
反应的正反应是气体体积不变的吸热反应,故要在温度不变的情
况下提高SiHCl
3
转化率可采取的措施是及时移去产物;要缩短反
应达到平衡的时间,可采取的措施有提高反应物压强(浓度)和改
进催化剂等。
③a、b处SiHCl
3
的转化率相等,但a处温度比b处高,故
v
a
大于
v
b
;依
据题意知
v
正
=
k
正
,
v
逆
=
k
逆
,由平衡时
v
正
=
v
逆
知,
=
=0.02,对于a处,列出“三段式”计算知,
=0.8,
=0.1,
=0.1,故a处
=
=
≈
1.3。
解题必备
化学反应速率和化学平衡图像题的解题模型
1.
审题
审明各物质的状态(有无固体、液体),明确气体分子数的变化(变
大、变小、不变),正反应是吸热还是放热。
2.
析题——找准解题的突破口
看图像
→
3.
解题——掌握分析的方法
(1)三步分析法:一看反应速率是增大还是减小;二看
v
(正)、
v
(逆)
的相对大小;三看化学平衡移动的方向。
(2)先拐先平数值大:在含量(转化率)—时间曲线中,先出现拐点的
曲线先达到平衡,说明该曲线对应的反应速率快,表示温度较高、
有催化剂或压强较大等。
(3)定一议二:当图像中有三个量时,先确定一个量不变,再讨论另
外两个量的关系,有时还需要做辅助线。
(4)想规律做判断:联想化学反应速率影响因素、化学平衡移动规
律,将图像与原理结合,对照得出结论。
4.
检查——正确解题的保证。
最后要对照试题进行检查,避免失误。
1.
(2018湖北鄂东南市级示范高中联盟学校联考)向某密闭容器中
加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下
发生反应,各物质浓度随时间变化如甲图所示[
t
0
~
t
1
阶段
c
(B)未画
出]。乙图为
t
2
时刻后改变条件平衡体系中反应速率随时间变化
的情况,且四个阶段都各改变一种不同的条件。已知,
t
3
~
t
4
阶段使
用催化剂。下列说法中不正确的是
( )
A.若
t
1
=15 min,则用C的浓度变化表示在
t
0
~
t
1
时间段的平均反应速
率为0.004 mol·L
-1
·min
-1
B.
t
4
~
t
5
阶段改变的条件一定是减小压强
C.B的起始物质的量为0.02 mol
D.
t
5
~
t
6
阶段,容器内A的物质的量减少了0.03 mol,而此过程中容器
与外界的热交换总量为
a
kJ,该反应的热化学方程式为3A(g)
B(g)+2C(g) Δ
H
=+100
a
kJ·mol
-1
答案
C 若
t
1
=15 min,生成物C在
t
0
~
t
1
时间段的平均反应速率
v
=
=
=0.004 mol·L
-1
·min
-1
,A项正确。
t
4
~
t
5
阶段改变条件,正、逆反应速率都减小且相等,所以改变的条件应
为减小压强,B项正确。反应中A的浓度变化为0.15 mol·L
-1
-0.06
mol·L
-1
=0.09 mol·L
-1
,C的浓度变化为0.11 mol·L
-1
-0.05 mol·L
-1
=0.06
mol·L
-1
,反应中A与C的化学计量数之比为0.09∶0.06=3∶2,根据
t
4
~
t
5
阶段改变压强平衡不移动可知,该反应的化学方程式为3A(g)
B(g)+2C(g),由A的起始物质的量为0.3 mol和起始浓度为0.1
5 mol·L
-1
可知,容器的容积
V
=
=2 L;由反应的化学方程
式可知B的起始浓度为0.05 mol·L
-1
-(0.11 mol·L
-1
-0.05 mol·L
-1
)/2=
0.02 mol·L
-1
,所以B的起始物质的量为0.02 mol·L
-1
×
2 L=0.04 mol,C
项错误。A的物质的量减少0.03 mol,此过程中容器与外界的热交
换总量为
a
kJ,则A的物质的量减少3 mol,与外界的热交换总量为
100
a
kJ,根据图像可知
t
5
~
t
6
阶段改变的条件应为升高温度,A的物
质的量减少,说明反应向正反应方向移动,则正反应为吸热反应,
故该反应的热化学方程式为3A(g)
B(g)+2C(g) Δ
H
=+100
a
kJ·mol
-1
,D项正确。
2.
(2016四川理综,6,3分)一定条件下,CH
4
与H
2
O(g)发生反应:CH
4
(g)+H
2
O(g)
CO(g)+3H
2
(g)。设起始
=
Z
,在恒压下,平衡
时CH
4
的体积分数
φ
(CH
4
)与
Z
和
T
(温度)的关系如图所示。下列说
法正确的是
( )
A.该反应的焓变Δ
H
>0
B.图中
Z
的大小为
a
>3>
b
C.图中X点对应的平衡混合物中
=3
D.温度不变时,图中X点对应的平衡在加压后
φ
(CH
4
)减小
答案
A A项,根据图像可知,
Z
相同时,温度升高,
φ
(CH
4
)减小,说
明平衡右移,则正反应是吸热反应,该反应的焓变Δ
H
>0,故正确;B
项,温度一定时,
Z
增大,平衡右移,
φ
(CH
4
)减小,则
a
<3<
b
,故错误;C
项,X点对应的起始混合物中
=3,由于反应时消耗
n
(H
2
O)∶
n
(CH
4
)=1∶1,则平衡时
>3,故错误;D项,加压后X点对应的
平衡左移,
φ
(CH
4
)增大,故错误。
3.
(2018江西南昌一模)二氧化碳催化加氢合成低碳烯烃是目前研
究的热门课题。在一个1 L密闭恒容容器中分别投入1.5 mol CO
2
、5.0 mol H
2
,发生反应:2CO
2
(g)+6H
2
(g)
C
2
H
4
(g)+4H
2
O(g) Δ
H
;在不同温度下,用传感技术测出平衡时H
2
的物质的量变化关系
如图所示。
(1)该反应的Δ
H
0(填“>”“<”或“=”);
(2)在
T
A
温度下的平衡常数
K
=
;
(3)提高CO
2
的平衡转化率,除改变温度外,还可采取的措施是:
;
(4)在
T
A
温度下,其他条件不变,起始时若按1 mol CO
2
、2 mol H
2
、
1 mol C
2
H
4
、2 mol H
2
O进行投料,此时
v
(正)
v
(逆)(填
“>”“<”或“=”)。
答案
(1)< (2)0.5 (3)增大压强或增大H
2
浓度 (4)>
解析
(1)
根据图像
,
升高温度
,
平衡时氢气物质的量增加
,
平衡逆
向移动
,
正反应放热
,
则
ΔH<0
。
(2) 2CO
2
(g)+6H
2
(g)
C
2
H
4
(g)+4H
2
O(g)
开始(mol·L
-1
) 1.5 5 0 0
转化(mol·L
-1
) 1 3 0.5 2
平衡(mol·L
-1
) 0.5 2 0.5 2
K
=
=
=0.5。
(3)增大压强或增大H
2
浓度,可以使平衡正向移动,CO
2
的平衡转化
率增大。
(4)在
T
A
温度下,其他条件不变,起始时若按1 mol CO
2
、2 mol H
2
、
1 mol C
2
H
4
、2 mol H
2
O进行投料,
Q
c
=
=0.25<
K
,所以反应正
向进行,
v
(正)>
v
(逆)。
1.(
2018课标Ⅰ,28,15分)采用N
2
O
5
为硝化剂是一种新型的绿色硝
化技术,在含能材料、医药等工业中得到广泛应用。回答下列问
题:
(1)1840年Devil用干燥的氯气通过干燥的硝酸银,得到N
2
O
5
。该
反应的氧化产物是一种气体,其分子式为
。
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25 ℃时N
2
O
5
(g)分解反应:
2N
2
O
5
(g)
4NO
2
(g)+O
2
(g)
2N
2
O
4
(g)
其中NO
2
二聚为N
2
O
4
的反应可以迅速达到平衡。体系的总压强
p
随时间
t
的变化如下表所示[
t
=
∞
时,N
2
O
5
(g)完全分解]:
0
40
80
160
260
1 300
1 700
∞
p
/kPa
35.8
40.3
42.5
45.9
49.2
61.2
62.3
63.1
①已知:2N
2
O
5
(g)
2N
2
O
4
(g)+O
2
(g) Δ
H
1
=-4.4 kJ·mol
-1
2NO
2
(g)
N
2
O
4
(g) Δ
H
2
=-55.3 kJ·mol
-1
则反应N
2
O
5
(g)
2NO
2
(g)+
O
2
(g)的Δ
H
=
kJ·mol
-1
。
②研究表明,N
2
O
5
(g)分解的反应速率
v
=2
×
10
-3
×
(kPa·min
-1
)。
t
=62 min时,测得体系中
=2.9 kPa,则此时的
=
kPa,
v
=
kPa·min
-1
。
③若提高反应温度至35 ℃,则N
2
O
5
(g)完全分解后体系压强
p
∞
(35
℃)
63.1 kPa(填“大于”“等于”或“小于”),原因是
。
④25 ℃时N
2
O
4
(g)
2NO
2
(g)反应的平衡常数
K
p
=
kPa(
K
p
为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N
2
O
5
(g)
4NO
2
(g)+O
2
(g),R.A.Ogg提出如下反应
历程:
第一步 N
2
O
5
NO
2
+NO
3
快速平衡
第二步 NO
2
+NO
3
NO+NO
2
+O
2
慢反应
第三步 NO+NO
3
2NO
2
快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正
确的是
(填标号)。
A.
v
(第一步的逆反应)>
v
(第二步反应)
B.反应的中间产物只有NO
3
C.第二步中NO
2
与NO
3
的碰撞仅部分有效
D.第三步反应活化能较高
答案
(1)O
2
(2)①53.1 ②30.0 6.0
×
10
-2
③大于 温度提高,
体积不变,总压强提高;NO
2
二聚为放热反应,温度提高,平衡左移,
体系物质的量增加,总压强提高 ④13.4
(3)AC
解析
本题考查氧化还原反应、反应热的计算、化学反应速
率、化学平衡及化学平衡常数的计算。
(1)
氯气具有强氧化性
,
氮元素化合价不变
,Ag
应以
AgCl
形式存在
,
则被氧化的是氧元素
,
对应的氧化产物为
O2,
反应的化学方程式为
4AgNO
3
+2Cl
2
4AgCl+2N
2
O
5
+O
2
。
(2)①2N
2
O
5
(g)
2N
2
O
4
(g)+O
2
(g) Δ
H
1
=-4.4 kJ·mol
-1
a
2NO
2
(g)
N
2
O
4
(g) Δ
H
2
=-55.3 kJ·mol
-1
b
根据盖斯定律,由
-b可得:N
2
O
5
(g)
2NO
2
(g)+
O
2
(g) Δ
H
=53.
1 kJ·mol
-1
。
②由2N
2
O
5
(g)~O
2
(g)可知,
=2.9 kPa时N
2
O
5
分压减小5.8 kPa,此
时
=(35.8-5.8)kPa=30.0 kPa。
v
=2
×
10
-3
×
(kPa·min
-1
)=2
×
10
-3
×
30(kPa·min
-1
)=6.0
×
10
-2
kPa·mol
-1
。
④
t
=
∞
时,N
2
O
5
完全分解。
2N
2
O
5
2N
2
O
4
+O
2
2 2 1
35.8 kPa
=35.8 kPa
=17.9 kPa
设达平衡时,N
2
O
4
分压减小了
x
kPa。
N
2
O
4
2NO
2
开始分压(kPa) 35.8 0
变化分压(kPa)
x
2
x
平衡分压(kPa) 35.8-
x
2
x
(35.8-
x
)kPa+2
x
kPa+17.9 kPa=63.1 kPa,解得
x
=9.4,则平衡时
=
26.4 kPa,
=18.8 kPa,
K
=
kPa
≈
13.4 kPa。
(3)第一步反应为快反应,其逆反应的速率也比第二步反应的速率
快,A正确;从反应方程式看,中间产物有NO
3
、NO,B错误;由于第
二步反应是慢反应,说明NO
2
与NO
3
的碰撞仅部分有效,C正确;第
三步是快反应,故其活化能应较低,D错误。
2.
(2018课标Ⅱ,27,14分)CH
4
-CO
2
催化重整不仅可以得到合成气
(CO和H
2
),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH
4
-CO
2
催化重整反应为:CH
4
(g)+CO
2
(g)
2CO(g)+2H
2
(g)。
已知:C(s)+2H
2
(g)
CH
4
(g) Δ
H
=-75 kJ·mol
-1
C(s)+O
2
(g)
CO
2
(g) Δ
H
=-394 kJ·mol
-1
C(s)+
O
2
(g)
CO(g) Δ
H
=-111 kJ·mol
-1
该催化重整反应的Δ
H
=
kJ·mol
-1
。有利于提高CH
4
平衡
转化率的条件是
(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH
4
、1 mol CO
2
以及
催化剂进行重整反应,达到平衡时CO
2
的转化率是50%,其平衡常
数为
mol
2
·L
-2
。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应
则使积碳量减少。相关数据如下表:
①由上表判断,催化剂X
Y(填“优于”或“劣于”),理
由是
。在反应进料气组成、压强及反应时间相同的情况下,某催
化剂表面的积碳量随温度的变化关系如下图所示。升高温度时,
下列关于积碳反应、消碳反应的平衡常数(
K
)和速率(
v
)的叙述正
确的是
(填标号)。
A.
K
积
、
K
消
均增加
B.
v
积
减小、
v
消
增加
C.
K
积
减小、
K
消
增加
D.
v
消
增加的倍数比
v
积
增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为
v
=
k
·
p
(CH
4
)·[
p
(CO
2
)]
-0.5
(
k
为速率常数)。在
p
(CH
4
)一定时,不同
p
(CO
2
)下
积碳量随时间的变化趋势如下图所示,则
p
a
(CO
2
)、
p
b
(CO
2
)、
p
c
(CO
2
)从大到小的顺序为
。
答案
(1)247 A
(2)①劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳
反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD
②
p
c
(CO
2
)、
p
b
(CO
2
)、
p
a
(CO
2
)
解析
本题考查盖斯定律的应用,化学反应速率与化学平衡常
数。
(1)C(s)+2H
2
(g)
CH
4
(g) Δ
H
=-75 kJ·mol
-1
①
C(s)+O
2
(g)
CO
2
(g) Δ
H
=-394 kJ·mol
-1
②
C(s)+
O
2
(g)
CO(g) Δ
H
=-111 kJ·mol
-1
③
运用盖斯定律,③
×
2-①-②可得CH
4
(g)+CO
2
(g)
2CO(g)+2H
2
(g) Δ
H
=[(-111
×
2)-(-75)-(-394)] kJ·mol
-1
=247 kJ·mol
-1
。正反应为
气体体积增大的吸热反应,故升温、减压有利于平衡正向移动,提
高CH
4
的平衡转化率,A正确。列三段式:
CH
4
(g) + CO
2
(g)
2CO(g)+2H
2
(g)
始 2 mol 1 mol 0 mol 0 mol
转 0.5 mol 0.5 mol 1 mol 1 mol
平 1.5 mol 0.5 mol 1 mol 1 mol
K
=
=
=
mol
2
·L
-2
。
(2)①积碳反应与消碳反应均为吸热反应,升高温度时,
K
积
、
K
消
均
增加;由图像可知600 ℃以后积碳量减小,说明升高温度,
v
消
增加的
倍数比
v
积
增加的倍数大,故A、D正确。
②由图像可知,时间相同时积碳量a>b>c,说明积碳速率a>b>c,由
v
=
k
·
p
(CH
4
)·[
p
(CO
2
)]
-0.5
可知,
p
(CH
4
)一定时,积碳速率与
p
(CO
2
)成反
比,故
p
a
(CO
2
)<
p
b
(CO
2
)<
p
c
(CO
2
)。