- 4.30 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
8
讲
电化学原理与应用
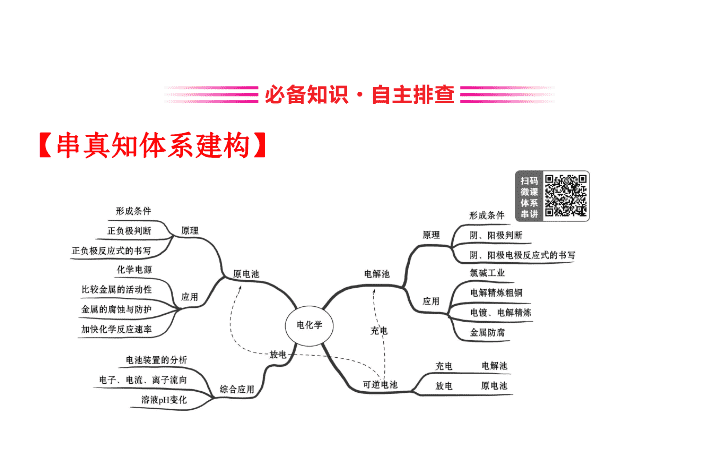
【
串真知体系建构
】
【
研核心思维激活
】
【
研习任务
1】
把反应
Zn+Cu
2+
====Zn
2+
+Cu
设计成盐桥电池。
(1)
画出装置图、标明电极名称和电子转移方向。
提示
:
(2)
写出电极反应式并指明反应类型。
提示
:
负极
:Zn-2e
-
====Zn
2+
氧化反应
正极
:Cu
2+
+2e
-
====Cu
还原反应
(3)
盐桥的组成和作用是什么
?
盐桥内离子移动方向如
何
?
提示
:
盐桥中装有饱和的
KCl
、
KNO
3
等溶液和琼胶制成
的胶冻。盐桥的作用
:
连接内电路
,
形成闭合回路
;
平衡
电荷
,
使原电池不断产生电流。盐桥内阳离子
(K
+
)
移向
正极
,
阴离子
(Cl
-
、
)
移向负极。
【
研习任务
2】
根据电化学的原理设计一个电化学装置
,
实现反应
Cu+2H
2
SO
4
====CuSO
4
+H
2
↑
。
(1)
画出装置图
,
标出电极名称和电极材料。
提示
:
根据金属活动顺序表
,Cu
和稀硫酸不反应
,
根据电化学的原理设计电解池
,Cu
作阳极
,C
作阴极
,
稀硫酸作电解质溶液
,
通入直流电就可以实现该反应。装置示意图如下
:
(2)
写出电极反应式并指明反应类型。
提示
:
阳极
:Cu-2e
-
====Cu
2+
氧化反应
,
阴极
:2H
+
+2e
-
====H
2
↑
还原反应。
【
研习任务
3】
用
2
种电化学方法模拟防止海水中铁生锈
,
分别画出装置示意图
(
标明电极材料和电极名称
),
写出相应电极反应式并指明所用防护方法的名称。
提示
:
(1)
方法
1:
根据原电池原理
,
若用比铁活泼的金属
Zn
等作原电池的负极、铁作原电池的正极
,
铁则被保护
,
该电化学防护法称为牺牲阳极的阴极保护法。装置示意图如下
:
电极反应式如下
:
负极
:Zn-2e
-
====Zn
2+
,
正极
:O
2
+4e
-
+2H
2
O====4OH
-
。
(2)
方法
2:
根据电解原理
,
把铁电极连接直流电源的负极
,
则阴极被保护
,
该电化学防护法为外加电流的阴极保护法。装置示意图如下
:
电极反应式如下
:
阳极
:4OH
-
-4e
-
====2H
2
O+O
2
↑,
阴极
:2H
+
+2e
-
====H
2
↑
。
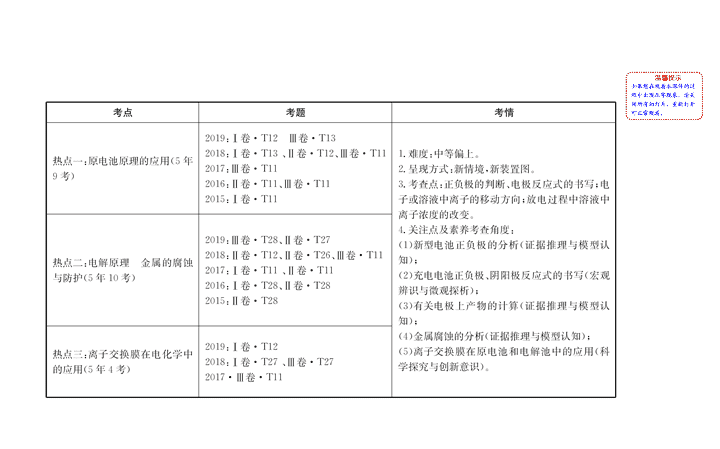
热点一 原电池原理的应用
【
研典例探究升华
】
角度一
:
新型化学电源
【
典例
1】
(2019·
天津高考
)
我国科学家研制了一种新型的高比能量锌
-
碘溴液流电池
,
其工作原理示意图如下。图
中贮液器可储存电解质溶液
,
提高电池的容量。下列叙述不正确的是
(
)
﹒
﹒
﹒
A.
放电时
,a
电极反应为
I
2
Br
-
+2e
-
====2I
-
+Br
-
B.
放电时
,
溶液中离子的数目增大
C.
充电时
,b
电极每增重
0.65 g,
溶液中有
0.02 mol
I
-
被氧化
D.
充电时
,a
电极接外电源负极
【
解析
】
选
D
。
Zn
2+
移向左侧
,a
极是正极
,
充电时
,
接外
电源的正极
,
放电时电极反应式为
I
2
Br
-
+2e
-
====2I
-
+Br
-
,
A
正确、
D
错误
;
放电时
,
负极
Zn-2e
-
====Zn
2+
,
负极、正
极的离子数目都增多
,B
正确
;
充电时
,b
极的电极反
应式为
Zn
2+
+2e
-
====Zn,
每增重
0.65 g,
转移电子
0.02 mol,
则有
0.02 mol I
-
被氧化
,C
正确。
【
题后反思
】
四步解决新型化学电源问题
角度二
:
可充电电池
【
典例
2】
(2019·
全国卷
Ⅲ)
为提升电池循环效率和稳
定性
,
科学家近期利用三维多孔海绵状
Zn(3D-Zn)
可以
高效沉积
ZnO
的特点
,
设计了采用强碱性电解质的
3D-Zn-NiOOH
二次电池
,
结构如下图所示。电池反应为
Zn(s)+2NiOOH(s)+H
2
O(l) ZnO(s)+2Ni(OH)
2
(s)
。
下列说法错误的是
(
)
A.
三维多孔海绵状
Zn
具有较高的表面积
,
所沉积的
ZnO
分散度高
B.
充电时阳极反应为
Ni(OH)
2
(s)+OH
-
(aq)-e
-
==== NiOOH(s)+H
2
O(l)
C.
放电时负极反应为
Zn(s)+2OH
-
(aq)-2e
-
==== ZnO(s)+H
2
O(l)
D.
放电过程中
OH
-
通过隔膜从负极区移向正极区
【
解析
】
选
D
。
Zn
作负极被氧化生成
ZnO,
三维多孔海绵
状
Zn
具有较高的表面积
,
沉积的
ZnO
分散度高
,A
正确。
充电时阳极发生氧化反应
,
根据电池反应的充电过程可
知
,
阳极反应为
Ni(OH)
2
(s)+OH
-
(aq)-e
-
====NiOOH(s)
+H
2
O(l),B
正确。放电时负极发生氧化反应
,
根据电池
反应的放电过程可知
,
负极反应为
Zn(s)+2OH
-
(aq)-2e
-
====ZnO(s)+H
2
O(l),C
正确。放电时
,
电池内部
阳离子由负极移向正极
,
阴离子由正极移向负极
,D
错误。
【
题后反思
】
可逆电池的解题思路
角度三
:
燃料电池
【
典例
3】
(2019·
全国卷
Ⅰ)
利用生物燃料电池原理研究室温下氨的合成
,
电池工作时
MV
2+
/MV
+
在电极与酶之间传递电子
,
示意图如下所示。下列说法错误的是
(
)
A.
相比现有工业合成氨
,
该方法条件温和
,
同时还可提
供电能
B.
阴极区
,
在氢化酶作用下发生反应
H
2
+2MV
2+
====
2H
+
+2MV
+
C.
正极区
,
固氮酶为催化剂
,N
2
发生还原反应生成
NH
3
D.
电池工作时质子通过交换膜由负极区向正极区移动
【
解析
】
选
B
。相比现有工业合成氨
,
该方法选用酶作
催化剂
,
条件温和
,
同时利用
MV
+
和
MV
2+
的相互转化
,
化学
能转化为电能
,
故可提供电能
,
故
A
正确
;
左室为负极
区
,MV
+
在负极失电子发生氧化反应生成
MV
2+
,
电极反应
式为
MV
+
-e
-
====MV
2+
,
放电生成的
MV
2+
在氢化酶的作用
下与
H
2
反应生成
H
+
和
MV
+
,
反应的方程式为
H
2
+2MV
2+
2H
+
+2MV
+
,
故
B
错误
;
右室为正极区
,MV
2+
在正极得电子发
生还原反应生成
MV
+
,
电极反应式为
MV
2+
+e
-
====MV
+
,
放电生成的
MV
+
与
N
2
在固氮酶的作用下反应生成
NH
3
和
MV
2+
,
故
C
正确
;
电池工作时
,
氢离子
(
即质子
)
通过交换膜由负
极向正极移动
,
故
D
正确。
【
精整合技法指导
】
1.
新型充电电池解题策略
(1)
新型电池“放电”时正、负极的判断
(2)
新型电池“放电”时正极、负极上的电极反应式的书写
首先根据电池反应分析物质得失电子情况
,
然后再考虑电极反应生成的物质是否跟电解质溶液中的离子发生反应
;
对于较复杂的电极反应
,
可以利用总反应
-
较简单一极电极反应式
=
较复杂一极电极反应式的方法解决。
(3)
新型电池“充电”时的阴、阳极的判断
首先明确原电池放电时的正、负极
,
再根据电池充电时
,
阳极接正极、阴极接负极的原理进行分析。
(4)
新型电池充、放电时
,
电解质溶液中离子移动方向的判断
首先分清电池是放电还是充电
;
再判断正、负极或阴、阳极
,
进而可确定离子的移动方向。
2.
燃料电池的分析思路模型
3.
燃料电池中正极电极反应式的书写思路
根据燃料电池的特点
,
一般在正极上发生还原反应的物质都是
O
2
,O
2
得到电子后化合价降低
,
首先变成
O
2-
,O
2-
能否存在要看电解质环境。由于电解质溶液
(
酸碱盐
)
的不同
,
其电极反应也有所不同
,
下表为四种不同电解质环境中
,
氧气得电子后
O
2-
的存在形式
:
电解质环境
从电极反应式判
O
2-
的存在形式
酸性电解质溶液环境下
O
2
+4H
+
+4e
-
====2H
2
O
碱性电解质溶液环境下
O
2
+2H
2
O+4e
-
====4OH
-
固体电解质
(
高温下能传导
O
2-
)
环境下
O
2
+4e
-
====2O
2-
熔融碳酸盐
(
如
:
熔融
K
2
CO
3
)
环境下
O
2
+2CO
2
+4e
-
====2
【
练类题巩固拓展
】
1.(2018·
全国卷
Ⅲ)
一种可充电锂
-
空气电池如图所
示。当电池放电时
,O
2
与
Li
+
在多孔碳材料电极处生成
(x=0
或
1)
。下列说法正确的是
(
)
A.
放电时
,
多孔碳材料电极为负极
B.
放电时
,
外电路电子由多孔碳材料电极流向锂电极
C.
充电时
,
电解质溶液中
Li
+
向多孔碳材料区迁移
D.
充电时
,
电池总反应为
Li
2
====
2Li+(1-
)O
2
【
解析
】
选
D
。结合题中所给信息及装置图
,
可知放电
时
Li
作负极
,
负极反应为
2Li-2e
-
==== 2Li
+
,
多孔碳材
料作正极
,
正极反应为
(1- )O
2
+2Li
+
+2e
-
====
Li
2
O
2-x
,
故
A
错误
;B
项电子从
Li
电极流向多孔碳材料
,
故
B
错误
;C
项充电时多孔碳材料作阳极
,Li
+
应移向锂
电极
,
故
C
错误
;D
项结合放电时的正负极反应式可
知正确。
2.(2019·
武汉模拟
)
下图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是 世纪金榜导学号
(
)
A.a
、
b
极不能使用同种电极材料
B.
工作时
,a
极的电势低于
b
极的电势
C.
工作一段时间之后
,a
极区溶液的
pH
增大
D.b
极的电极反应式为
CH
3
COO
-
+4H
2
O-8e
-
====2
+9H
+
【
解析
】
选
D
。图中连接负载
(
用电器
)
的装置为原电池
,
根据电极上的物质变化
,
判断得或失电子、电极名称
,
写出电极反应式。应用原电池原理是正确判断的关
键。
A.
电极
a
、
b
上发生的反应不同
,
因而两极间形成电
势差
,
故电极材料可同可异
,A
项错误
;B.
工作时
,
电极
b
上
CH
3
COO
-
→ ,
碳元素从
0
价失电子升至
+4
价
,
电极
b
是原电池的负极
,
则电极
a
是电池的正极
,a
极的电势高
于
b
极的电势
,B
项错误
;C.
电极
a(
正极
)
电极反应为
+H
+
+2e
-
==== +Cl
-
,
正极每得到
2 mol
电子时
,
为使溶液电中性
,
必有
2 mol H
+
通过质子交换
膜进入
a
极溶液
,
同时电极反应消耗
1 mol H
+
。故工作
一段时间之后
,a
极区溶液中
H
+
浓度增大
,pH
减小
,C
项
错误
;D.
据图中物质转化
,
考虑到质量守恒和电荷守恒
关系
,
电极
b(
负极
)
反应为
CH
3
COO
-
+4H
2
O-8e
-
====2
+9H
+
,D
项正确。
【
加固训练
】
1.
美国
NASA
曾开发一种铁
-
空气二次电池。该电池放电
时
,
其原理如图所示
,
电池反应为
2Fe+O
2
+2H
2
O==== 2Fe(OH)
2
。有关该电池放电时的说法正确的是
(
)
A.
电极
a
质量不变
B.
电极
b
为电池负极
C.
电子由电极
a
经负载流向电极
b
D.
由电能转变为化学能
【
解析
】
选
C
。从已知的反应原理看
,Fe
在反应过程中失去电子
,
则在原电池的负极发生反应
,O
2
在反应过程中得到电子
,
则在原电池的正极发生反应。电极
a
上
Fe
失去电子生成
Fe
2+
,
并进一步变成
Fe(OH)
2
,
所以电极
a
的质量增大
,A
错误
;
电极
b
上
O
2
得到电子
,
作原电池的正极
,B
错误
;
电子从负极流出
,
经过外电路流向正极
,C
正确
;
原电池是一种将化学能转变成电能的装置
,D
错误。
2.(2018·
全国卷
Ⅱ)
我国科学家研发了一种室温下
“可呼吸”的
Na-CO
2
二次电池。将
NaClO
4
溶于有机溶
剂作为电解液
,
钠和负载碳纳米管的镍网分别作为电极
材料
,
电池的总反应为
:3CO
2
+4Na 2Na
2
CO
3
+C
。下
列说法错误的是
(
)
A.
放电时
,
向负极移动
B.
充电时释放
CO
2
,
放电时吸收
CO
2
C.
放电时
,
正极反应为
:3CO
2
+4e
-
====2
+C
D.
充电时
,
正极反应为
:Na
+
+e
-
====Na
【
解析
】
选
D
。放电时为原电池
,
而溶液中的阴离子移
向电池的负极
,
故
A
项正确
;
由题干中的信息可以得出
Na
为电池的负极材料
,
因电池的总反应为
3CO
2
+4Na
2Na
2
CO
3
+C,
则电池放电时吸收
CO
2
,
充电时放出
CO
2
,
故
B
项正确
;
放电时
CO
2
在正极放电
,
而充电时会在正极生成
CO
2
,Na
在电池的负极参与反应
,
在充电时又会在电池的
负极生成
,
故
C
项正确
,D
项错误。
3.(2019·
张家口模拟
)
一种检测空气中甲醛
(HCHO)
含量的电化学传感器的工作原理如图所示。下列说法正确的是
(
)
A.
传感器工作时
,
工作电极电势高
B.
工作时
,H
+
通过交换膜向工作电极附近移动
C.
当导线中通过
1.2×10
-6
mol
电子
,
进入传感器的甲醛为
3×10
-3
mg
D.
工作时
,
对电极区电解质溶液的
pH
增大
【
解析
】
选
D
。原电池工作时
,HCHO
转化为
CO
2
,
失电子
在负极发生氧化反应
,
其电极反应式为
HCHO+H
2
O-4e
-
====CO
2
+4H
+
,O
2
在正极得电子发生还原反应
,
其电极反
应式为
O
2
+4e
-
+4H
+
====2H
2
O,
工作时
,
阳离子向电源的
正极移动。
HCHO
在工作电极失电子被氧化
,
作原电池
的负极
,
工作电极电势低
, A
项错误
;
根据原电池工作原
理知
,
工作时
,
溶液中的阳离子
(
氢离子
)
向电源的
正极移动
,
即对电极方向
, B
项错误
;
负极反应为
HCHO+H
2
O-4e
-
====CO
2
+4H
+
,
当电路中转移
1.2×10
-6
mol
电子时
,
消耗
HCHO
的物质的量为
×1.2×10
-6
mol
=3.0×10
-7
mol,
则
HCHO
质量为
3.0×10
-7
mol ×30 g·
mol
-1
= 9×10
-3
mg, C
项错误
;
工作时
,
对电极的电极反
应为
:4H
+
+O
2
+4e
-
====2H
2
O,
反应后生成水
,
虽然有
相同数量的氢离子从负极迁移过来
,
但是溶液的体积
增大
,
正极区溶液的酸性减弱
,
其
pH
增大
(
若忽略溶液的体积变化
,
则
pH
基本不变
),D
项正确。
4.
最近科学家研发了可充电“全氢电池”
,
其工作原理如图所示。
(1)
吸附层
a
中发生反应的方程式是
______
_
____
。
(2)
电池的总反应方程式是
___________
。
(3)
请在图中标出
Na
+
的移动方向。
(4)
下列说法正确的是
________(
选序号
)
。
a.H
2
可循环利用
,
基本不需要补充
b.NaClO
4
的作用是传导离子和参与电极反应
c.“
全氢电池”工作时
,
将化学能转化为电能
d.
该电池充电时
,
吸附层
b
接电源正极
【
解析
】
由电子流向可知
,
右边吸附层为正极
,
发生
了还原反应
,
左边吸附层为负极
,
发生了氧化反应
,
电极
反应是
H
2
-2e
-
+2OH
-
====2H
2
O,
正极电极反应是
2H
+
+2e
-
=====H
2
,
电池的总反应无氧气参加
,
原电池中阳离子移
向正极
,
阴离子移向负极
,
所以电解质溶液中
Na
+
向右正
极移动
,
向左负极移动
,
(1)
根据电子流向得到吸附层
a
中发生反应是原电池负极反应
,
氢气失电子发生氧化反应
,
电极反应为
H
2
-2e
-
+2OH
-
====2H
2
O
。
(2)
由电子流向可知
,
右边吸附层为正极
,
发生了还原反应
,
由电子流向可知
,
左边吸附层为负极
,
发生了氧化反应
,
电极反应是
H
2
-2e
-
+2OH
-
====2H
2
O,
正极电极反应是
2e
-
+2H
+
====H
2
,
得到总反应的离子方程式为
H
+
+OH
-
====H
2
O
。
(3)
原电池中阳离子移向正极
,Na
+
的移动方向由左向右
,
图示为
(4)H
2
可循环利用
,
化学能转化为电能
,
电池充电时
b
接电源正极。
a.
反应过程中不消耗氢气
,H
2
可循环利用
,
基本不需要补充
,a
正确
;b.NaClO
4
的作用是传导离子
,
不参与电极反应
,b
错误
;c.“
全氢电池”工作时是原电池反应
,
能量变化是将化学能转化为电能
,c
正确
;d.
该电池充电时
,
原电池正极连接电源的正极
,
原电池负极连接电源负极
,
吸附层
b
为原电池正极
,
接电源正极
,d
正确。
答案
:
(1)H
2
-2e
-
+2OH
-
====2H
2
O
(2)H
+
+OH
-
====H
2
O
(3)
(4)acd
热点二 电解原理 金属的腐蚀与防护
【
研典例探究升华
】
角度一
:
电解原理
【
典例
4】
(2018·
全国卷
Ⅰ)
最近我国科学家设计了一种
CO
2
+H
2
S
协同转化装置
,
实现对天然气中
CO
2
和
H
2
S
的高效去除。示意图如下所示
,
其中电极分别为
ZnO@
石墨烯
(
石墨烯包裹的
ZnO)
和石墨烯
,
石墨烯电极区发生反应为
:
①EDTA-Fe
2+
-e
-
====EDTA-Fe
3+
②2EDTA-Fe
3+
+H
2
S====2H
+
+S+2EDTA-Fe
2+
该装置工作时
,
下列叙述错误的是
(
)
A.
阴极的电极反应
:CO
2
+2H
+
+2e
-
====CO+H
2
O
B.
协同转化总反应
:CO
2
+H
2
S====CO+H
2
O+S
C.
石墨烯上的电势比
ZnO@
石墨烯上的低
D.
若采用
Fe
3+
/Fe
2+
取代
EDTA-Fe
3+
/EDTA-Fe
2+
,
溶液需为酸性
【
解析
】
选
C
。根据图中的物质转化方式可知
,
该电解
池的左侧电极上发生还原反应为阴极
,
右侧电极上发生
氧化反应为阳极
,
故该电池的阴极的电极反应式为
CO
2
+2H
+
+2e
-
====CO+H
2
O,A
正确
;
将电解池阴、阳极电极
的反应式相加即可得到协同转化的总反应式
:
CO
2
+H
2
S====CO+H
2
O+S,B
正确
;
由于石墨烯为阳极
,
与电
源的正极相连
,
石墨烯上的电势高
,C
不正确
;
若采
用
Fe
3+
/Fe
2+
取代
EDTA-Fe
3+
/EDTA-Fe
2+
,
若溶液呈碱性
,
则会使溶液中形成沉淀
,
减少
Fe
3+
/Fe
2+
的含量
,
故溶液应呈酸性。
【
规律方法
】
“电解装置”解题流程
角度二
:
电化学腐蚀与金属防护
【
典例
5】
(2017·
全国卷
Ⅰ)
支撑海港码头基础的钢管桩
,
常用外加电流的阴极保护法进行防腐
,
工作原理如图所示
,
其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
(
)
A.
通入保护电流使钢管桩表面腐蚀电流接近于零
B.
通电后外电路电子被强制从高硅铸铁流向钢管桩
C.
高硅铸铁的作用是作为损耗阳极材料和传递电流
D.
通入的保护电流应该根据环境条件变化进行调整
【
解析
】
选
C
。通过外加电流的阴极保护法可以有效防止钢管桩的腐蚀
,
从而使钢管桩表面腐蚀电流接近于零
,A
项正确
;
通电后高硅铸铁为阳极
,
发生氧化反应
,
电子流出通过外电路流向钢管桩
,B
项正确
;
高硅铸铁为惰性辅助阳极
,
阳极反应的实质是水的电解
,
高硅铸铁并不是损耗阳极材料
,
只起传递电流的作用
,C
项错误
;
可以根据发生腐蚀的趋势不同调整通入的保护电流
,D
项正确。
【
延伸探究
】
(1)
如果不通入电流
,
高硅铸铁应换成什么材料
,
可以起到防腐作用
?
提示
:
换成金属锌
,
作负极可以保护钢管桩。
(2)
什么样的环境下
,
应调大保护电流
?
提示
:
若海水的酸性变强
,
或者氧气浓度变大
,
金属的腐蚀严重时
,
应调大保护电流。
【
精整合技法指导
】
1.
分析电化学装置的思维流程
2.
电极反应式和电解方程式应注意的问题
(1)
做到“三看”
,
正确书写电极反应式
①一看电极材料
,
若是金属
(Au
、
Pt
除外
)
作阳极
,
金属一定被电解
(
注
:Fe
生成
Fe
2+
)
。
②二看电解质
,
电解质是否参与电极反应。
③
三看电解质状态
,
是熔融状态还是水溶液。
(2)
规避“三个”失分点
①书写电解池中电极反应式时
,
一般以实际放电的离子表示
,
但书写总电解反应方程式时
,
弱电解质要写成分子式
,
且注明“通电”条件。
②
要确保两极电子转移数目相同。
③电解水溶液时
,
应注意放电顺序中
H
+
、
OH
-
之后的离子一般不参与放电。
3.
电化学计算的基本方法
【
练类题巩固拓展
】
1.(2019·
全国卷
Ⅱ·
节选
)
环戊二烯可用于制备二茂
铁
(Fe(C
5
H
5
)
2
,
结构简式为
),
后者广泛应用于航天、
化工等领域中。二茂铁的电化学制备原理如下图所示
,
其中电解液为溶解有溴化钠
(
电解质
)
和环戊二烯的
DMF
溶液
(DMF
为惰性有机溶剂
)
。 世纪金榜导学号
该电解池的阳极为
_____________________________,
总反应为
______
_
___
_
______
_
___________
。
电解制备需要在无水条件下进行
,
原因为
_______
。
【
解析
】
由原理图可知
,Fe
电极的铁生成
Fe
2+
,
发生氧
化反应
,Fe
电极为电解池的阳极
;
由图可知有
H
2
生成
,
电
解池的总反应为
Fe+2 +H
2
↑
。中间物
Na
能与水
反应
,
且水会电解生成
OH
-
,
与
Fe
2+
反应生成
Fe(OH)
2
,
故
电解制备需要在无水条件下进行。
答案
:
Fe
电极
Fe+2 +H
2
↑(Fe+2C
5
H
6
==== Fe(C
5
H
5
)
2
+H
2
↑)
水会阻碍中间物
Na
的生成
;
水会电解
生成
OH
-
,
进一步与
Fe
2+
反应生成
Fe(OH)
2
2.
城市地下潮湿的土壤中常埋有纵横交错的管道和输电线路
,
当有电流泄漏并与金属管道形成回路时
,
就会引起金属管道的腐蚀。原理如图所示
,
但若电压等条件适宜
,
钢铁管道也可能减缓腐蚀
,
此现象被称为“阳极保护”。下列有关说法不正确的是 世纪金榜导学号
(
)
A.
该装置能够将电能转化为化学能
B.
管道右端腐蚀比左端快
,
右端电极反应式为
Fe-2e
-
====Fe
2+
C.
如果没有外加电源
,
潮湿的土壤中的钢铁管道比较容易发生吸氧腐蚀
D.
钢铁“阳极保护”的实质是在阳极金属表面形成一层耐腐蚀的钝化膜
【
解析
】
选
B
。
A
项
,
该装置相当于电解池
,
能将电能转化为化学能
,
正确
;B
项
,
左端是阳极
,
腐蚀得更快
,
错误
;C
项
,
如果没有外加电源
,
潮湿的土壤
(
接近中性
)
中的钢铁管道发生原电池反应
,
所以发生的是吸氧腐蚀
,
正确
;D
项
,
根据题意
,
此种腐蚀较慢
,
所以“阳极保护”实际上是在金属表面形成了一层致密的保护膜
,
正确。
【
加固训练
】
1.(2017·
全国卷
Ⅲ)
全固态锂硫电池能量密度高、成
本低
,
其工作原理如图所示
,
其中电极
a
常用掺有石墨
烯的
S
8
材料
,
电池反应为
:16Li+xS
8
====8Li
2
S
x
(2≤x≤8)
。下列说法错误的是
(
)
A.
电池工作时
,
正极可发生反应
:2Li
2
S
6
+2Li
+
+2e
-
====3Li
2
S
4
B.
电池工作时
,
外电路中流过
0.02 mol
电子
,
负极材料减重
0.14 g
C.
石墨烯的作用主要是提高电极
a
的导电性
D.
电池充电时间越长
,
电池中
Li
2
S
2
的量越多
【
解析
】
选
D
。电池工作时
,Li
+
向正极移动
,
则
a
为正极
,
正极上得电子发生还原反应
,
电极反应可以为
2Li
2
S
6
+
2Li
+
+2e
-
====3Li
2
S
4
,A
项正确
;
电池工作时
,
转移
0.02 mol
电子时
,Li
被氧化生成
Li
+
的物质的量为
0.02 mol,
负极质量减轻
0.14 g,B
项正确
;
石墨烯能导电
,
利用石墨烯作电极
,
可提高电极
a
的导电性
,C
项正确
;
并
不是电池充电时间越长
,
电池中
Li
2
S
2
的量越多
,D
项错
误。
2.(2019·
温州模拟
)
下列关于如图所示实验装置说法不正确的是
(
)
A.
该装置为铁的吸氧腐蚀实验
B.
一段时间后
,
向插入铁钉的玻璃筒内滴入
NaOH
溶液
,
即可观察到铁钉附近溶液中有沉淀生成
C.
向插入石墨棒的玻璃筒内滴入石蕊试液
,
可观察到石墨附近的溶液变红
D.
若将装置中饱和食盐水换成稀硫酸
,
装置内发生析氢腐蚀
【
解析
】
选
C
。无锈铁钉通过导线与石墨棒相连并插入
饱和食盐水中形成原电池
,
由于
NaCl
溶液呈中性
,
故铁
钉发生吸氧腐蚀
,
则正极反应式为
2H
2
O+O
2
+4e
-
====
4OH
-
,A
正确
;
发生腐蚀时
,Fe
作负极被氧化
,
电极反应式
为
Fe-2e
-
==== Fe
2+
,
一段时间后
,
铁钉附近溶液中含有
Fe
2+
,
滴入
NaOH
溶液时
,
先生成
Fe(OH)
2
沉淀
,
后被氧化生
成
Fe(OH)
3
沉淀
,B
正确
;
发生吸氧腐蚀时
,
石墨棒周围
溶液呈碱性
,
滴入石蕊试液
,
溶液变成蓝色
,C
错误
;
将装置中饱和食盐水换成稀硫酸
,
电解质溶液呈酸性
,
发生腐蚀时
,
正极反应式为
2H
+
+2e
-
====H
2
↑,
故发生析氢腐蚀
,D
正确。
3.(2019·
保定模拟
)
如图所示
,
在一定电压下用惰性电极电解由等物质的量浓度的
FeCl
2
、
HCl
组成的混合溶液。已知在此电压下
,
阴、阳离子根据放电能力顺序
,
都可能在阳极放电
,
下列分析正确的是
(
)
A.C
1
电极上的电极反应式为
2H
2
O+2e
-
====2OH
-
+H
2
↑
B.C
1
电极处溶液首先变黄色
C.C
2
电极上可依次发生的电极反应为
Fe
2+
-e
-
====Fe
3+
、
2Cl
-
-2e
-
====Cl
2
↑
D.
当
C
1
电极上有
2 g
物质生成时
,
就会有
2N
A
个电子通过
溶液发生转移
【
解析
】
选
C
。
C
1
电极与电源的负极相连
,
作阴极
,
溶液中的
H
+
在阴极放电
,
电极反应式为
2H
+
+2e
-
====H
2
↑,A
错误
;C
1
电极上
H
+
放电生成
H
2
,C
2
电极与电源的正极相连
,
作阳极
,Fe
2+
的还原性强于
Cl
-
,
则依次发生的电极反应为
Fe
2+
-e
-
====Fe
3+
、
2Cl
-
-2e
-
====Cl
2
↑,
故
C
2
电极处溶液先变黄色
,B
错误
,C
正确
;
电子只能通过导线传递
,
不能通过溶液传递
,D
错误。
热点三 离子交换膜在电化学中的应用
【
研典例探究升华
】
【
典例
6】
(2016·
全国高考
Ⅰ)
三室式电渗析法处理含
Na
2
SO
4
废水的原理如图所示
,
采用惰性电极
,ab
、
cd
均
为离子交换膜
,
在直流电场的作用下
,
两膜中间的
Na
+
和
可通过离子交换膜
,
而两端隔室中离子被阻挡不能
进入中间隔室。
下列叙述正确的是
(
)
A.
通电后中间隔室的
离子向正极迁移
,
正极区溶液
pH
增大
B.
该法在处理含
Na
2
SO
4
废水时可以得到
NaOH
和
H
2
SO
4
产品
C.
负极反应为
2H
2
O-4e
-
====O
2
+4H
+
,
负极区溶液
pH
降低
D.
当电路中通过
1 mol
电子的电量时
,
会有
0.5 mol
的
O
2
生成
【
解析
】
选
B
。电解池中阴离子向阳极移动
,
所以通电
后中间隔室的 向正极区迁移
,
阳极上氢氧根离子放
电产生氧气
,
溶液中氢离子浓度增大
,pH
减小
,A
项错误
;
电解时在负极区生成
NaOH,
在正极区生成
H
2
SO
4
,B
项正
确
;
阴极反应是氢离子得到电子生成氢气
,
溶液中氢氧
根离子浓度增大
,pH
升高
,C
项错误
;
当电路中通过
1 mol
电子的电量时
,
会有
0.25 mol
的
O
2
生成
,D
项错误。
【
延伸探究
】
(1)
要想完成此废水的处理
,cd
应为
________(
填“阳”“阴”
)
离子交换膜。
提示
:
阴。根据同种电荷相互排斥
,
异种电荷相互吸引
的原则
,
在电解池中阴离子会向正电荷较多的阳极区定
向移动
,
因此通电后中间隔室的 向正极迁移
,
即
cd
应为阴离子交换膜。
(2)
常温下
,Na
2
SO
4
足量
,
当电路中通过
0.1 mol
电子的电量时
,
负极区附近溶液的
pH
为
________
。
(
设溶液体积为
1 L,
反应前后不变
)
提示
:
13
。当电路中通过
0.1 mol
电子的电量时
,
负极发生反应
2H
2
O+2e
-
====2OH
-
+H
2
↑,
可得
n(OH
-
)=0.1 mol,
则溶液的
pH
为
13
。
(3)
废水处理完毕后
,
若去掉
ab
膜、
cd
膜
,
将三部分溶液充分混合
,
加入适量的
________(
填化学式
)
可将溶液恢复到原状态。
提示
:
H
2
O
。整个电解过程的实质是电解水。
【
精整合技法指导
】
离子交换膜的功能、类型、作用
【
练类题巩固拓展
】
1.(
单膜
)
工业上可利用如图所示电解装置吸收和转化
SO
2
(A
、
B
均为惰性电极
)
。下列说法正确的是
(
)
A.A
电极接电源的正极
B.A
极区溶液的碱性逐渐增强
C.
本装置中使用的是阴离子交换膜
D.B
极的电极反应式为
SO
2
+2e
-
+2H
2
O====
+4H
+
【
解析
】
选
B
。
A.
由 生成
,
发生还原反应
,A
应
为负极
,
故
A
错误
;B.
阴极的电极反应式为
:2 +2H
+
+2e
-
==== +2H
2
O,
碱性增强
,
故
B
正确
;C.
阳极的电
极反应式为
:SO
2
+2H
2
O-2e
-
==== +4H
+
,
阴极的电极
反应式为
:2 +2H
+
+2e
-
==== +2H
2
O,
离子交换膜
应使
H
+
移动
,
应为阳离子交换膜
,
故
C
错误
;D.B
为阳极
,
发生
SO
2
+2H
2
O-2e
-
==== +4H
+
,
故
D
错误。
2.(
双膜
)
实验室模拟三室式电渗析法
,
采用惰性电极处
理含
Na
2
SO
3
的废水的原理如图所示。
ab
、
cd
均为离子
交换膜
,
在直流电场的作用下
,
两膜中间的
Na
+
和
可
通过离子交换膜
,
而两端隔室中的离子被阻挡不能进入
中间隔室。下列叙述正确的是
(
)
A.B
极为阴极
,
当有
2 mol
电子通过时产生
22.4 L
气体
B.A
极反应为
2H
2
O-4e
-
====O
2
+4H
+
,
该区溶液
pH
降低
C.
当有
1 mol
进入
A
极区时
,
则得到
1 mol·L
-1
的
H
2
SO
4
产品
D.
通电一段时间后
,Na
2
SO
3
废水的
pH
降低
【
解析
】
选
D
。由离子移向可知
B
为电解池的阴极
,
电极
反应
2H
+
+2e
-
====H
2
↑,
当有
2 mol
电子通过时产生
1 mol
气体
,
但温度压强不知不能计算
,A
错误
;A
电极为电解池
的阳极
,
溶液中氢氧根离子失电子发生氧化反应
,
电极
反应为
:4OH
-
-4e
-
====2H
2
O+O
2
↑,B
错误
;
通电时
,
氢氧根
离子在阳极区放电生成水和氧气
,
两膜中间的亚硫酸根
离子会进入正极区被
O
2
氧化为
,
与氢离子结
合成硫酸
,
当有
1mol
进入
A
极区时
,
则得到
1 mol
的
H
2
SO
4
产品
,
溶液体积不知不能计算浓度
,C
错误
;
溶液中
亚硫酸根离子移向阳极废水中 浓度降低
,
溶液
pH
减小
,D
正确。
3.(
多膜
)
电渗析法淡化海水装置示意图如下
,
电解槽中阴离子交换膜和阳离子交换膜相间排列
,
将电解槽分隔成多个独立的间隔室
,
海水充满在各个间隔室中。通电后
,
一个间隔室的海水被淡化
,
而其相邻间隔室的海水被浓缩
,
从而实现了淡水和浓缩海水分离。下列说法正确的是
(
)
世纪金榜导学号
A.
离子交换膜
b
为阳离子交换膜
B.
各间隔室的排出液中
,①③⑤⑦
为淡水
C.
通电时
,
电极
l
附近溶液的
pH
比电极
2
附近溶液的
pH
变化明显
D.
淡化过程中
,
得到的浓缩海水没有任何使用价值
【
解析
】
选
B
。图中分析可知
,
电极
1
为电解池阳极
,
氯
离子放电生成氯气
,
电极反应为
2Cl
-
-2e
-
====Cl
2
↑,
电
极
2
为阴极
,
溶液中氢离子得到电子生成氢气
,
电极反应
为
2H
+
+2e
-
====H
2
↑,
实线对应的半透膜是阳离子半透膜
,
虚线是阴离子半透膜
,A.
分析可知
b
为阴离子交换膜
,
故
A
错误
;B.
实线对应的半透膜是阳离子半透膜
,
虚线是阴
离子半透膜
,
结合阴阳离子移向可知
,
各间隔
室的排出液中
,①③⑤⑦
为淡水
,
故
B
正确
;C.
通电时
,
阳
极电极反应
:2Cl
-
-2e
-
====Cl
2
↑,
阴极电极反应
:
2H
+
+2e
-
====H
2
↑,
电极
2
附近溶液的
pH
比电极
1
附近溶液
的
pH
变化明显
,
故
C
错误
;D.
淡化过程中
,
得到的浓缩海
水可以提取氯化钠、镁、溴等
,
有使用价值
,
故
D
错误。
【
加固训练
】
1.
某混合物浆液含
Al(OH)
3
、
MnO
2
和少量
Na
2
CrO
4
。考虑到胶体的吸附作用使
Na
2
CrO
4
不易完全被水浸出
,
某研究小组利用设计的电解分离装置如图所示
,
使浆液分离成固体混合物和含铬元素溶液
,
并回收利用。
用惰性电极电解时
,
能从浆液中分离出来的原因
是
__________________________________________,
分离后含铬元素的粒子是
____________;
阴极室生成的
物质为
____________(
写化学式
)
。
【
解析
】
惰性电极电解混合物的浆液时
,Na
+
移向阴极
,
移向阳极。在直流电源的作用下
,
通过阴
离子交换膜向阳极室移动
,
脱离浆液
;
分离后的溶液中
存在
2 (
黄色
)+2H
+
(
橙红色
)+H
2
O
平衡
,
故含铬元素的粒子是 和
;
由于阴极是溶液
中的
H
+
得电子生成氢气
,
所以阴极室生成的物质为
NaOH
和
H
2
。
答案
:
在直流电场作用下
,
通过阴离子交换膜向
阳极室移动
,
脱离浆液 和
NaOH
和
H
2
2.(2018·
全国卷
Ⅰ
节选
)
焦亚硫酸钠
(Na
2
S
2
O
5
)
在医药、橡胶、印染、食品等方面应用广泛。制备
Na
2
S
2
O
5
可采用三室膜电解技术
,
装置如图所示
,
其中
SO
2
碱吸收液中含有
NaHSO
3
和
Na
2
SO
3
。阳极的电极反应式为
___
。
电解后
,________
室的
NaHSO
3
浓度增加。将该室溶液进行结晶脱水
,
可得到
Na
2
S
2
O
5
。
【
解析
】
阳极发生氧化反应
:2H
2
O-4e
-
====4H
+
+O
2
↑,
阳
极室
H
+
向
a
室迁移
,
与
a
室中的
SO
2
碱吸收液中含有的
Na
2
SO
3
发生反应转化成
NaHSO
3
,
故
a
室中
NaHSO
3
浓度增
加。
答案
:
2H
2
O-4e
-
====4H
+
+O
2
↑
a
3.(2018·
全国卷
Ⅲ
节选
)
利用“
KClO
3
氧化法”制备
KIO
3
工艺流程如图所示
:
KIO
3
也可采用“电解法”制备
,
装置如图所示。
(1)
写出电解时阴极的电极反应式
_____________
。
(2)
电解过程中通过阳离子交换膜的离子主要为
_____
___,
其迁移方向是
________
。
(3)
与“电解法”相比
,“KClO
3
氧化法”的主要不足之处有
________(
写出一点
)
。
【
解析
】
(1)
电解法制备
KIO
3
时
,H
2
O
在阴极得到电子
,
发生还原反应
:2H
2
O+2e
-
====2OH
-
+H
2
↑
。
(2)
电解池中阳离子向阴极移动
,
即由电极
a
向电极
b
迁移
,
阳离子交换膜只允许阳离子通过
,
故主要是
K
+
通过阳离子交换膜。
(3)
根据工艺流程分析
,KClO
3
氧化法生成的
Cl
2
有毒
,
易污染环境
;
且在调
pH
时加入
KOH
的量不易控制
;
生成的
KIO
3
中杂质较多。
答案
:
(1)2H
2
O+2e
-
====2OH
-
+H
2
↑
(2)K
+
由
a
到
b
(3)
产生
Cl
2
,
易污染环境
(
合理即可
)
4.H
3
PO
2
可用电渗析法制备。“四室电渗析法”工作原理如图所示
(
阳膜和阴膜分别只允许阳离子、阴离子通过
):
(1)
写出阳极的电极反应式
:___________
。
(2)
分析产品室可得到
H
3
PO
2
的原因
:________
。
(3)
早期采用“三室电渗析法”制备
H
3
PO
2
:
将“四室电渗析法”中阳极室的稀硫酸用
H
3
PO
2
稀溶液代替。并撤去阳极室与产品室之间的阳膜
,
从而合并了阳极室与产品室。其缺点是产品中混有
________
杂质。该杂质产生的原因是
_____________________
。
【
解析
】
(1)
阳极发生氧化反应
,
在反应中
OH
-
失去电子
,
电极反应式为
2H
2
O-4e
-
====O
2
↑+4H
+
。
(2)H
2
O
放电产生
H
+
,H
+
通过阳膜进入产品室
,
原料室的
穿过阴膜扩散至产品室
,
二者发生反应
:
H
+
+ ====H
3
PO
2
。
(3)
如果撤去阳膜
,
或
H
3
PO
2
可能会被氧化生成
。
答案
:
(1)2H
2
O-4e
-
====O
2
↑+4H
+
(2)
阳极室的
H
+
穿过阳膜扩散至产品室
,
原料室的
穿过阴膜扩散至产品室
,
二者反应生成
H
3
PO
2
(3)
或
H
3
PO
2
被氧化