- 228.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
题型十三 化学平衡的移动
(建议用时:20分钟)
一、单项选择题
1.温度为T K时向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应PCl5 (g)PCl3(g)+Cl2(g),经过一段时间后达到平衡,反应过程中测定的部分数据列于下表。下列说法正确的是( )
t/s
0
50
150
250
350
n(PCl3)/mol
0
0.16
0.19
0.20
0.20
A.在前50 s,PCl3的平均反应速率v(PCl3)=0.003 2 mol·L-1·s-1
B.达到平衡时,容器中的压强是起始时的1.2倍
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v正0
B.T1时,该反应的平衡常数为
C.容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1∶2
D.若T20)。相关反应数据如下:
容器
容器类型
起始温度/℃
起始物质的量/mol
平衡时H2
物质的
量/mol
CO
H2O
CO2
H2
Ⅰ
恒温恒容
800
1.2
0.6
0
0
0.4
Ⅱ
恒温恒容
900
0.7
0.1
0.5
0.5
Ⅲ
绝热恒容
800
0
0
1.2
0.8
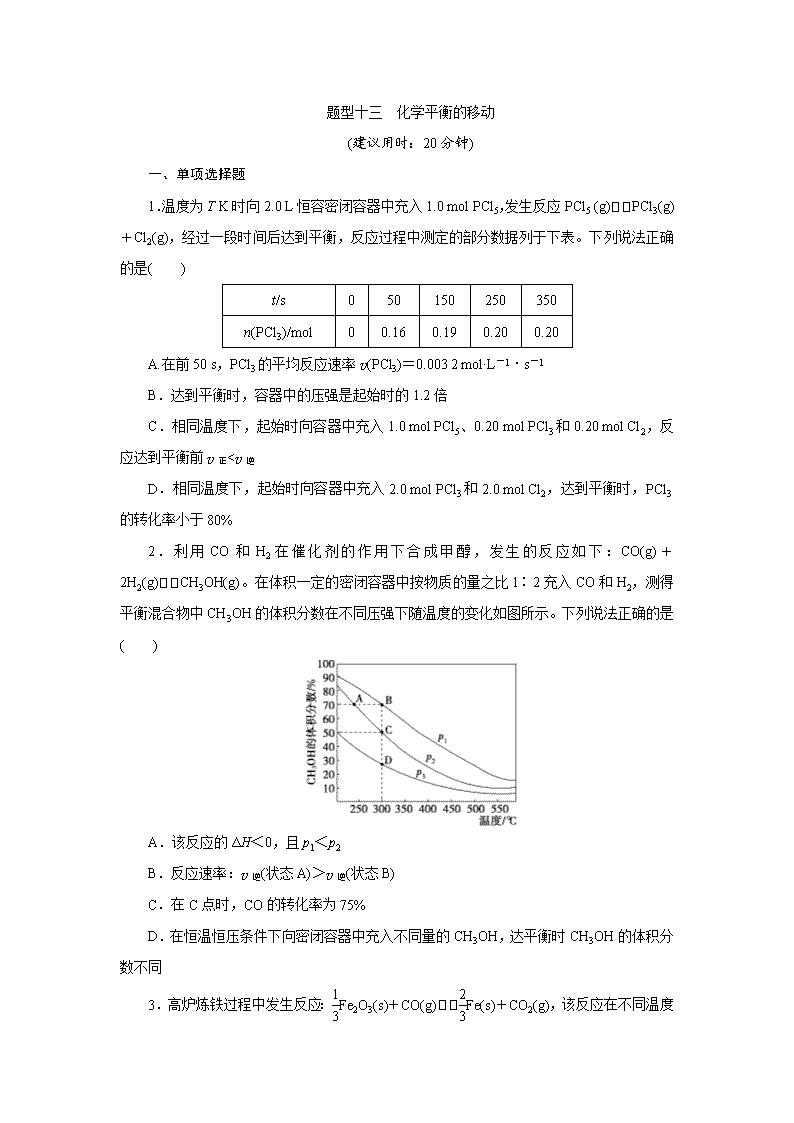
下列说法正确的是( )
A.容器Ⅰ中反应经10 min建立平衡,0~10 min内,平均反应速率v(CO)=0.04 mol·L-1·min-1
B.若向容器Ⅰ平衡体系中再加入CO、H2O、CO2、H2各0.1 mol,平衡正向移动
C.达到平衡时,容器Ⅱ中反应吸收的热量小于0.1a kJ
D.达到平衡时,容器Ⅲ中n(CO)<0.48 mol
8.(2019·苏州高三质量调研)700 ℃时,在四个恒容密闭容器中反应H2(g)+CO2(g)H2O(g)+CO(g)达到平衡。
起始浓度
甲
乙
丙
丁
c(H2)/(mol·L-1)
0.10
0.20
0.20
0.10
c(CO2)/(mol·L-1)
0.10
0.10
0.20
0.20
甲容器达平衡时c(H2O)=0.05 mol·L-1。下列说法正确的是( )
A.达平衡时容器乙中CO2的转化率等于50%
B.温度升至800 ℃,上述反应的平衡常数为,则正反应为放热反应
C.达平衡时容器丙中c(CO2)是容器甲中的2倍
D.达平衡时容器丁中c(CO)与容器乙中的相同
9.在三个容积均为1 L的恒温恒容密闭容器中,起始时按下表中相应的量加入物质,在相同温度下发生反应3CO(g)+3H2(g)(CH3)2O(g)+CO2(g)(不发生其他反应), CO的平衡转化率与温度和压强的关系如下图所示。
容器
起始物质的量/mol
CO的平衡转化率
CO
H2
(CH3)2O
CO2
Ⅰ
0.3
0.3
0
0
50%
Ⅱ
0.3
0.3
0
0.1
Ⅲ
0
0
0.2
0.4
下列说法正确的是( )
A.该反应的ΔH<0,压强p10,压强p1>p2
B.起始时,容器Ⅱ中v正(CH4)0,而当温度不变时,增大压强会使平衡向着气体体积减小的方向即逆反应方向移动,CH4的平衡转化率会减小,因此p2>p1,A错误;由容器Ⅰ中可得出该温度下,该反应的平衡常数K=0.067 5,而起始时容器Ⅱ中的Q==0.27>K,所以起始时反应逆向进行,B正确;利用等效平衡思想可判断,nⅡ(CO)<2nⅠ(CO),C正确;容器Ⅱ中等效于起始量为0.2 mol CH4和0.2 mol H2O,容器Ⅲ中等效于起始量为0.2 mol CH4和0.3 mol H2O,则达到平衡时容器Ⅱ、Ⅲ中气体的总压强之比pⅡ∶pⅢ<4∶5,D错误。