- 290.71 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1.美国UNC化学教授Thomas J. Meyer等研发了环境友好、完全型的“绿色”引爆炸药,其中一种可表示为Na2R,它保存在水中可以失去活性,爆炸后不会产生危害性残留物。已知10 mL某Na2R溶液含Na+的数目为N,该Na2R溶液的物质的量浓度为( )。
A.N×10-2 mol·L-1 B.N1.204×1022 mol·L-1
C.N6.02×1021 mol·L-1 D.N6.02×1025 mol·L-1
解析 10 mL该Na2R溶液中含Na+的数目为N,Na2R的物质的量为N2×6.02×1023 mol,Na2R的物质的量浓度为N2×6.02×1023 mol÷0.01 L=N1.204×1022 mol·L-1。
答案 B
2.(2018年安徽168中阶段性考试)某乙醇水溶液的质量分数为w%,物质的量浓度为c mol·L-1,密度为d g·mL-1,1 kg 这种溶液中含有的乙醇是( )。
A.46c g B.cd mol
C.c mol D.1000dw g
解析 1 kg该溶液中乙醇的质量为1000 g×w%=10w g;1 kg该溶液的体积为1000 gdg·mL-1=1000d mL=1d L,所以乙醇的物质的量为c·V=c mol·L-1×1d L=cd mol。
答案 B
3.在配制一定物质的量浓度的盐酸时,下列错误操作可使所配制溶液浓度偏高的是( )。
A.用量筒量取浓盐酸时仰视读数
B.稀释搅拌时有液体飞溅
C.定容时仰视容量瓶刻度线
D.定容摇匀后液面下降,再加水至刻度线
解析 用量筒量取浓盐酸时仰视读数会导致浓盐酸体积偏大,溶质的物质的量偏大,所配制溶液浓度偏高,A项正确;稀释搅拌时有液体飞溅,会导致溶质的物质的量偏小,所配制溶液浓度偏低,B项错误;定容时仰视容量瓶刻度线,会导致溶液的体积偏大,所配制溶液浓度偏低,C项错误;定容摇匀后液面下降为正常现象,如果再加水至刻度线,会导致溶液体积偏大,浓度偏低,D项错误。
答案 A
4.(2018年陕西师大附中期中)下列有关实验原理或操作正确的是( )。
A.用20 mL量筒量取15 mL酒精,加5 mL水,配制质量分数为75%的酒精溶液
B.在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子和NA个金属离子,则该硫酸盐的物质的量浓度为2.5 mol·L-1
C.实验中需用950 mL 2.0 mol·L-1 Na2CO3溶液,配制时选用的容量瓶的规格和称取的Na2CO3的质量分别为950 mL、201.4 g
D.实验室配制500 mL 0.2 mol·L-1硫酸亚铁溶液,其操作是:用天平称15.2 g绿矾(FeSO4·7H2O),放入小烧杯中加水溶解,转移到500 mL容量瓶,洗涤、稀释、定容、摇匀
解析 不能用量筒来配制溶液,应用烧杯,且15 mL酒精的质量不是5 mL水的质量的3倍,A项错误;1.5NA个硫酸根离子的物质的量为1.5 mol,NA个金属阳离子的物质的量为1 mol,设金属离子的化合价为x,根据电荷守恒可知,x=1.5×2=3,故金属阳离子为+3价,所以该硫酸盐可以表示为M2(SO4)3,根据硫酸根离子守恒可知,硫酸盐为0.5 mol,所以该硫酸盐的物质的量浓度为0.5 mol0.2 L=2.5 mol·L-1,B项正确;容量瓶没有950 mL规格,应用1000 mL的容量瓶进行配制,则m(Na2CO3)=cVM=1 L×2 mol·L-1×106 g·mol-1=212 g,C项错误;配制500 mL 0.2 mol·L-1硫酸亚铁溶液,需要绿矾(FeSO4·7H2O)的物质的量为0.5 L×0.2 mol·L-1=0.1 mol,质量为27.8 g,D项错误。
答案 B
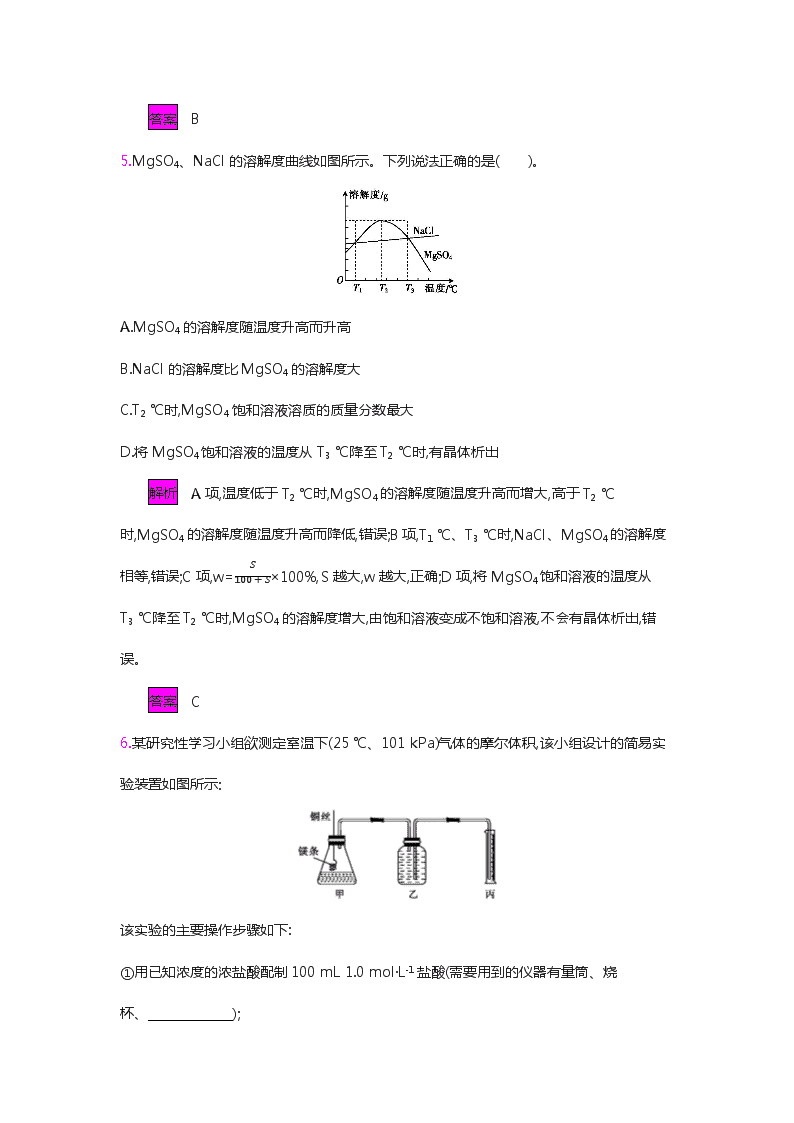
5.MgSO4、NaCl的溶解度曲线如图所示。下列说法正确的是( )。
A.MgSO4的溶解度随温度升高而升高
B.NaCl的溶解度比MgSO4的溶解度大
C.T2 ℃时,MgSO4饱和溶液溶质的质量分数最大
D.将MgSO4饱和溶液的温度从T3 ℃降至T2 ℃时,有晶体析出
解析 A项,温度低于T2 ℃时,MgSO4的溶解度随温度升高而增大,高于T2 ℃时,MgSO4的溶解度随温度升高而降低,错误;B项,T1 ℃、T3 ℃时,NaCl、MgSO4的溶解度相等,错误;C项,w=S100+S×100%,S越大,w越大,正确;D项,将MgSO4饱和溶液的温度从T3 ℃降至T2 ℃时,MgSO4的溶解度增大,由饱和溶液变成不饱和溶液,不会有晶体析出,错误。
答案 C
6.某研究性学习小组欲测定室温下(25 ℃、101 kPa)气体的摩尔体积,该小组设计的简易实验装置如图所示:
该实验的主要操作步骤如下:
①用已知浓度的浓盐酸配制100 mL 1.0 mol·L-1盐酸(需要用到的仪器有量筒、烧杯、 );
②用10 mL的量筒量取8.0 mL 1.0 mol·L-1盐酸加入锥形瓶中;
③准确称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使盐酸全部参加反应,a的数值至少为 ;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请回答下列问题:
(1)步骤①中,配制100 mL 1.0 mol·L-1盐酸时,下列会使所配制溶液的浓度偏小的操作有 (填字母)。
A.用量筒量取浓盐酸时,俯视量筒的刻度线
B.容量瓶未干燥就用来配制溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线未做处理
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯中有少量水
G.未冷却至室温即定容
(2)请填写操作步骤中的空格:
步骤①: ;
步骤③: 。
(3)实验步骤⑤中应选用的量筒规格是 。
(4)读数时需要注意(至少写两点):
。
(5)忽略水蒸气的影响,在该条件下测得气体摩尔体积的计算式为 L·mol-1。
解析 (2)步骤①用浓盐酸配制100 mL 1.0 mol·L-1盐酸时,需用量筒量取浓盐酸,在烧杯中稀释,要用玻璃棒不断搅拌,最后用胶头滴管在100 mL容量瓶中进行定容。步骤③Mg与盐酸发生的反应为Mg+2HClMgCl2+H2↑,8.0 mL 1.0 mol·L-1盐酸中n(HCl)=8.0×10-3 L×1.0 mol·L-1=8.0×10-3 mol,完全反应时消耗的Mg为4.0×10-3 mol,其质量为m(Mg)=4.0×10-3 mol×24 g·mol-1=0.096 g。
(3)8.0×10-3 mol HCl与Mg完全反应放出4.0×10-3 mol H2,其在标准状况下的体积为4.0×10-3 mol×22.4 L·mol-1=0.0896 L=89.6 mL,故应选取规格为100 mL的量筒。
(5)HCl完全反应时生成4.0×10-3 mol H2,实验中收集到V mL H2,则该条件下的气体摩尔体积为Vm=V×10-3L4.0×10-3mol=0.25V L·mol-1。
答案 (1)AC
(2)玻璃棒、100 mL容量瓶、胶头滴管;0.096
(3)100 mL
(4)①恢复到室温再读数;②调节量筒高度,使量筒内液面与集气瓶内液面相平;③读数时视线应与量筒中液体的凹液面最低处保持相平
(5)0.25V
7.(2018年山东莱芜一中检测)在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是 、 。
(2)取这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是 。
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多为 mL。
(4)将1 g不纯的NaOH样品(样品含少量Na2CO3和水),加入50 mL 2 mol·L-1盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1 NaOH溶液。蒸发中和后的溶液,最终得到 g固体。
解析 (1)n(HCl)=224 L22.4 L·mol-1=10 mol,
m(HCl)=10 mol×36.5 g·mol-1=365 g,
盐酸的质量分数w=365 g365 g+635 g×100%=36.5%,
c(HCl)=1000ρwM=1000 mL·L-1×1.18 g·cm-3×36.5%36.5 g·mol-1=11.8 mol·L-1。
(2)由c(浓)·V(浓)=c(稀)·V(稀)可知,
c(稀)=11.8 mol·L-1×0.1 L1.18 L=1 mol·L-1。
(3)n(Na2CO3)=0.040 L×0.065 mol·L-1=0.0026 mol,设加入稀盐酸的体积最多为x mL,则n(HCl)=1 mol·L-1×0.001x L=0.001x mol,根据反应Na2CO3+HClNaHCO3+NaCl得0.0026=0.001x,x=2.6。
(4)经过反应,蒸发中和后的溶液,最后所得固体为NaCl,根据氯原子守恒,n(NaCl)=n(HCl)=0.050 L×2 mol·L-1=0.1 mol,m(NaCl)=0.1 mol×58.5 g·mol-1=5.85 g。
答案 (1)36.5%;11.8 mol·L-1
(2)1 mol·L-1
(3)2.6
(4)5.85
8.(2018年天津静海一中学业能力调研)T ℃时,将a g NH3完全溶于水,得到V mL 溶液,假设该溶液的密度为d g·mL-1,溶质的质量分数为w,其中含 NH4+的物质的量为b mol。下列叙述中正确的是( )。
A.溶质的质量分数w=1000a17V×100%
B.溶质的物质的量浓度c=1000a17V mol·L-1
C.溶液中c(OH-)=1000b17V mol·L-1
D.上述溶液中再加入V mL 水后,所得溶液溶质的质量分数大于0.5w
解析 质量分数=溶质质量溶液质量×100%,该溶液中溶质为NH3,其质量为a g,溶液的质量为Vd g,即溶质的质量分数为aVd×100%,A项错误;溶质的物质的量为a17 mol,溶液的体积为V×10-3 L,根据物质的量浓度的公式,推出c=1000a17V mol·L-1,B项正确;NH3溶于水生成NH3·H2O,NH3·H2O的电离方程式为NH3·H2ONH4++OH-,NH4+的物质的量为b mol,则n(OH-)≈b mol,则c(OH-)≈1000bV mol·L-1,C项错误;稀释过程中溶质的质量不变,即稀释后溶质质量为a g,溶液的质量为(Vd+V) g,则稀释后溶质的质量分数为aVd+V×100%,d<1,则a2Vd>aV(d+1),因此稀释后溶质的质量分数小于原来的一半,D项错误。
答案 B
9.(2018年湖北黄冈质量检测)标准状况下,三个烧瓶分别盛①混有空气的氨气、②等体积的二氧化氮与氧气的混合气、③二氧化氮,将它们分别倒置于盛足量水的水槽中,当水进入烧瓶中,并使气体充分溶解,假定烧瓶中溶液无损失,所得溶液的物质的量浓度之比为( )。
A.5∶4∶5 B.1∶1∶1
C.15∶12∶10 D.无法计算
解析 ①设烧瓶中氨气的体积为a L,n(NH3)=a22.4 mol,将烧瓶倒置在盛足量水的水槽中,由于NH3极易溶于水,空气难溶于水,所得溶液的体积为a
L,因此所得溶液的物质的量浓度为a22.4molaL=122.4 mol·L-1;②设烧瓶的体积为b L,则混合气的体积为b L,NO2、O2等体积混合,NO2、O2的体积都为b2 L,将烧瓶倒置在盛有足量水的水槽中,发生反应3NO2+H2O2HNO3+NO、2NO+O22NO2,总反应可表示为4NO2+O2+2H2O4HNO3,NO2与O2的物质的量之比为4∶1时恰好完全反应,则NO2全部消耗,O2有剩余,生成HNO3的物质的量=n(NO2)=b2L22.4 L·mol-1=b44.8 mol,反应消耗O2的体积为14×b2 L=b8 L,剩余O2的体积为b2 L-b8 L=3b8 L,由于O2难溶于水,所得溶液的体积为b L-3b8 L=5b8 L,因此HNO3溶液的物质的量浓度为b44.8mol5b8L=128 mol·L-1;③设烧瓶的体积为c L,则NO2的体积为c L,n(NO2)=c22.4 mol,将烧瓶倒置在盛有足量水的水槽中,发生反应3NO2+H2O2HNO3+NO,反应生成的HNO3的物质的量n(HNO3)=23n(NO2)=23×c22.4 mol,生成的NO的体积为c3 L,NO难溶于水,所得溶液的体积为c L-c3 L=2c3 L,所得HNO3溶液的物质的量浓度为23×c22.4mol2c3L=122.4 mol·L-1。三个烧瓶中所得溶液物质的量浓度之比为122.4 mol·L-1∶128 mol·L-1∶122.4 mol·L-1=5∶4∶5,A项正确。
答案 A
10.(2018年黑龙江哈尔滨师大附中开学考试)取Cu、Cu2O和CuO固体混合物,将其分成两等份,一份用足量的氢气还原,反应后固体质量减少6.4 g,另一份加入1000 mL稀硝酸,固体恰好完全溶解,收集到标准状况下4.48 L NO气体,所用硝酸的物质的量浓度为( )。
A.3.2 mol·L-1 B.1.6 mol·L-1
C.0.9 mol·L-1 D.无法判断
解析 将Cu2O拆分为Cu、CuO,原混合物看作Cu、CuO的混合物,其中一份用足量的氢气还原,反应后固体质量减少6.40 g,为拆分后Cu、CuO的混合物中O原子的质量,O原子的物质的量为6.4 g16 g·mol-1=0.4 mol,根据O元素守恒可知,n(CuO)=n(O)=0.4 mol
;另一份中加入1000 mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下4.48 L NO气体,NO的物质的量为4.48 L22.4 L·mol-1=0.2 mol,根据电子守恒可知,拆分后Cu、CuO的混合物中2n(Cu)=3n(NO)=3×0.2 mol,n(Cu)=0.3 mol,由铜元素守恒可知,n[Cu(NO3)2]=n(CuO)+n(Cu)=0.4 mol+0.3 mol=0.7 mol,根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.2 mol+2×0.7 mol=1.6 mol,所以该稀硝酸的浓度为1.6 mol1 L=1.6 mol·L-1,B项正确。
答案 B
11.Mg(ClO3)2在农业上可用作脱叶剂、催熟剂。可采用复分解反应制备:MgCl2+2NaClO3Mg(ClO3)2+2NaCl。已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示。下列有关叙述中不正确的是( )。
A.温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大
B.温度越高,Mg(ClO3)2饱和溶液溶质的质量分数越大
C.350 K时,Mg(ClO3)2饱和溶液的物质的量浓度为250 g191 g·mol-1×1 L
D.350 K时,Mg(ClO3)2饱和溶液溶质的质量分数为250 g350 g×100%
解析 由图像可知,Mg(ClO3)2的溶解度随温度的升高而增大,所以温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大,其溶质的质量分数也越大,A、B两项均正确;350 K时,Mg(ClO3)2的溶解度为250 g,则可计算Mg(ClO3)2饱和溶液的物质的量浓度为nV=mMV=250 g191 g·mol-1×250 g+100 gρg·cm-3×10-3L
,由于溶液的密度不确定,故溶液的物质的量浓度不能确定,C项错误;350 K时,Mg(ClO3)2饱和溶液溶质的质量分数为S100+S×100%=250 g350 g×100%,D项正确。
答案 C
12.某同学用NaHCO3和KHCO3组成的混合物进行实验,测得的实验数据(盐酸的物质的量浓度相等)如表所示:
盐酸体积/mL
50
50
50
混合物质量/g
9.2
15.7
27.6
标准状况下CO2体积/L
2.24
3.36
3.36
(1)盐酸的物质的量浓度为 ,若用标准状况下的HCl来配制250 mL该盐酸,需要HCl的体积为 ;若用36.5%、密度为1.17 g·mL-1的浓盐酸配制等量的该盐酸,需要浓盐酸的体积为 (保留两位小数),所需仪器有 。
(2)混合物中NaHCO3的质量分数为 (保留两位小数)。
(3)产生标准状况下3.36 L二氧化碳所需固体混合物的质量为 g。
解析 (1)由表中数据可知,求盐酸的浓度需选择盐酸量不足的一组数据进行计算,随着固体混合物质量的增加,产生二氧化碳气体的量不再增加,表明盐酸已经全部反应完,由H++HCO3-H2O+CO2↑得,c(HCl)=3.36 L22.4 L·mol-10.050 L=3.0 mol·L-1。250 mL 3.0 mol·L-1盐酸中溶质的物质的量为0.75 mol,需标准状况下HCl的体积为0.75 mol×22.4 L·mol-1=16.8 L。需要浓盐酸的体积为0.75 mol×36.5 g·mol-11.17 g·mL-1×36.5%≈64.10 mL。
(2)根据表中第一栏数据可以计算出NaHCO3的质量分数,设n(NaHCO3)为x mol,n(KHCO3)为y mol,则有84x+100y=9.2,x+y=0.1,解得x=y=0.05,NaHCO3的质量为4.2 g,其质量分数为4.2 g9.2 g×100%≈45.65%。
(3)根据固体混合物与气体的比例关系可知,设产生标准状况下3.36 L二氧化碳所需固体混合物的质量为m g,则有9.22.24=m3.36,解得m=13.8。
答案 (1)3.0 mol·L-1;16.8 L;64.10 mL;250 mL容量瓶、烧杯、100 mL量筒、玻璃棒、胶头滴管
(2)45.65%
(3)13.8
13.人体血液中Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,向其中加入适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
Ⅰ.配制KMnO4标准溶液:配制50 mL KMnO4标准溶液的过程如图所示。
(1)请你观察图示判断,其中不正确的操作有 (填序号)。
(2)其中确定50 mL溶液体积的容器是 (填名称)。
(3)如果按图示⑤操作配制溶液,所配制的溶液浓度将 (填“偏大”“偏小”或“无影响”)。
Ⅱ.测定血液样品中Ca2+的浓度:抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸与酸性KMnO4溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+2Mnx++10CO2↑+8H2O,则x= 。
(5)经过计算,血液样品中Ca2+的浓度为 mg·cm-3。
解析 (1)由图可知①②⑤操作不正确。①中药品和砝码位置颠倒了;②不能在量筒中溶解固体;⑤定容时应平视刻度线,至溶液凹液面最低处与刻度线相切。(2)应该用50 mL容量瓶准确测定50 mL溶液的体积。(3)如果按图示⑤操作配制溶液,由于定容时仰视刻度线,会使溶液体积偏大,因此所配制的溶液浓度将偏小。(4)根据电荷守恒,草酸与KMnO4溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+2Mn2++10CO2↑+8H2O。(5)血液样品中Ca2+的浓度为0.020 mol·L-1×12×10-3L×52×40 g·mol-1×103mg·g-120.00 cm3=1.2 mg·cm-3。
答案 (1)①②⑤
(2)50 mL 容量瓶
(3)偏小
(4)2
(5)1.2