- 2.33 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
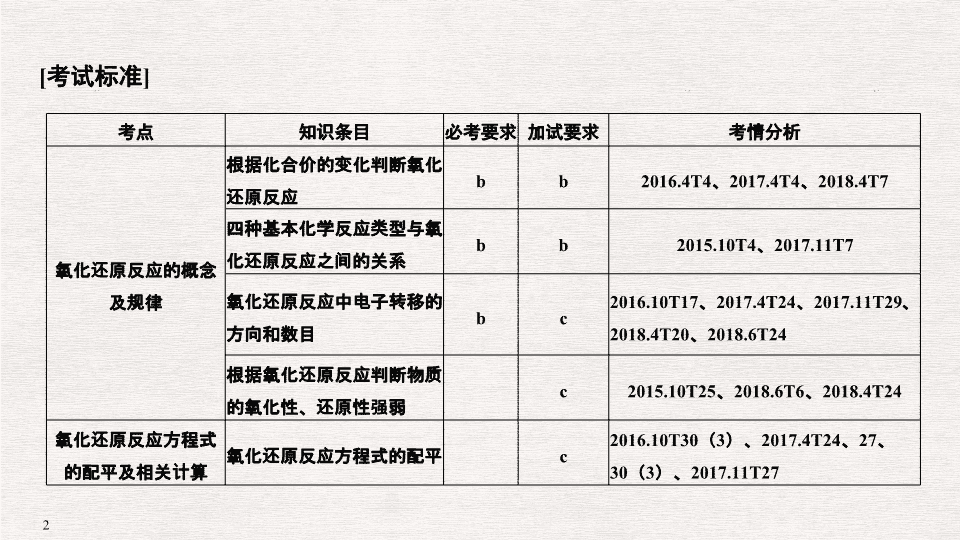
专题四 氧化还原反应
[
考试标准
]
考点
知识条目
必考要求
加试要求
考情分析
氧化还原反应的概念及规律
根据化合价的变化判断氧化还原反应
b
b
2016.4T4
、
2017.4T4
、
2018.4T7
四种基本化学反应类型与氧化还原反应之间的关系
b
b
2015.10T4
、
2017.11T7
氧化还原反应中电子转移的方向和数目
b
c
2016.10T17
、
2017.4T24
、
2017.11T29
、
2018.4T20
、
2018.6T24
根据氧化还原反应判断物质的氧化性、还原性强弱
c
2015.10T25
、
2018.6T6
、
2018.4T24
氧化还原反应方程式的配平及相关计算
氧化还原反应方程式的配平
c
2016.10T30
(
3
)、
2017.4T24
、
27
、
30
(
3
)、
2017.11T27
考点一:氧化还原反应的判断
1.
(
2018·
嘉兴一中高一期末)
下列关于氧化还原反应的说法正确的是( )
A.CH
3
CHO
既有氧化性,又有还原性
B.
反应
BaO
+
H
2
O
2
===BaO
2
+
H
2
O
中,
H
2
O
2
作氧化剂,
BaO
2
为氧化产物
C.
反应
CH
4
+
Cl
2
―→
CH
3
Cl
+
HCl
,既是取代反应、置换反应,也是氧化还原反应
D.
反应
3Cu
+
8HNO
3
===3Cu
(
NO
3
)
2
+
2NO
↑
+
4H
2
O
中,氧化剂与还原剂的物质的量之比为
8
∶
3
解析
A.CH
3
CHO
中的醛基可以与氧气发生催化氧化,也可与氢气发生还原反应,既有氧化性,又有还原性,故
A
正确;
B.
反应
BaO
+
H
2
O
2
===BaO
2
+
H
2
O
中没有元素的化合价发生变化,不属于氧化还原反应,故
B
错误;
C.
反应
CH
4
+
Cl
2
―→
CH
3
Cl
+
HCl
,既是取代反应、也是氧化还原反应,但不属于置换反应,故
C
错误;
D.
反应
3Cu
+
8HNO
3
===3Cu
(
NO
3
)
2
+
2NO
↑
+
4H
2
O
中,氧化剂为硝酸,还原剂为铜,氧化剂与还原剂的物质的量之比为
2
∶
3
,故
D
错误;故选
A
。
答案
A
A.CuFeS
2
中被氧化和被还原的原子数之比为
2
∶
1
B.
该反应中有两种物质作氧化剂
C.
每生成
1 mol SO
2
,反应中转移
6 mol
电子
D.CuFeS
2
中被氧化的元素只有硫
解析
A.Cu
元素由+
2
价降低为+
1
价,
S
元素由-
2
价升高到+
4
价,
CuFeS
2
中
Cu
元素被还原、
S
元素被氧化,且生成
Cu
2
S
、
FeS
时
S
元素的化合价不变,则
CuFeS
2
中被氧化和被还原的原子数目之比为
1
∶
2
,故
A
错误;
B.
反应中
Cu
、
O
元素的化合价降低,两种反应物均作氧化剂,故
B
正确;
C.
由方程式可知,每生成
1 mol SO
2
,有
1 mol
硫被氧化生成
SO
2
,转移电子为
1 mol
×
[4
-(-
2
)
]
=
6 mol
,故
C
正确;
D.Cu
元素由+
2
价降低为+
1
价,
S
元素由-
2
价升高到+
4
价,
CuFeS
2
中
Cu
元素被还原、
S
元素被氧化,故
D
正确。故选
A
。
答案
A
答案
D
考点四:氧化还原反应规律的应用
4.
(
2017·
绍兴新昌中学)
NaNO
2
有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。
(
1
)下列说法正确的是
(填序号)。
A.
解毒剂美蓝应该具有氧化性
B.
中毒时亚硝酸盐发生氧化反应
C.
解毒时高铁血红蛋白被还原
D.
中毒过程中血红蛋白显氧化性
(
2
)已知
NaNO
2
能发生如下反应:
2NaNO
2
+
4HI===2NO
↑
+
I
2
+
2NaI
+
2H
2
O
从上述反应推知
(填序号)。
A.
氧化性:
I
2
>
NaNO
2
B.
氧化性:
NaNO
2
>
I
2
C.
还原性:
HI
>
NO D.
还原性:
I
2
>
HI
(
3
)根据上述反应,可用试纸和生活中常见的物质进行实验来鉴别
NaNO
2
和
NaCl
。现供选用的物质有:
①
白酒
②
碘化钾淀粉试纸
③
淀粉
④
白糖
⑤
食醋,进行本实验时,可以选用的物质至少有
(填序号)。
(
4
)某工厂的废液中含有
2%
~
5%
的
NaNO
2
,直接排放会造成污染。下列试剂中:
①
NaCl
②
NH
4
Cl
③
HNO
3
④
浓
H
2
SO
4
,能使
NaNO
2
转化为
N
2
的是
(填序号)。
解析
(
1
)将正常的血红蛋白变为高铁血红蛋白,使血红蛋白中的铁元素由二价变为三价,说明
NaNO
2
具有氧化性,美蓝是亚硝酸盐中毒的有效解毒剂,应具有还原性,则
A.
解毒剂美蓝应该具有还原性,故
A
错误;
B.
中毒时亚硝酸盐发生还原反应,能使血红蛋白中的铁元素由二价变为三价,故
B
错误;
C.
加入解毒剂美蓝,高铁血红蛋白被还原,故
C
正确;
D.
中毒过程中血红蛋白被氧化,表现出还原性,故
D
错误。(
2
)根据反应
2NaNO
2
+
4HI===2NO
↑
+
I
2
+
2NaI
+
2H
2
O
可知,氧化性:
NaNO
2
>
I
2
,还原性:
HI
>
NO
。(
3
)鉴别
NaNO
2
和
NaCl
,可根据
NaNO
2
在酸性条件下具有氧化性,用淀粉碘化钾试纸来检验,可加入醋酸酸化。(
4
)能使
NaNO
2
转化为
N
2
的应是具有还原性的物质,只有
NH
4
Cl
符合。
答案
(
1
)
C
(
2
)
BC
(
3
)
②⑤
(
4
)
②
考点五:氧化还原反应的有关计算
5.
(
2018·
金华十校高一)
向
100 mL FeI
2
溶液中逐渐通入
Cl
2
,其中
n
(
I
2
)、
n
(
Fe
3
+
)随通入
n
(
Cl
2
)的变化如图所示,下列说法不正确的是( )
A.
氧化性强弱:
I
2
Fe
2
+
,所以氧化性大小关系为
Fe
3
+
>I
2
,
A
正确;
B.
根据图像可知,
n
(
Cl
2
)=
0.12 mol
时,
I
-
已完全转化为
I
2
,
Fe
2
+
部分被氧化,所以溶液中含有的离子主要为
Fe
2
+
、
Fe
3
+
、
Cl
-
,
B
正确;
C.I
-
完全氧化需要消耗
0.1 mol Cl
2
,根据电子守恒可知
I
-
的物质的量为
0.2 mol
,
FeI
2
的物质的量为
0.1 mol
,所以
FeI
2
溶液的浓度为
1 mol· L
-
1
,
C
正确;
D.
n
(
Cl
2
)
∶
n
(
FeI
2
)=
1
∶
2
时,设
Cl
2
为
1 mol
,提供
2 mol
电子,
I
-
的还原性大于
Fe
2
+
的还原性,
Cl
2
先与
I
-
反应且可以氧化
2 mol I
-
,
I
-
未完全氧化,所以对应的离子方程式为
2I
-
+
Cl
2
===2Cl
-
+
I
2
,
D
错误。正确答案为
D
。
答案
D
答案
B
易错点一 不能准确判断氧化剂、还原剂、氧化产物和还原产物
[
易错训练
1]
(
2017·
嘉兴市高一期末)
化合物
Q
是一种具有耐高温等优异性能的新型陶瓷。工业上可用以下方法制取:
答案 (
1
)
Si
3
N
4
(
2
)
C
(
3
)
70
易错点二 不能准确判断物质氧化性和还原性的相对强弱及其应用
氧化性:氧化剂
>
氧化产物
还原性:还原剂
>
还原产物
[
易错训练
2]
常温下,在溶液中可发生以下反应:
①
2Fe
2
+
+
Br
2
===2Fe
3
+
+
2Br
-
,
②
2Br
-
+
Cl
2
===Br
2
+
2Cl
-
,
③
2Fe
3
+
+
2I
-
===2Fe
2
+
+
I
2
;
由此判断下列说法错误的是( )
A.
铁元素在反应
①
和
③
中均被氧化
B.
反应
②
中当有
1 mol Cl
2
被还原时,有
2 mol Br
-
被氧化
C.
氧化性强弱顺序为
Cl
2
>
Br
2
>
Fe
3
+
>
I
2
D.
还原性强弱顺序为
I
-
>
Fe
2
+
>
Br
-
>
Cl
-
解析
选项
A
,反应
①
中
Fe
2
+
作还原剂,在反应中被氧化,反应
③
中
Fe
3
+
作氧化剂,在反应中被还原,
A
不正确;反应
②
中
Cl
2
作氧化剂,当
1 mol Cl
2
被还原时,有
2 mol Br
-
被氧化,
B
正确;由反应
①
可知,氧化性
Br
2
>
Fe
3
+
,还原性
Fe
2
+
>
Br
-
;由反应
②
可知,氧化性:
Cl
2
>
Br
2
,还原性
Br
-
>
Cl
-
,由反应
③
可知,氧化性
Fe
3
+
>I
2
,还原性,
I
-
>
Fe
2
+
,故
C
、
D
正确。
答案
A
易错点三 不会利用转移电子数守恒规律进行相关计算
应用电子守恒解题的一般步骤为(
1
)找出氧化剂、还原剂及相应的还原产物和氧化产物;(
2
)找准一个原子或离子得失电子数(注意化学式中粒子的个数);(
3
)根据题中物质的物质的量和得失电子守恒列出关系式:
n
(氧化剂)
×
变价原子个数
×
化合价变化值(高价-低价)=
n
(还原剂)
×
变价原子个数
×
化合价变化值(高价-低价)。
[
易错训练
3]
(
2018·
浙江诸暨中学模拟)
ClO
2
是一种广谱型的消毒剂,根据世界环保联盟的要求,
ClO
2
将逐渐取代
Cl
2
成为生产自来水的消毒剂。工业上
ClO
2
常用
NaClO
3
和
Na
2
SO
3
溶液混合并加
H
2
SO
4
酸化后反应制得,其中
Na
2
SO
3
被氧化为
Na
2
SO
4
。在以上反应中,
NaClO
3
和
Na
2
SO
3
的物质的量之比为( )
A.1
∶
1 B.2
∶
1
C.1
∶
2 D.2
∶
3
解析
NaClO
3
和
Na
2
SO
3
溶液混合并加
H
2
SO
4
酸化后反应过程中,氯元素化合价从+
5
价降到+
4
价,降低了
1
价,硫元素化合价从+
4
价升高到+
6
价,升高了
2
价,化合价升高数和化合价降低数相等,所以
NaClO
3
和
Na
2
SO
3
的物质的量之比为
2
∶
1
。故选
B
。
答案
B
[
易错训练
4]
(
2018·
浙江湖州三县联考)
H
3
PO
2
是精细磷化工产品。工业制备原理如下:
(
Ⅰ
)
2P
4
+
3Ba
(
OH
)
2
+
6H
2
O===3Ba
(
H
2
PO
2
)
2
+
2PH
3
↑
(
Ⅱ
)
Ba
(
H
2
PO
2
)
2
+
H
2
SO
4
===BaSO
4
↓
+
2H
3
PO
2
下列推断不正确的是( )
A.
反应
Ⅰ
是氧化还原反应,反应
Ⅱ
是非氧化还原反应
B.H
3
PO
2
具有强还原性,在空气中可能被氧化成磷酸
C.
在反应
Ⅰ
中氧化剂与还原剂的质量之比为
1
∶
1
D.
在标准状况下生成
2.24 L PH
3
,上述反应转移
0.3 mol
电子
答案
C