- 757.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1.科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为______________。
(2)下列关于CH4和CO2的说法正确的是______(填序号)。
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为________________,该元素位于元素周期表中的第________族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4中含有________mol σ键。
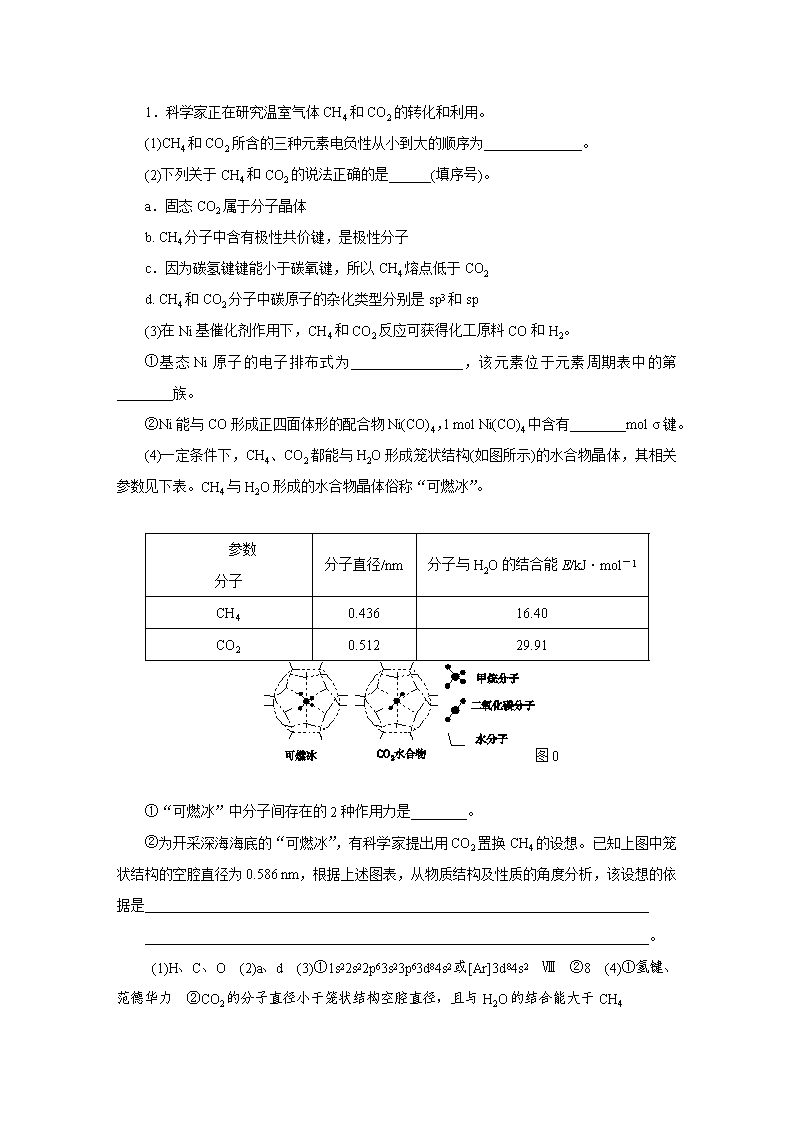
(4)一定条件下,CH4、CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
参数
分子
分子直径/nm
分子与H2O的结合能E/kJ·mol-1
CH4
0.436
16.40
CO2
0.512
29.91
图0
①“可燃冰”中分子间存在的2种作用力是________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是________________________________________________________________________
________________________________________________________________________。
(1)H、C、O (2)a、d (3)①1s22s22p63s23p63d84s2或[Ar]3d84s2 Ⅷ ②8 (4)①氢键、范德华力 ②CO2的分子直径小于笼状结构空腔直径,且与H2O的结合能大于CH4
[解析] (1)元素的非金属性越强,其电负性越大,故三种元素中氧的电负性最大,氢的电负性最小,因此电负性从小到大的顺序为H、C、O。 (2)固态CO2常温下是气体,是由分子间的作用力形成的分子晶体,a项正确;甲烷分子中含极性共价键,但空间结构是正四面体分子,属于非极性分子,b项错误;CH4、CO2均属于分子晶体,物质熔点高低由分子间作用力的大小决定,与化学键强弱无关,c项错误;CH4分子中碳原子形成了4个σ键,属于sp3杂化,CO2分子中碳原子与2个氧原子形成了2个σ键且无孤电子对,属于sp杂化,d项正确。(3)Ni(CO)4中,Ni与CO是σ键,共有4个,CO中碳氧原子间有1个σ键,故1 mol Ni(CO)4中共有8 mol σ键。(4) 可燃冰中水分子间存在氢键,甲烷分子间、水分子之间及甲烷与水分子间还存在分子间作用力。由题中信息知,CO2分子直径小于笼状结构的空腔直径,故CO2可置于空腔中,又CO2分子与水分子结合释放出的能量更多一些,故形成的相应物质比可燃冰稳定一些。
2. A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是________(填元素符号),其中C原子的核外电子排布式为__________________。
(2)单质A有两种同素异形体,其中沸点高的是______(填分子式),原因是__________________________________________;A和B的氢化物所属的晶体类型分别为________和________。
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为______________,中心原子的杂化轨道类型为________。
(4)化合物D2A的立体构型为________,中心原子的价层电子对数为________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为____________________________________________________________________。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566 nm,F的化学式为________;晶胞中A原子的配位数为________;列式计算晶体F的密度(g·cm-3 )________________________________。
图0
(1)O 1s22s22p63s23p3(或[Ne]3s23p3)
(2)O3 O3相对分子质量较大,范德华力大 分子晶体 离子晶体
(3)三角锥形 sp3
(4)V形 4
2Cl2+2Na2CO3+H2O===Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3===Cl2O+CO2+2NaCl)
(5)Na2O 8 =2.27 g·cm-3
[解析] 根据题中信息可确定A、B、C、D分别为O、Na、P和Cl。(1)电负性最大的元素即非金属性最强的元素,即O的电负性最大。根据P原子的结构示意图可写出核外电子排布式。(2)由于相对分子质量O3>O2,故O3沸点较高;H2O和NaH的晶体分别为分子晶体和离子晶体。(3)PCl3中含有3个成键电子对和1个孤对电子,价层电子对数为4对,即空间结构为三角锥形,中心原子P原子为sp3杂化。(4)根据价层电子对互斥理论可知Cl2O分子中孤对电子对数为2,即Cl2O为V形分子,价层电子对数为4。(5)该晶胞中两原子个数分别为×8+×6=4和8,即F的化学式为Na2O,位于晶胞顶点和面心的原子为O,而晶胞内部的原子为Na,O原子周围有8个等距离的Na原子,即O原子配位数为8。根据(0.566×10-7cm)3ρ=×62 g·mol-1可求出ρ。
3.碳及其化合物广泛存在于自然界中。回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用________形象化描述。在基态14C原子中,核外存在________对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是_________________________________________________
________________________________________________________________________。
(3)CS2
分子中,共价键的类型有________,C原子的杂化轨道类型是________,写出两个与CS2具有相同空间构型和键合形式的分子或离子:________。
(4)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为376 K,其固体属于________晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
图0
①在石墨烯晶体中,每个C原子连接________个六元环,每个六元环占有________个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接________个六元环,六元环中最多有________个C原子在同一平面。
(1) 电子云 2
(2)C有4个价电子且半径小,难以通过得失电子达到稳定电子结构
(3)σ键和π键 sp CO2 、SCN-(或COS等)
(4)分子 (5) ①3 2 ②12 4
[解析] (1)电子云图常用来形象地表示电子在原子核外空间出现的几率大小;C原子核外1s轨道、2s轨道各有一对自旋相反的成对电子,2p轨道有两个自旋方向相同的单电子。
(2)碳原子最外层有4个电子,不容易完全失去4个电子形成2电子的稳定结构,也不易完全得到4个电子,形成8电子稳定结构,所以更多的是与其他电子形成共价键。
(3)CS2结构式为S===C===S,其中化学键从成键元素角度理解为极性键;从共用电子对数目角度理解为双键;从电子云重叠方式理解为σ键和π键。题目考查含有的化学键类型应为σ键和π键;CS2中C原子价层电子对数目为=2,C原子的杂化轨道类型为sp杂化;据等电子体理论可知与CS2具有相同空间构型和键合形式的分子或离子可为CO2 等。
(4)该化合物熔沸点都较低,应为分子晶体。
(5)①
石墨烯为平面结构,每个碳原子周围有3条单键,每两条相邻单键在一个环内,则每个C原子连接3个六元环,每个环内有6×=2个碳原子;
②金刚石晶体为空间立体网状结构,每个碳原子周围有4条单键,每两条相邻单键参与形成三个六元环,即每个C原子连接12个六元环,每个环内最多有4个C原子共平面。
4. X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。X和R属同族元素;Z和U位于第ⅦA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。
请回答下列问题:
(1)R基态原子的电子排布式是______________________。
(2)利用价层电子对互斥理论判断TU3的立体构型是________。
(3)X所在周期元素最高价氧化物对应的水化物中,酸性最强的是________(填化学式);Z和U的氢化物中沸点较高的是________(填化学式);Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是____________(填化学式)。
(4)CuSO4溶液能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是____________________________。
(1)1s22s22p63s23p2或[Ne]3s23p2 (2)三角锥形
(3)HNO3 HF Si、Mg、Cl2 (4) P4+10CuSO4+16H2O===10Cu+4H3PO4+10H2SO4
[解析] Z和U位于第ⅦA族,故Z为F元素,U为Cl元素;X和Z可形成化合物XZ4,则X为C元素;X和R属同族元素,则R为Si元素;Q基态原子的s轨道和p轨道的电子总数相等,则Q为Mg元素;T的一种单质在空气中能够自燃,则T为P元素。(1)R为Si元素,原子序数为14,故其基态原子的电子排布式是1s22s22p63s23p2或[Ne]3s23p2。(2)PCl3的价层电子对数为(5+3)÷2=4,除形成三条P-Cl σ键,还有一对孤电子对,受孤电子对的排斥,PCl3为三角锥形。(3)与碳同一周期,非金属性强弱顺序为F>O>N,因F、O无正化合价,故最高价氧化物的水化物酸性最强的是HNO3。HF、HCl中因HF能够形成分子间氢键,沸点高于HCl。Si形成的晶体是原子晶体,Mg是金属晶体,Cl2形成的晶体是分子晶体,故熔点由高到低的顺序为Si、Mg、Cl2。(4) P的最高价含氧酸为H3PO4,则CuSO4溶液与P4反应的化学方程式为P4+10CuSO4+16H2O===10Cu+4H3PO4+10H2SO4。
5.A1、A2、N2[2015·四川卷] 设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.2.0 g HO与D2O的混合物中所含中子数为NA
B.常温常压下,4.4 g乙醛所含σ键数目为0.7NA
C.标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA
D.50 mL 12 mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
5.A [解析] HO和D2O的相对分子质量都为20,而中子数都为10,故2.0 g混合物中含有的中子数为NA,A项正确;乙醛的结构式为CHHHCOH,分子中存在6条σ键,因此4.4 g(即0.1 mol)乙醛中含有σ键的数目为0.6NA,B项错误;CO2与Na2O2发生反应的方程式为2CO2+2Na2O2===2Na2CO3+O2,每有2 mol CO2参加反应转移2 mol电子,故5.6 L CO2(即0.25 mol)CO2参加反应转移0.25NA电子,C项错误;随着反应的进行,盐酸的浓度越来越小,二氧化锰和稀盐酸不再发生反应,故转移的电子数小于0.3NA,D项错误。
6.氟在自然界中常以CaF2的形式存在。
(1)下列有关CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是________________________________________________(用离子方程式表示)。
已知:AlF在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1 。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
(1)b、d (2)3CaF2+Al3+===3Ca2++AlF (3)V形 sp3 (4)172 低
[解析] (1)CaF2是离子化合物,阴阳离子间既存在静电吸引作用,又存在静电排斥作用,a项错误;熔点与晶格能有关,晶格能与离子半径成反比,b项正确;离子个数比相同的晶体,晶体结构不一定相同,c项错误;离子晶体在熔融状态下可以电离,d项正确。(2)CaF2中存在沉淀溶解平衡:CaF2(s)Ca2+(aq)+2F-(aq),溶液中的F-与Al3+形成配位离子AlF,使沉淀溶解平衡向右移动,导致氟化钙溶解,总反应方程式为3CaF2+Al3+===3Ca2++AlF。(3)O原子的杂化轨道数目为(6+2)÷2=4,故氧原子杂化类型为sp3
,因氧原子有两对孤对电子,根据价层电子对互斥理论可知OF2分子构型为V形。(4)根据反应:Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ/mol,反应中Q吸=3×159 kJ/mol+242 kJ/mol=719 kJ/mol,Q放=719 kJ/mol+313 kJ/mol=1032 kJ/mol,故Cl-F键的平均键能=1032 kJ/mol÷6=172 kJ/mol。通常情况下,结构相似的分子晶体,相对分子质量越大,沸点越高,故ClF3的沸点比BrF3低。
7. X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。X和R属同族元素;Z和U位于第ⅦA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。
请回答下列问题:
(1)R基态原子的电子排布式是______________________。
(2)利用价层电子对互斥理论判断TU3的立体构型是________。
(3)X所在周期元素最高价氧化物对应的水化物中,酸性最强的是________(填化学式);Z和U的氢化物中沸点较高的是________(填化学式);Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是____________(填化学式)。
(4)CuSO4溶液能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是____________________________。
(1)1s22s22p63s23p2或[Ne]3s23p2 (2)三角锥形
(3)HNO3 HF Si、Mg、Cl2 (4) P4+10CuSO4+16H2O===10Cu+4H3PO4+10H2SO4
[解析] Z和U位于第ⅦA族,故Z为F元素,U为Cl元素;X和Z可形成化合物XZ4,则X为C元素;X和R属同族元素,则R为Si元素;Q基态原子的s轨道和p轨道的电子总数相等,则Q为Mg元素;T的一种单质在空气中能够自燃,则T为P元素。(1)R为Si元素,原子序数为14,故其基态原子的电子排布式是1s22s22p63s23p2或[Ne]3s23p2。(2)PCl3的价层电子对数为(5+3)÷2=4,除形成三条P-Cl σ键,还有一对孤电子对,受孤电子对的排斥,PCl3为三角锥形。(3)与碳同一周期,非金属性强弱顺序为F>O>N,因F、O无正化合价,故最高价氧化物的水化物酸性最强的是HNO3。HF、HCl中因HF能够形成分子间氢键,沸点高于HCl。Si形成的晶体是原子晶体,Mg是金属晶体,Cl2形成的晶体是分子晶体,故熔点由高到低的顺序为Si、Mg、Cl2。(4) P的最高价含氧酸为H3PO4,则CuSO4溶液与P4反应的化学方程式为P4+10CuSO4+16H2O===10Cu+4H3PO4+10H2SO4。
8. A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,
C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是________(填元素符号),其中C原子的核外电子排布式为__________________。
(2)单质A有两种同素异形体,其中沸点高的是______(填分子式),原因是__________________________________________;A和B的氢化物所属的晶体类型分别为________和________。
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为______________,中心原子的杂化轨道类型为________。
(4)化合物D2A的立体构型为________,中心原子的价层电子对数为________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为____________________________________________________________________。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566 nm,F的化学式为________;晶胞中A原子的配位数为________;列式计算晶体F的密度(g·cm-3 )________________________________。
图0
(1)O 1s22s22p63s23p3(或[Ne]3s23p3)
(2)O3 O3相对分子质量较大,范德华力大 分子晶体 离子晶体
(3)三角锥形 sp3
(4)V形 4
2Cl2+2Na2CO3+H2O===Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3===Cl2O+CO2+2NaCl)
(5)Na2O 8 =2.27 g·cm-3
[解析] 根据题中信息可确定A、B、C、D分别为O、Na、P和Cl。(1)电负性最大的元素即非金属性最强的元素,即O的电负性最大。根据P原子的结构示意图可写出核外电子排布式。(2)由于相对分子质量O3>O2,故O3沸点较高;H2O
和NaH的晶体分别为分子晶体和离子晶体。(3)PCl3中含有3个成键电子对和1个孤对电子,价层电子对数为4对,即空间结构为三角锥形,中心原子P原子为sp3杂化。(4)根据价层电子对互斥理论可知Cl2O分子中孤对电子对数为2,即Cl2O为V形分子,价层电子对数为4。(5)该晶胞中两原子个数分别为×8+×6=4和8,即F的化学式为Na2O,位于晶胞顶点和面心的原子为O,而晶胞内部的原子为Na,O原子周围有8个等距离的Na原子,即O原子配位数为8。根据(0.566×10-7cm)3ρ=×62 g·mol-1可求出ρ。
9.氟在自然界中常以CaF2的形式存在。
(1)下列有关CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是________________________________________________(用离子方程式表示)。
已知:AlF在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1 。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
(1)b、d (2)3CaF2+Al3+===3Ca2++AlF (3)V形 sp3 (4)172 低
[解析] (1)CaF2是离子化合物,阴阳离子间既存在静电吸引作用,又存在静电排斥作用,a项错误;熔点与晶格能有关,晶格能与离子半径成反比,b项正确;离子个数比相同的晶体,晶体结构不一定相同,c项错误;离子晶体在熔融状态下可以电离,d项正确。(2)CaF2中存在沉淀溶解平衡:CaF2(s)Ca2+(aq)+2F-(aq),溶液中的F-与Al3+形成配位离子AlF,使沉淀溶解平衡向右移动,导致氟化钙溶解,总反应方程式为3CaF2+Al3+===3Ca2++AlF。(3)O原子的杂化轨道数目为(6+2)÷2=4,故氧原子杂化类型为sp3,因氧原子有两对孤对电子,根据价层电子对互斥理论可知OF2分子构型为V形。(4)根据反应:Cl2(g)+
3F2(g)===2ClF3(g) ΔH=-313 kJ/mol,反应中Q吸=3×159 kJ/mol+242 kJ/mol=719 kJ/mol,Q放=719 kJ/mol+313 kJ/mol=1032 kJ/mol,故Cl-F键的平均键能=1032 kJ/mol÷6=172 kJ/mol。通常情况下,结构相似的分子晶体,相对分子质量越大,沸点越高,故ClF3的沸点比BrF3低。