- 127.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
电离平衡
第一节
(
第二课时
)
可逆反应有什么特征?化学平衡有什么特征?
若在纯水滴加冰醋酸,试分析一下所形成的水溶液中发生哪些变化?
以醋酸为例,研究弱电解质的电离过程中实质上包含着哪几个过程?
弱电解质的电离过程中包含
:
(
1
)
分子电离成离子;
(
2
)
离子结合成分子。
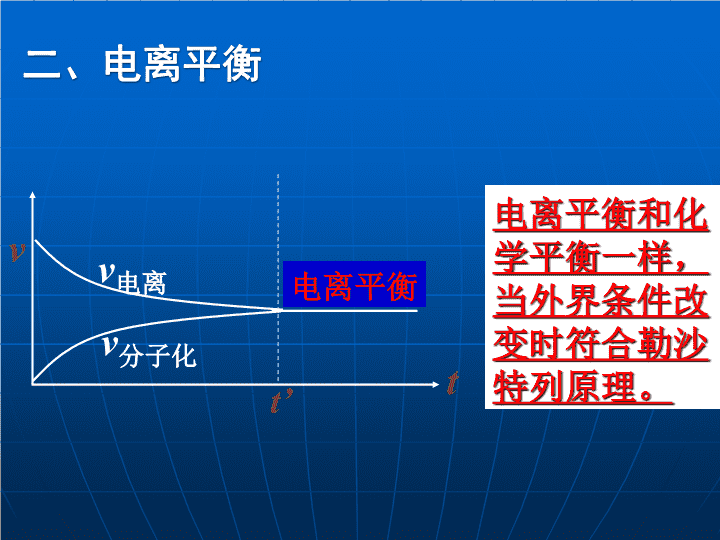
二、电离平衡
v
t’
t
v
电离
v
分子化
电离平衡
电离平衡和化学平衡一样,当外界条件改变时符合勒沙特列原理。
影响电离平衡有哪些因素
(
1
)温度
电离过程是吸热过程,平衡温度升高向电离方向移动。
(
2
)浓度
浓度越大,电离程度越小。
(
3
)其他因素
讨论:
1
、
在盐酸中加少量
NaCl
固体,在醋酸溶液中加少量
NaAc
固体,将分别对两种酸的电离有怎样的影响?
2
、在
0.1mol/L
醋酸溶液分别:加热、加入少量盐酸、加入少量氢氧化钠、加入醋酸铵晶体,电离平衡会怎样移动?溶液中
c
(H
+
)
怎样变化?
3
、强电解质溶液中有无可能存在电离平衡?
问题:
怎样定量的比较弱电解质的相对强弱?电离程度相对大小怎么比较?
三、
电离平衡常数(
K
)
看课本自学相关内容并思考:
(
1
)什么叫电离平衡常数?
(
2
)电离平衡常数的化学含义是什么?
(
3
)怎样用电离平衡常数比较弱电解质的相对强弱?
(
4
)影响电离平衡常数的因素是什么?
弱电解质电离程度相对大小的参数
一
电离平衡常数(
K
)
对于一元弱酸
HA H
+
+A
-
,
平衡时
K
a
=
c
( H
+
)
.
c
( A
-
)
c
(HA)
对于一元弱碱
MOH M
+
+OH
-
,
平衡时
K
b
=
c
(
M
+
)
.
c
( OH
-
)
c
(MOH)
意义:
K
值越大,电离程度越大,相应酸
(
或碱
)
的酸
(
或碱
)
性越强。
K
值只随温度变化。
已知多元弱酸在水溶液中的电离是分步的
。
例
:
H
2
CO
3
H
+
+HCO
3
-
一
(1)
HCO
3
-
H
+
+CO
3
2-
一
(2)
每一步的电离程度是不一样的。
(9)
写出
H
3
PO
4
在水溶液中的电离方程式。
H
3
PO
4
H
+
+ H
2
PO
4
-
一
(1)
H
2
PO
4
-
H
+
+ HPO
4
2
-
一
(2)
HPO
4
2
-
H
+
+ PO
4
3
-
一
(3)
就
电离本身而言,你推测每一步的电离程度如何变化,为什么?
对于多元酸:
多元弱酸是分步电离的,
K
1
》K
2
(一般要相差
10
5
)。
多元弱酸的酸性由第一步电离决定。
试根据课本中“一些弱酸和弱碱的电离平衡常数”比较它们的相对强弱。
弱电解质电离程度相对大小的另一种参数
-------
电离度
α
α
=
已电离的分子数
弱电解质分子总数
讨论:根据 以上定义式,你还能得出哪些计算
α
的关系式?
相关文档
- 2021届高考化学一轮复习生命中的基2021-07-087页
- 2019届二轮复习热化学方程式的书写2021-07-086页
- 2020_2021学年高中化学专题十一元2021-07-086页
- 许昌市三校联考高二下期第一次考试2021-07-0810页
- 【化学】浙江省杭州市西湖高级中学2021-07-0819页
- 高中化学学习方法2021-07-083页
- 【化学】陕西省咸阳市永寿县中学202021-07-085页
- 2020届二轮复习物质的组成和分类化2021-07-0810页
- 新课标同步导学高一化学课件:第二章2021-07-0857页
- 2020届高考化学二轮复习铁、铜及其2021-07-0829页