- 364.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
跟踪检测(三十七) 难点专攻——图像中的反应速率与化学平衡
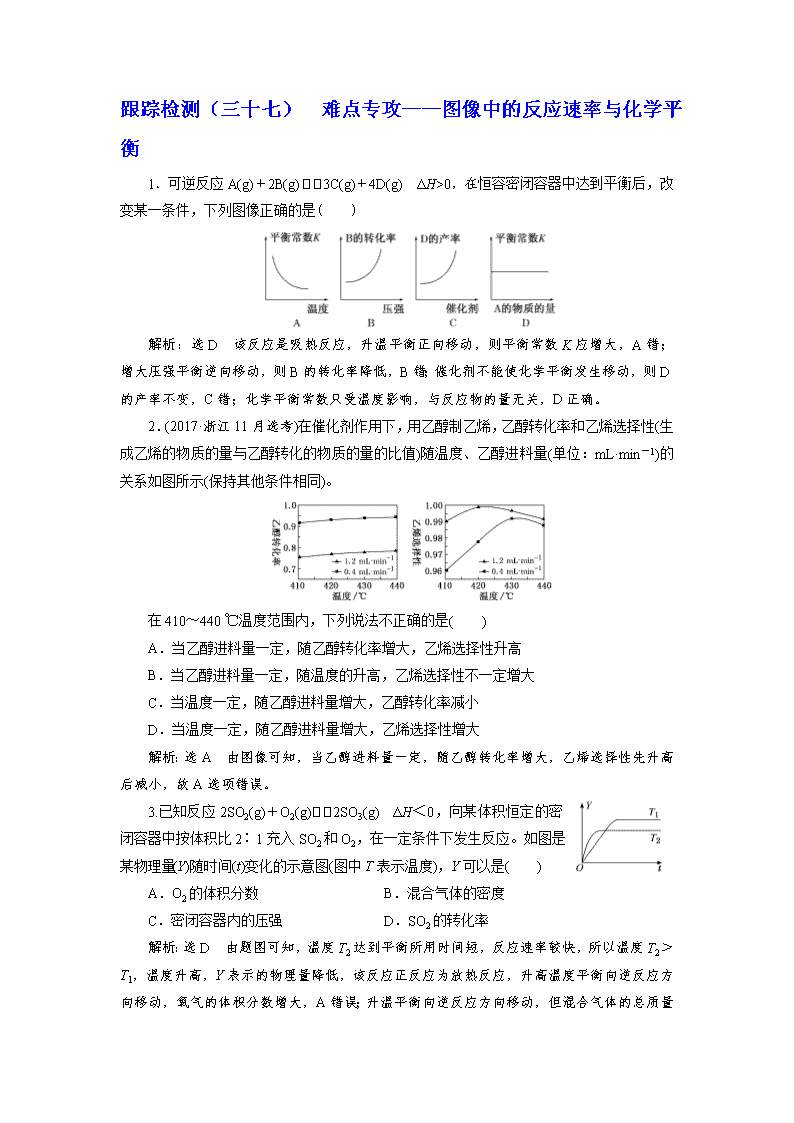
1.可逆反应A(g)+2B(g)3C(g)+4D(g) ΔH>0,在恒容密闭容器中达到平衡后,改变某一条件,下列图像正确的是( )
解析:选D 该反应是吸热反应,升温平衡正向移动,则平衡常数K应增大,A错;增大压强平衡逆向移动,则B的转化率降低,B错;催化剂不能使化学平衡发生移动,则D的产率不变,C错;化学平衡常数只受温度影响,与反应物的量无关,D正确。
2.(2017·浙江11月选考)在催化剂作用下,用乙醇制乙烯,乙醇转化率和乙烯选择性(生成乙烯的物质的量与乙醇转化的物质的量的比值)随温度、乙醇进料量(单位:mL·min-1)的关系如图所示(保持其他条件相同)。
在410~440 ℃温度范围内,下列说法不正确的是( )
A.当乙醇进料量一定,随乙醇转化率增大,乙烯选择性升高
B.当乙醇进料量一定,随温度的升高,乙烯选择性不一定增大
C.当温度一定,随乙醇进料量增大,乙醇转化率减小
D.当温度一定,随乙醇进料量增大,乙烯选择性增大
解析:选A 由图像可知,当乙醇进料量一定,随乙醇转化率增大,乙烯选择性先升高后减小,故A选项错误。
3.已知反应2SO2(g)+O2(g)2SO3(g) ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。如图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是( )
A.O2的体积分数 B.混合气体的密度
C.密闭容器内的压强 D.SO2的转化率
解析:选D 由题图可知,温度T2达到平衡所用时间短,反应速率较快,所以温度T2>T1,温度升高,Y
表示的物理量降低,该反应正反应为放热反应,升高温度平衡向逆反应方向移动,氧气的体积分数增大,A错误;升温平衡向逆反应方向移动,但混合气体的总质量不变,容器的体积不变,混合气体的密度不变,B错误;升温平衡向逆反应方向移动,混合气体的总的物质的量增大,容器的体积不变,容器的压强增大,C错误;升温平衡向逆反应方向移动,SO2的转化率降低,D正确。
4.在密闭容器中进行反应:A(g)+3B(g)2C(g),下列有关图像的说法不正确的是( )
A.依据图a可判断正反应为放热反应
B.在图b中,虚线可表示使用了催化剂时的变化情况
C.若ΔH<0,图c可表示升高温度使平衡向逆反应方向移动
D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应吸热
解析:选D 根据图a曲线可知,温度越高,逆反应速率越大,故升高温度平衡逆向移动,正反应为放热反应,A项正确;催化剂能加快反应速率,缩短达到平衡所用的时间,但不能使平衡发生移动,B项正确;升高温度,平衡向吸热方向移动,C项正确;根据图像曲线可知,温度越高,混合气体的平均相对分子质量减小,故升高温度平衡逆向移动,因此可判断正反应为放热反应,D项错误。
5.已知某密闭容器中存在下列平衡:CO(g)+H2O(g)CO2(g)+H2(g),CO2的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是( )
A.平衡状态a与c相比,平衡状态a的c(CO)较小
B.在T2时,d点的反应速率:v(逆)>v(正)
C.反应CO(g)+H2O(g)CO2(g)+H2(g)的ΔH>0
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
解析:选A 平衡状态a与c相比,c点温度高,升高温度,平衡向正反应方向移动,CO浓度减小,所以a点CO浓度较大,故A错误;T2时反应进行到d点,c(CO2)高于平衡浓度,故反应向逆反应方向进行,则一定有v(逆)>v(正),故B正确;由题图可知,温度越高平衡时c(CO2)越大,说明升高温度,平衡向正反应方向移动,即ΔH>0,故C正确;该反应正反应是吸热反应,升高温度平衡向正反应方向移动,化学平衡常数增大,则K10 ,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
选项
x
y
A
压强
CO2与CO的物质的量之比
B
温度
容器内混合气体的密度
C
MgSO4的质量(忽略体积)
CO的转化率
D
SO2的浓度
平衡常数K
解析:选B 增大压强平衡左移,CO2的物质的量减小,而CO的物质的量增大,减小,故A错误;若x是温度,y是容器内混合气体的密度,升高温度,平衡向吸热反应方向即正反应方向移动,气体的质量增大,容器体积不变,则容器内气体密度增大,所以符合图像,故B正确;若x是MgSO4的质量,y是CO的转化率,MgSO4是固体,其质量不影响平衡移动,所以增大MgSO4的质量,CO的转化率不变,故C错误;若x是SO2的浓度,y是平衡常数,平衡常数只与温度有关,与物质浓度无关,增大SO2浓度,温度不变,平衡常数不变,故D错误。
11.反应mA(s)+nB(g)pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率 ③x点比y点时的反应速率慢 ④n>p
A.①② B.②④
C.②③ D.①③
解析:选C 由图像的曲线变化特征可以看出,增大压强,B的百分含量增大,说明平衡向逆反应方向移动,A为固态,则有n<p,m+n与p关系不能确定,故①、④错误;x点位于曲线上方,未达到平衡状态,由图像可以看出,当B的含量减小时,可趋向于平衡,则应是向正反应方向移动,即v正>v逆,故②正确;由图像可以看出x点的压强小于y点压强,压强越大,反应速率越大,故x点比y点的反应速率慢,故③正确。
12.二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断正确的是( )
A.在0~50 min之间,R的降解百分率pH=2大于pH=7
B.溶液酸性越强,R的降解速率越大
C.R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响
D.在20~25 min之间,pH=10时R的降解速率为0.04 mol·L-1·min-1
解析:选B A项,在0~50 min之间,pH=2和pH=7时反应物R都能完全反应,降解率都是100%,错误;B项,由斜率可知pH越小降解速率越大,即溶液的酸性越强,R的降解速率越大,正确;C项,浓度越大化学反应速率越大,所以起始浓度越小降解速率越小,错误;D项,20~25 min之间,pH=10时R的平均降解速率为0.04×10-4 mol·L-1·min-1,错误。
13.氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质物质的量浓度变化如图1所示,回答下列问题:
图1 图2
(1)计算反应在第一次平衡时的平衡常数K=__________(保留两位小数)。
(2)产物NH3在5~10 min、25~30 min和45~50 min时平均反应速率(平均反应速率分别以v1、v2、v3表示)从大到小排列次序为____________。
(3)H2在三次平衡阶段的平衡转化率分别以α1、α2、α3表示,其中最小的是____________。
(4)由第一次平衡到第二次平衡,平衡移动的方向是____________,采取的措施是____________。
(5)请在图2中用实线表示25~60 min各阶段化学平衡常数K的变化图像。
解析:(1)第一次达到平衡常数时,氨气的浓度为2.00 mol·L-1,氢气浓度为3.00 mol·L-1,氮气的浓度为1.00 mol·L-1,第一次平衡时平衡常数K=≈0.15;(2)由图可知,5~10 min氨气的浓度变化大于0.5 mol·L-1,25~30 min氨气浓度变化约为0.5 mol·L-1,45~50 min氨气的浓度变化为(1.0-0.76)mol·L-1=0.24 mol·L-1,时间变化均为5 min,由v=可知,反应速率关系为v1>v2>v3;(3)第一次平衡时氢气的转化率为×100%=50%,第二次平衡时氢气的转化率为×100%=38%,第三次达到平衡时氢气的转化率为×100%≈19.4%,显然第三次氢气的转化率最低,即最小的是α3;(4)25 min时生成物氨气的物质的量浓度为0、氮气和氢气的浓度逐渐减小,说明从反应体系中移出产物氨气,平衡向着正向移动;(5)25 min时从浓度时间图像看,是移走氨气,反应的温度没有改变,故25 min~45 min内平衡常数没有改变;45 min时平衡向正方向进行,各物质的浓度都在原来基础上发生变化,只有降低温度,才会出现此种情况,平衡常数变大。
答案:(1)0.15 (2)v1>v2>v3 (3)α3
(4)正反应方向移动 移走生成物NH3
(5)
14.(2018·浙江4月选考)(一)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图1所示。
(1)收集到(CH3)4NOH的区域是__________(填“a”“b”“c”或“d”)。
(2)写出电池总反应:____________________________。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:
CH3COOH(l)+C2H5OH(l)CH3COOC2H5(l)+H2O(l) ΔH=-2.7 kJ·mol-1
已知纯物质和相关恒沸混合物的常压沸点如下表:
纯物质
沸点/℃
恒沸混合物(质量分数)
沸点/℃
乙醇
78.3
乙酸乙酯(0.92)+水(0.08)
70.4
乙酸
117.9
乙酸乙酯(0.69)+乙醇(0.31)
71.8
乙酸乙酯
77.1
乙酸乙酯(0.83)+乙醇(0.08)+水(0.09)
70.2
(1)关于该反应,下列说法不合理的是________。
A.反应体系中硫酸有催化作用
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的ΔH接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
(2)一定温度下该反应的平衡常数K=4.0。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y=________;若乙酸和乙醇的物质的量之比为n∶1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在图2中绘制x随n变化的示意图(计算时不计副反应)。
(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110 ℃左右发生酯化反应并回流,直到塔顶温度达到70~71 ℃,开始从塔顶出料。控制乙酸过量的作用有__________________________________________________________
________________________________________________________________________。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:
2C2H5OH(g)CH3COOC2H5(g)+2H2(g)
在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图3所示。
关于该方法,下列推测合理的是________。
A.反应温度不宜超过300 ℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
解析:(一)由题意结合电解图,可得在阳极区Cl-失去电子生成Cl2,而在阴极区H+得到电子生成H2,阳极区的阳离子(CH3)4N+通过阳离子交换膜进入阴极区与OH-结合生成(CH3)4NOH,且能在d区收集,其电池总反应式为2(CH3)4NCl+2H2O2(CH3)4NOH+H2↑+Cl2↑。
(二)(2)设CH3COOH和CH3CH2OH起始物质的量为1 mol,平衡时转化的物质的量为x mol
则 CH3COOH+C2H5OHCH3COOC2H5+H2O
起始量/mol 1 1
转化量/mol x x x x
平衡量/mol 1-x 1-x x x
则=4,可得x=,乙酸乙酯的平衡产率为≈0.67。
答案:(一)(1)d (2)2(CH3)4NCl+2H2O通电,2(CH3)4NOH+H2↑+Cl2↑
(二)(1)BC (2)0.67(或67%)
(3)提高乙醇转化率;提高反应温度,从而加快反应速率;有利于后续产物分离 (4)ACD