- 385.50 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1.下列说法不正确的是( )
A.化学能可以转变成为热能、电能等
B.化学反应必然伴随发生能量变化
C.化学反应中的能量变化主要是由化学键的变化引起的
D.化学反应中能量变化的多少与反应物的质量无关
答案 D
解析 化学反应的实质是旧化学键断裂、新化学键形成,一定伴随能量变化;化学变化过程
中产生的能量可以转化为热能、电能等,且化学反应中,反应物的质量(或物质的量)的多少
及物质的聚集状态,影响着反应中能量变化的多少。
2.根据如图所示的反应,判断下列说法中错误的是( )
A.CO2(g)和 CaO(s)的总能量大于 CaCO3(s)的总能量
B.该反应的焓变大于零
C.该反应中既有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量
D.由该反应可推出凡是需要加热才发生的反应均为吸热反应
答案 D
解析 因为碳酸钙受热分解是吸热反应,所以 CO2(g)和 CaO(s)的总能量大于 CaCO3(s)的总能
量,焓变大于零,A、B 两项均正确;在 CaCO3 中,Ca2+和 CO 2-3 之间存在离子键,CO 2-3
中 C 与 O 之间存在共价键,故反应中既有离子键断裂也有共价键断裂,断键吸收能量,成键
放出能量,C 项正确;需要加热才发生的反应不一定为吸热反应,如碳的燃烧反应就是放热
反应,D 项错误。
3.已知 2H2(g)+CO(g)??CH3OH(g)为放热反应,对该反应的下列说法正确的是( )
A.因该反应为放热反应,故不加热就可发生
B.相同条件下,2 mol H2 的能量或 1 mol CO 的能量一定高于 1 mol CH3OH 的能量
C.相同条件下,反应物 2 mol H2 和 1 mol CO 的总能量一定高于生成物 1 mol CH3OH 的总能量
D.达到平衡时,CO 的浓度与 CH3OH 的浓度一定相等
答案 C
解析 A 项,放热反应与反应条件无关,可能需要加热才发生,错误;B 项,物质的能量与
状态有关,由放热反应可知,相同条件下,2 mol H2(g)的能量与 1 mol CO(g)的能量和一定高
于 1 mol CH3OH(g)的能量,错误;C 项,反应物总能量大于生成物总能量时,为放热反应,
则相同条件下,反应物 2 mol H2 和 1 mol CO 的总能量一定高于生成物 1 mol CH3OH 的总能
量,正确;D 项,平衡时,各物质的浓度不变,浓度是否相等与起始量、转化率有关,错误。
4.(2018·吉安二模)下列有关热化学方程式的叙述,正确的是( )
A.1 mol 甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
B.由 N2O4(g)??2NO2(g) ΔH=-56.9 kJ·mol -1,可知将 1 mol N2O4(g)置于密闭容器中充分
反应后放出热量为 56.9 kJ
C.由:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,可知:含 1 mol CH3COOH 的溶
液与含 1 mol NaOH 的溶液混合,放出热量为 57.3 kJ
D.已知 101 kPa 时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则 1 mol 碳完全燃烧放
出的热量大于 110.5 kJ
答案 D
解析 A 项,液态的水才是氢的稳定氧化物,错误;B 项,N2O4(g)??2NO2(g) ΔH=-56.9 kJ·mol-1,这
是一个可逆反应,反应不可能完全,错误;C 项,醋酸是弱电解质,电离的过程要吸收热量,
因此 1 mol CH3COOH 的溶液与含 1 mol NaOH 的溶液混合,放出热量要小于 57.3 kJ,错误。
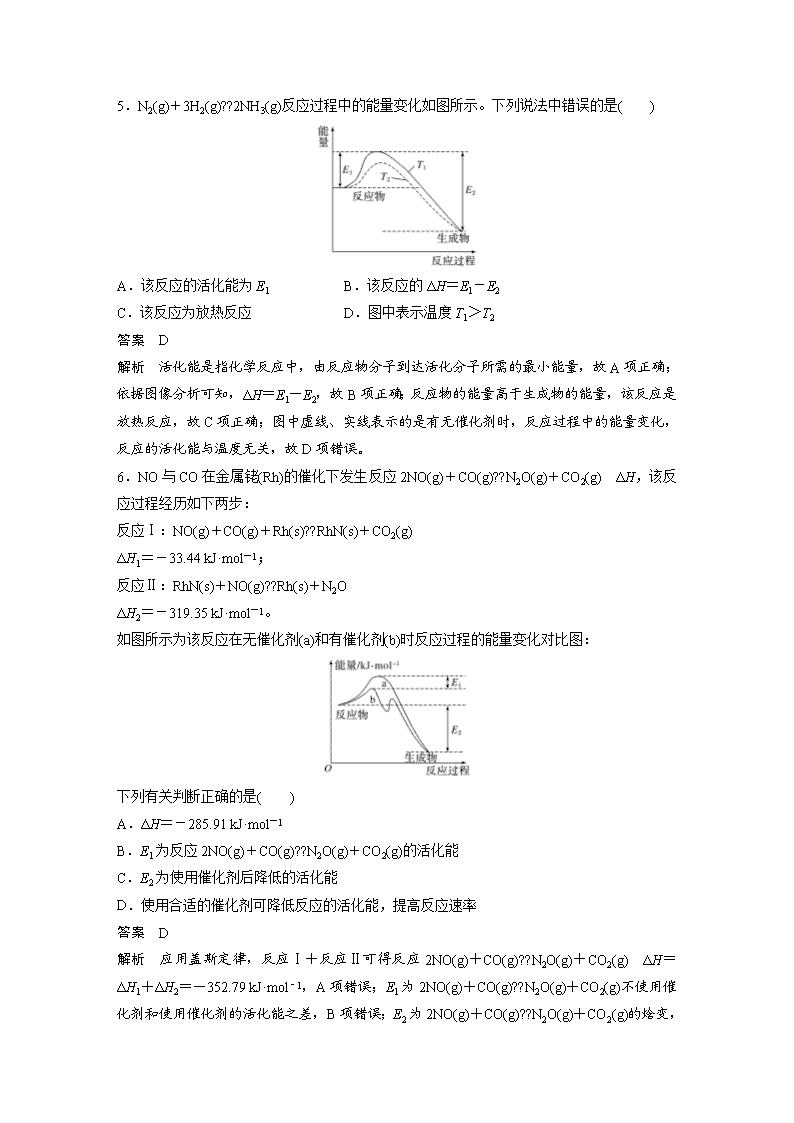
5.N2(g)+3H2(g)??2NH3(g)反应过程中的能量变化如图所示。下列说法中错误的是( )
A.该反应的活化能为 E1 B.该反应的 ΔH=E1-E2
C.该反应为放热反应 D.图中表示温度 T1>T2
答案 D
解析 活化能是指化学反应中,由反应物分子到达活化分子所需的最小能量,故 A 项正确;
依据图像分析可知,ΔH=E1-E2,故 B 项正确;反应物的能量高于生成物的能量,该反应是
放热反应,故 C 项正确;图中虚线、实线表示的是有无催化剂时,反应过程中的能量变化,
反应的活化能与温度无关,故 D 项错误。
6.NO 与 CO 在金属铑(Rh)的催化下发生反应 2NO(g)+CO(g)??N2O(g)+CO2(g) ΔH,该反
应过程经历如下两步:
反应Ⅰ:NO(g)+CO(g)+Rh(s)??RhN(s)+CO2(g)
ΔH1=-33.44 kJ·mol-1;
反应Ⅱ:RhN(s)+NO(g)??Rh(s)+N2O
ΔH2=-319.35 kJ·mol-1。
如图所示为该反应在无催化剂(a)和有催化剂(b)时反应过程的能量变化对比图:
下列有关判断正确的是( )
A.ΔH=-285.91 kJ·mol-1
B.E1 为反应 2NO(g)+CO(g)??N2O(g)+CO2(g)的活化能
C.E2 为使用催化剂后降低的活化能
D.使用合适的催化剂可降低反应的活化能,提高反应速率
答案 D
解析 应用盖斯定律,反应Ⅰ+反应Ⅱ可得反应 2NO(g)+CO(g)??N 2O(g)+CO2(g) ΔH=
ΔH1+ΔH2=-352.79 kJ·mol-1,A 项错误;E1 为 2NO(g)+CO(g)??N2O(g)+CO2(g)不使用催
化剂和使用催化剂的活化能之差,B 项错误;E2 为 2NO(g)+CO(g)??N2O(g)+CO2(g)的焓变,
C 项错误;使用合适的催化剂可降低反应的活化能,从而提高反应速率,D 项正确。
7.(2018·邯郸教学质量检测)工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。化学原
理:CH2==CH2(g)+H2O(g)===CH3CH2OH(g) ΔH。已知几种共价键的键能如下表所示:
化学键 C—H C==C H—O C—C C—O
键能/kJ·mol-1 413 615 463 348 351
下列说法中错误的是( )
A.上述合成乙醇的反应是加成反应
B.相同时间段内,反应中用三种物质表示的反应速率相等
C.碳碳双键的键能小于碳碳单键键能的 2 倍
D.上述反应式中,ΔH=-96 kJ·mol-1
答案 D
解析 题述反应式中,ΔH=615 kJ·mol-1+413 kJ·mol-1×4+463 kJ·mol-1×2-348 kJ·mol-
1-413 kJ·mol-1×5-463 kJ·mol-1-351 kJ·mol-1=-34 kJ·mol-1,D 项错误。
8.(2018·河南中原名校第五次联考)已知:①1 mol 晶体硅中含有 2 mol Si—Si 键。②Si(s)+
O2(g)===SiO2(s) ΔH,其反应过程与能量变化如图所示。
③
化学键 Si—O O==O Si—Si
断开 1 mol 共价键所需键能/kJ 460 500 176
下列说法中正确的是( )
A.晶体硅光伏发电是将化学能转化为电能
B.二氧化硅的稳定性小于硅的稳定性
C.ΔH=-988 kJ·mol-1
D.ΔH=a-c
答案 C
解析 晶体硅光伏发电是将太阳能转化为电能,A 项错误;根据化学键的键能判断,断裂 1
mol 二氧化硅中的 Si—O 键需要的能量为 4×460 kJ=1 840 kJ,断裂 1 mol 晶体硅中的 Si—Si
键需要的能量为 2×176 kJ=354 kJ,故二氧化硅的稳定性大于硅的稳定性,B 项错误;Si(s)+
O2(g)===SiO2(s) ΔH=(176×2+500-460×4) kJ·mol -1=-988 kJ·mol -1,C 项正确;根据
图中信息可知,ΔH=-c,D 项错误。
9.在 25 ℃、101 kPa 下,1 mol 白磷(化学式为 P4)完全燃烧放出的热量和 4 mol 红磷(化学式
为 P)完全燃烧放出的热量关系如图所示:
由此判断,下列说法正确的是( )
A.由红磷转化为白磷是吸热反应,等质量时红磷比白磷能量高,白磷比红磷稳定
B.由红磷转化为白磷是放热反应,等质量时红磷比白磷能量低,红磷比白磷稳定
C.由红磷转化为白磷是放热反应,等质量时红磷比白磷能量高,白磷比红磷稳定
D.由红磷转化为白磷是吸热反应,等质量时红磷比白磷能量低,红磷比白磷稳定
答案 D
解析 由图像知:白磷比红磷能量高,能量越高越不稳定,故红磷比白磷稳定,红磷转化为
白磷时需要吸收能量,属于吸热反应。
10.(2018·湖北联考)下列图示与对应的叙述相符的是( )
A.图甲中的 ΔH1>ΔH2
B.图乙表示可逆反应 A(s)+3B(g)??2C(g) ΔH>0
C.图丙表示充满 NO2 气体的试管,倒置于水槽中,向其中缓慢通入氧气直至试管中全部充
满水,假设溶质不扩散,溶质的物质的量浓度与通入氧气的体积关系
D.由图丁可说明烯烃与 H2 加成反应是放热反应,虚线表示在有催化剂的条件下进行
答案 C
解析 ΔH1、ΔH2、ΔH3 均小于零,且 ΔH1=ΔH2+ΔH3,故 A 错误;平衡常数不会随压强的
改变而改变,故 B 错误;试管中发生的总反应为 4NO2+O2+2H2O===4HNO3,所以随氧气
通入,溶质的物质的量浓度不变,故 C 正确;催化剂会降低反应的活化能,故 D 错误。
11.火箭推进器常以联氨(N2H4)为燃料、过氧化氢为助燃剂。已知下列各物质反应及过程的
热化学方程式:
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH1=-533.23 kJ·mol-1
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1
2H2O2(l)===2H2O(l)+O2(g) ΔH3=-196.4 kJ·mol-1
则联氨与过氧化氢反应的热化学方程式可表示为( )
A.N2H4(g)+2H2O2(l)===N2(g)+4H2O(l) ΔH=817.63 kJ·mol-1
B.N2H4(g)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-641.63 kJ·mol-1
C.N2H4(g)+2H2O2(l)===N2(g)+4H2O(l) ΔH=-641.63 kJ·mol-1
D.N2H4(g)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-817.63 kJ·mol-1
答案 B
解析 将题中的反应及过程依次编号为①、②、③,生成液态水时的反应热=①+③+2×
②,生成气态水的反应热=①+③-2×②,可求出 B 正确。
12.煤炭燃烧过程中会释放出大量的 SO2,严重破坏生态环境。采用一定的脱硫技术可以把
硫元素以 CaSO4 的形式固定,从而降低 SO2 的排放。但是煤炭燃烧过程中产生的 CO 又会与
CaSO4 发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)??CaO(s)+SO2(g)+CO2(g) ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)??CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ是放热反应还是吸热反应? ,能否通过反应Ⅰ判断等物质的量的 CO、CO2
具有能量的高低? 。
(2)已知 CO 转化成 CO2 的能量关系如图所示。写出该反应的热化学方程式
,
则 CO 的燃烧热 ΔH 为 kJ·mol-1。
(3)依据反应Ⅰ、Ⅱ确定反应 CaO(s)+3CO(g)+SO2(g)===CaS(s)+3CO2(g) ΔH=
kJ·mol-1。
答案 (1)吸热反应 否
(2)2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 -283 (3)-394
解析 (1)反应Ⅰ的 ΔH1>0,故为吸热反应;通过反应Ⅰ只能判断反应物的总能量低于生成物
的总能量,不能判断某一反应物与某一生成物之间的能量的相对大小。
(2)由图可知 2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1,CO 的燃烧热 ΔH 为1
2×(-566) kJ·mol-1=-283 kJ·mol-1。
(3)利用盖斯定律将反应Ⅱ减去反应Ⅰ可得目标方程式,ΔH=(-175.6-218.4)kJ·mol-1=
-394 kJ·mol-1。
13.CH4、H2、C 都是优质的能源物质,它们燃烧的热化学方程式分别为
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;
③C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与 O2 作用产生的能量存活。甲烷细菌使
1 mol 甲烷生成 CO2 气体与液态水,放出的能量 (填“>”“<”或“=”)890.3 kJ。
(2)甲烷与 CO2 可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2===2CO+2H2,1 g
CH4 完全反应可释放 15.46 kJ 的热量,能表示该反应过程中能量变化的是 (填字母)。
(3)C(s)与 H2(g)不反应,所以 C(s)+2H2(g)===CH4(g)的反应热无法直接测量,但通过上述反应
可求出其反应热 ΔH= 。
答案 (1)= (2)D (3)-74.8 kJ·mol-1
解析 (1)给定反应的反应热只取决于反应物和生成物的多少和状态,与中间过程无关,故甲
烷细菌使 1 mol 甲烷生成 CO2 气体与液态水,放出的能量仍等于 890.3 kJ。
(2)1 g CH4 完全反应释放 15.46 kJ 的热量,则 1 mol CH4 完全反应放出的热量为 247.36 kJ,
故 D 项符合题意。
(3)根据盖斯定律,②+③-①即得 C(s)+2H2(g)===CH4(g) ΔH=-74.8 kJ·mol-1。