- 190.99 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
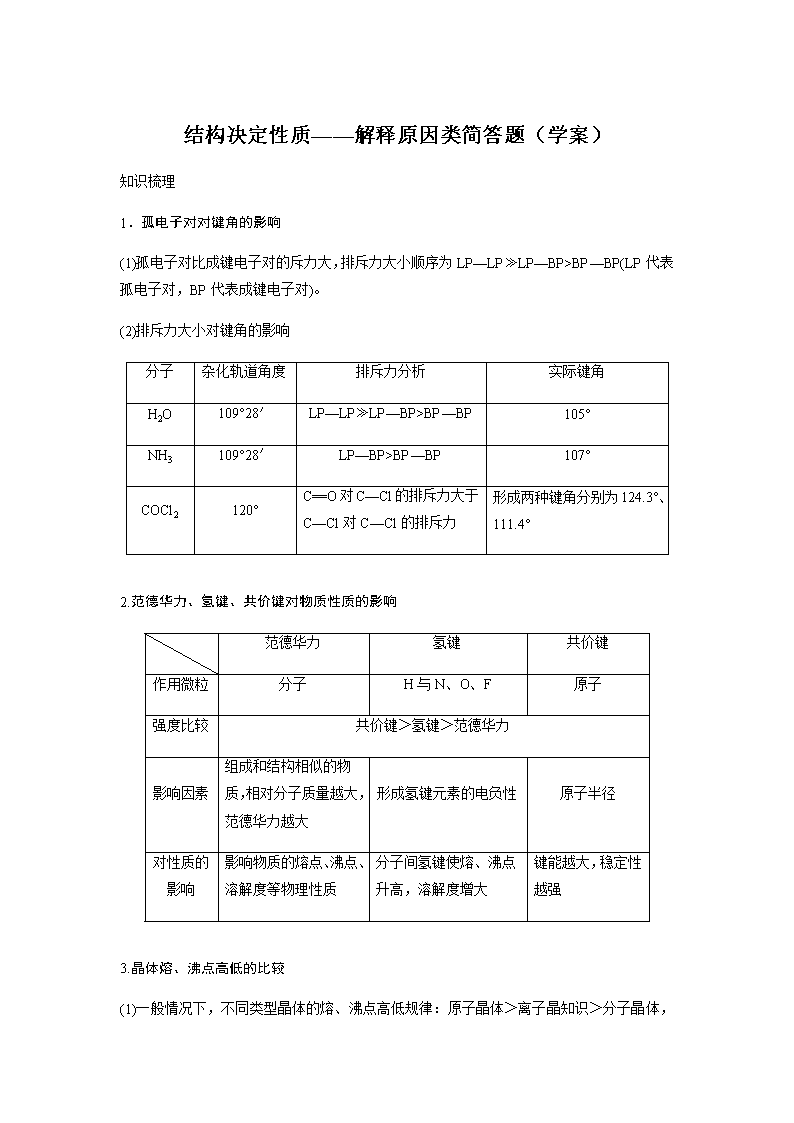
结构决定性质——解释原因类简答题(学案)
知识梳理
1.孤电子对对键角的影响
(1)孤电子对比成键电子对的斥力大,排斥力大小顺序为LP—LP≫LP—BP>BP—BP(LP代表孤电子对,BP代表成键电子对)。
(2)排斥力大小对键角的影响
分子
杂化轨道角度
排斥力分析
实际键角
H2O
109°28′
LP—LP≫LP—BP>BP—BP
105°
NH3
109°28′
LP—BP>BP—BP
107°
COCl2
120°
C==O对C—Cl的排斥力大于C—Cl对C—Cl的排斥力
形成两种键角分别为124.3°、111.4°
2.范德华力、氢键、共价键对物质性质的影响
范德华力
氢键
共价键
作用微粒
分子
H与N、O、F
原子
强度比较
共价键>氢键>范德华力
影响因素
组成和结构相似的物质,相对分子质量越大,范德华力越大
形成氢键元素的电负性
原子半径
对性质的影响
影响物质的熔点、沸点、溶解度等物理性质
分子间氢键使熔、沸点升高,溶解度增大
键能越大,稳定性越强
3.晶体熔、沸点高低的比较
(1)一般情况下,不同类型晶体的熔、沸点高低规律:原子晶体>离子晶知识>分子晶体,
如:金刚石>NaCl>Cl2;金属晶体>分子晶体,如:Na>Cl2(金属晶体熔、沸点有的很高,如钨、铂等,有的则很低,如汞等)。
(2)形成原子晶体的原子半径越小、键长越短,则键能越大,其熔、沸点就越高,如:金刚石>石英>碳化硅>晶体硅。
(3)形成离子晶体的阴阳离子的电荷数越多,离子半径越小,则离子键越强,熔、沸点就越高,如:MgO>MgCl2,NaCl>CsCl。
(4)金属晶体中金属离子半径越小,离子所带电荷数越多,其形成的金属键越强,金属单质的熔、沸点就越高,如Al>Mg>Na。
(5)分子晶体的熔、沸点比较规律
①组成和结构相似的分子,相对分子质量越大,其熔沸点就越高,如:HI>HBr>HCl;
②组成和结构不相似的分子,分子极性越大,其熔、沸点就越高,如:CO>N2;
③同分异构体分子中,支链越少,其熔、沸点就越高,如:正戊烷>异戊烷>新戊烷;
④同分异构体中的芳香烃及其衍生物,邻位取代物>间位取代物>对位取代物,如:邻二甲苯>间二甲苯>对二甲苯。
4.答题模板——结构决定性质简答题
首先叙述结构,然后阐述原理,最后回扣本题结论。
例 [2016·全国卷Ⅰ,37(2)(3)](2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是_________________
________________________________________________________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________
________________________________________________________________________。
GeCl4
GeBr4
GeI4
熔点/℃
-49.5
26
146
沸点/℃
83.1
186
约400
答案 (2)Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键
(3)GeCl4、GeBr4、GeI4的熔、沸点依次增高。原因是分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强
强化训练
1.[2018·全国卷Ⅲ,35(3)]ZnF2具有较高的熔点(872 ℃),其化学键类型是________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是
________________________________________________________________________。
答案 离子键 ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主,极性较小
2.[2018·全国卷Ⅰ,35(2)]Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是____________________。
答案 Li+核电荷数较大
3.[2017·全国卷Ⅲ,35(2)(3)(4)]研究发现,在CO2低压合成甲醇反应(CO2+3H2===CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(2)CO2和CH3OH分子中C原子的杂化形式分别为________和________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为________________________________________________________________________,
原因是________________________________________________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
答案 (2)sp sp3
(3)H2O>CH3OH>CO2>H2 H2O与CH3OH均为极性分子,水含氢键比甲醇中多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力较大
(4)离子键、π键
4.[2016·全国卷Ⅱ,37(2)]硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是________。
③氨的沸点________(填“高于”或“低于”)膦(PH3),原因是_________________________;
氨是________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为________。
答案 ①正四面体 ②配位键 N ③高于 氨气分子间可形成氢键 极性 sp3
5.碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键
C—C
C—H
C—O
Si—Si
Si—H
Si—O
键能/kJ·mol-1
356
413
336
226
318
452
(1)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是________________________________________________________________________。
(2)SiH4的稳定性小于CH4,更易生成氧化物,原因是
________________________________________________________________________。
答案 (1)硅烷中的Si—Si键和Si—H键的键能小于烷烃分子中C—C键和C—H键的键能,稳定性差,易断裂,导致长链硅烷难以形成,所以硅烷在种类和数量上都远不如烷烃多
(2)C—H键的键能大于C—O键,C—H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键
6.简要解答下列问题。
(1)氧元素的氢化物(H2O)在乙醇中的溶解度大于H2S,其原因是___________________。
(2)已知苯酚()具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________(填“>”或“<”)Ka(苯酚),其原因是________________________________________________。
(3)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为______________。
的沸点比高,原因是_____________________________。
答案 (1)水分子与乙醇分子之间形成氢键
(2)< —COO-与—OH形成分子内氢键,使其更难电离出H+
(3)O—H键、氢键、范德华力 形成分子内氢键,而形成分子间氢键,分子间氢键使分子间作用力增大
7.(1)CuSO4可由Cu和H2O2在H2SO4溶液中反应得到:Cu+H2O2+H2SO4===CuSO4+2H2O。
上述化学方程式中的5种物质所属的晶体类型不含有________(填字母)。
a.离子晶体 b.分子晶体
c.原子晶体 d.金属晶体
(2)Al2O3、SiC、Si、金刚石中属于原子晶体的有________________________,其熔点高低顺序为________________________________________________________________________,
其理由是__________________________________________________________________。
(3)干冰、冰二者熔点较高的是________________________________________________。
其理由是__________________________________________________________________。
(4)CS2熔点高于CO2的理由是________________________________________________。
答案 (1)c (2)SiC、Si、金刚石 金刚石>SiC>Si C—C、C—Si、Si—Si的键长依次增大,键能依次减小,熔点依次降低
(3)冰 冰晶体中分子间存在氢键
(4)CS2和CO2均为分子晶体,CS2的相对分子质量大,分子间作用力大
8.H+可与H2O形成H3O+,H3O+中O原子采用____________杂化。H3O+中H—O—H键角比H2O中H—O—H 键角大,原因为__________________________________________。
答案 sp3 H2O中O原子有两对孤电子对,H3O+中O原子只有一对孤电子对,排斥力较小
相关文档
- 2020年高考化学一轮复习化学反应速2021-07-0913页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-098页
- 2020届高考化学一轮复习化学与材料2021-07-0910页
- 2021届高考化学一轮复习化学反应速2021-07-0913页
- 2020届高考化学一轮复习化学反应与2021-07-0929页
- 2020届高考化学一轮复习化学反应速2021-07-0918页
- 2020届高考化学一轮复习化学工艺流2021-07-0919页
- 2021届高考化学一轮复习化学平衡常2021-07-0919页
- 2020届高考化学一轮复习化学反应与2021-07-098页
- 2021届高考化学一轮复习化学平衡状2021-07-0910页