- 213.00 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
练案[23]第八章 水溶液中的离子平衡
第23讲 弱电解质的电离平衡
A组 基础必做题
1.(2020·山东菏泽高三检测)在氨水中存在电离平衡:NH3·H2ONH+OH-。下列情况能引起电离平衡正向移动的有( C )
①加水 ②加NaOH溶液 ③通入HCl ④加CH3COOH ⑤加NH4Cl固体
A.②③⑤ B.①④⑤
C.①③④ D.③④⑤
[解析] 本题考查电离平衡移动分析。加水稀释促进NH3·H2O的电离,电离平衡正向移动,①符合题意;加NaOH溶液,溶液中c(OH-)增大,NH3·H2O的电离平衡逆向移动,②不符合题意;通入HCl或加CH3COOH,均有H+与OH-反应生成H2O,溶液中c(OH-)减小,NH3·H2O的电离平衡正向移动,③、④符合题意;加NH4Cl固体,溶液中c(NH)增大,NH3·H2O的电离平衡逆向移动,⑤不符合题意,故选C。
2.(2020·河北衡水检测)下列事实能证明HCOOH为弱酸的是( B )
A.可与Na2CO3反应生成CO2
B.常温时HCOONa溶液的pH大于7
C.导电能力低于同浓度的硫酸
D.0.1 mol·L-1HCOOH溶液可以使甲基橙变红
[解析] HCOOH能与Na2CO3反应生成CO2,说明HCOOH的酸性强于H2CO3,不能证明HCOOH是弱酸,A错误;常温时HCOONa溶液的pH大于7,说明HCOO-发生水解而使溶液显碱性,可以证明HCOOH是弱酸,B正确;H2SO4是二元酸,HCOOH是一元酸,不能根据同浓度两种酸的导电能力判断HCOOH为弱酸,C错误;0.1 mol·L-1HCOOH溶液可以使甲基橙变红,说明HCOOH溶液显酸性,但不能判断HCOOH是否完全电离,故不能证明HCOOH是弱酸,D错误。
3.(2020·江苏高三检测)(双选)25 ℃时,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是( BC )
A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
[解析] A项,由图示可知,pH=4.75时,c(CH3COO-)=0.050 mol·L-1,若pH由4.75→5.5,溶液酸性减弱,说明CH3COONa的量增加,即c(CH3COO-)>0.050 mol·L-1,c(CH3COOH)<0.050 mol·L-1即c(CH3COOH)<c(CH3COO-),故A错误;B项,W点时,c(CH3COO-)=c(CH3COOH)=0.050 mol·L-1,根据电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)+c(H+)=c(CH3COOH)+c(OH-);C项,根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),又知c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,故c(Na+)+c(H+)-c(OH-)=c(CH3COO-)=0.1 mol·L-1-c(CH3COOH),即c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1;D项通入0.05 mol HCl气体完全反应后,溶液为0.1 mol·L-1的CH3COOH和0.05 mol·L-1的NaCl的混合溶液,根据电荷守恒,c(H+)+c(Na+)=c(CH3COO-)+c(OH-)+c(Cl-),c(Na+)=c(Cl-),故c(H+)=c(CH3COO-)+c(OH-),而c(CH3COOH)≠c(CH3COO-),故D错误。
4.(2020·江西吉安期末)常温下,下列有关两种溶液的说法不正确的是( D )
序号
①
②
pH
11
11
溶液
氨水
NaOH溶液
A.①②两溶液中水的电离程度相同
B.①②两溶液中c(OH-)相等
C.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
D.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①<②
[解析] 本题考查强碱和弱碱的稀释、与酸的中和反应、水的电离程度及溶液中c(OH-)大小比较等。常温下,氨水和NaOH溶液的pH均为11,溶液中c(OH-)=1.0×10-3 mol·L-1,对水的电离抑制程度相同,则水的电离程度相同,水电离产生的c(H+)=1.0×10-11 mol·L-1,A、B正确;两溶液的pH均为11,则有c(NH3·H2O)>c(NaOH),等体积的两溶液分别与0.01 mol·L-1的盐酸完全中和,氨水消耗盐酸的体积大,C正确;两溶液加水稀释时,氨水中NH3·H2O的电离平衡正向移动,溶液中c(OH-)变化小,故稀释10倍后氨水的pH大,D错误。
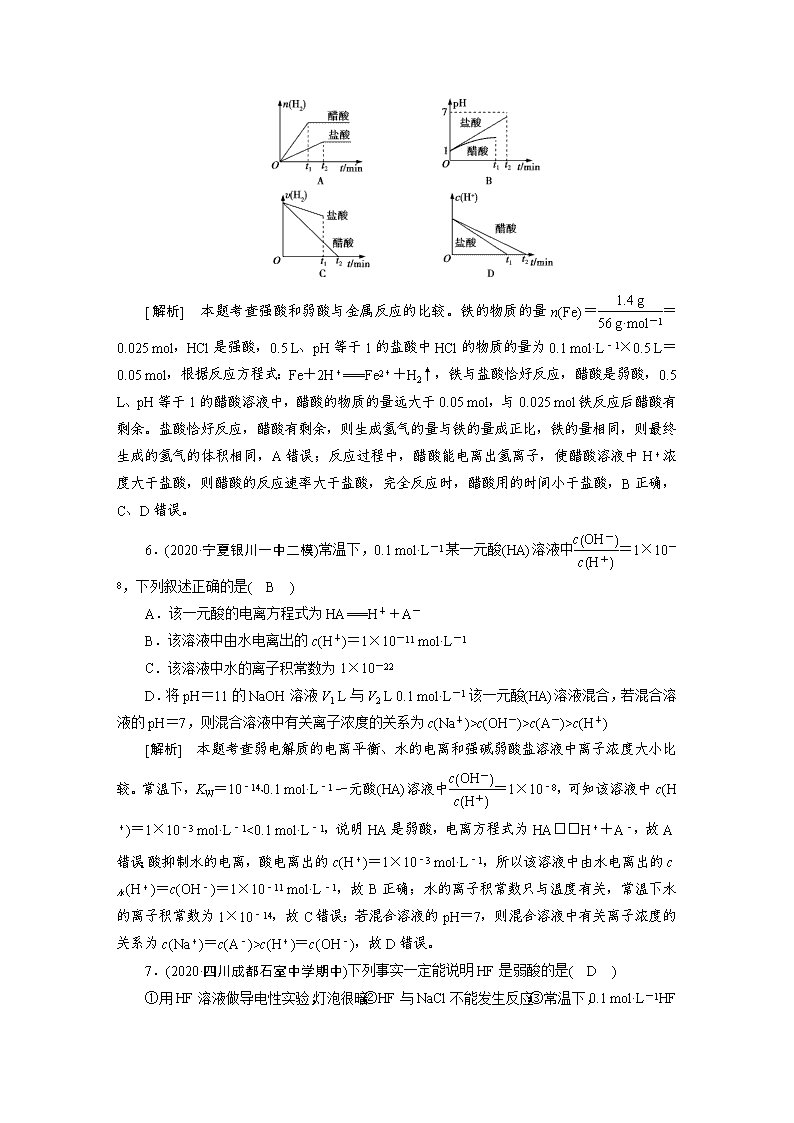
5.(2020·河北衡水检测)在体积均为0.5 L、pH均等于1的盐酸、醋酸溶液中,分别投入1.4 g铁粉,则如图所示曲线比较符合客观事实的是( B )
[解析] 本题考查强酸和弱酸与金属反应的比较。铁的物质的量n(Fe)==0.025 mol,HCl是强酸,0.5 L、pH等于1的盐酸中HCl的物质的量为0.1 mol·L-1×0.5 L=0.05 mol,根据反应方程式:Fe+2H+===Fe2++H2↑,铁与盐酸恰好反应,醋酸是弱酸,0.5 L、pH等于1的醋酸溶液中,醋酸的物质的量远大于0.05 mol,与0.025 mol铁反应后醋酸有剩余。盐酸恰好反应,醋酸有剩余,则生成氢气的量与铁的量成正比,铁的量相同,则最终生成的氢气的体积相同,A错误;反应过程中,醋酸能电离出氢离子,使醋酸溶液中H+浓度大于盐酸,则醋酸的反应速率大于盐酸,完全反应时,醋酸用的时间小于盐酸,B正确,C、D错误。
6.(2020·宁夏银川一中二模)常温下,0.1 mol·L-1某一元酸(HA)溶液中=1×10-8,下列叙述正确的是( B )
A.该一元酸的电离方程式为HA===H++A-
B.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
C.该溶液中水的离子积常数为1×10-22
D.将pH=11的NaOH溶液V1 L与V2 L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则混合溶液中有关离子浓度的关系为c(Na+)>c(OH-)>c(A-)>c(H+)
[解析] 本题考查弱电解质的电离平衡、水的电离和强碱弱酸盐溶液中离子浓度大小比较。常温下,KW=10-14,0.1 mol·L-1一元酸(HA)溶液中=1×10-8,可知该溶液中c(H+)=1×10-3 mol·L-1<0.1 mol·L-1,说明HA是弱酸,电离方程式为HAH++A-,故A错误;酸抑制水的电离,酸电离出的c(H+)=1×10-3 mol·L-1,所以该溶液中由水电离出的c水(H+)=c(OH-)=1×10-11 mol·L-1,故B正确;水的离子积常数只与温度有关,常温下水的离子积常数为1×10-14,故C错误;若混合溶液的pH=7,则混合溶液中有关离子浓度的关系为c(Na+)=c(A-)>c(H+)=c(OH-),故D错误。
7.(2020·四川成都石室中学期中)下列事实一定能说明HF是弱酸的是( D )
①用HF溶液做导电性实验,灯泡很暗;②HF与NaCl不能发生反应;③常温下,0.1 mol·L-1HF溶液的pH为2.3;④HF能与Na2CO3溶液反应,产生CO2;⑤HF与水能以任意比混溶;
⑥1 mol·L-1的HF水溶液能使紫色石蕊试液变红。
A.①② B.②③⑤
C.③④⑥ D.③
[解析] ①用HF溶液做导电性实验,灯泡很暗,说明溶液中导电离子浓度较小,可能是c(HF)较小引起的,不能证明HF是弱酸,错误;②HF与NaCl不能发生反应,说明HF的酸性比HCl弱,但不能证明HF是弱酸,错误;③常温下,0.1 mol·L-1HF溶液的pH为2.3,说明HF部分电离,则HF是弱酸,正确;④HF能与Na2CO3溶液反应,产生CO2,说明HF的酸性强于H2CO3,但不能证明HF是弱酸,错误;⑤HF与水能以任意比混溶,与其酸性强弱无关,错误;⑥1 mol·L-1的HF水溶液能使紫色石蕊试液变红,说明HF溶液具有酸生,不能证明HF是弱酸,错误。
8.(2019·贵州贵阳调研)为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:0.010 mol·L-1氨水、0.1 mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞溶液、pH试纸、蒸馏水。已知pH均为常温下测定。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,就认定一水合氨是弱电解质,你认为这一方法是否正确? 正确 (填“正确”或“不正确”),并说明理由 若是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.01 mol·L-1,pH=12;用pH试纸测出0.010 moL·L-1氨水的pH为10,说明NH3·H2O没有完全电离,应为弱电解质 。
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH为a,然后用蒸馏水稀释至1000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b应满足什么关系? a-2K2>K3=0.01
B.室温时,若在NaZ溶液中加少量盐酸,则的值变大
C.表格中三种浓度的HX溶液中,从左至右c(X-)浓度逐渐减小
D.在相同温度下,电离平衡常数:K5>K4>K3
[解析] 由表中HX的数据可知,弱电解质溶液的浓度越小,HX的电离度越大;电离平衡常数只与温度有关,则有K1=K2=K3,A错误。在NaZ溶液中存在Z-的水解平衡:Z-+H2OHZ+OH-,水解平衡常数为Kh=,加入少量盐酸,平衡正向移动,由于温度不变,则Kh不变,故的值不变,B错误。由表中HX的数据可知,HX的浓度越大,其电离度越小,但电离产生的c(X-)越大,故表格中三种浓度的HX溶液中,从左至右c(X-)浓度逐渐增大,C错误。相同条件下,弱电解质的电离度越大,则酸性越强,其电离常数越大,故相同温度下,电离平衡常数为K5>K4>K3,D正确。
10.(2020·无锡一模)(双选)25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( BD )
A.向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-)
B.0.1 mol·L-1 NH4HSO4溶液与0.1 mol·L-1 NaOH溶液等体积混合:c(SO)=c(Na+)>c(NH)>c(H+)>c(OH-)
C.0.2 mol·L-1 NaHCO3溶液与0.1 mol·L-1 NaOH溶液等体积混合:2c(H+)+c(CO)+3c(H2CO3)>2c(OH-)+c(HCO)
D.0.1 mol·L-1 HCN溶液与0.05 mol·L-1 NaOH溶液等体积混合(pH>7):c(H+)+c(HCN)>c(OH-)+c(CN-)
[解析] 发生反应Cl2+2NaOH===NaCl+NaClO+H2O、Cl2+H2OHCl+HClO,HCl完全电离,HClO部分电离,且ClO-水解,故c(Cl-)>c(ClO-),A项错误;等体积混合生成等量的Na2SO4和(NH4)2SO4,NH水解使溶液显酸性,B项正确;混合后得等量的Na2CO3和NaHCO3,由电荷守恒得c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-),由物料守恒得2c(Na+)=3[c(CO)+c(HCO)+c(H2CO3)],由两式得2c(H+)+3c(H2CO3)+c(HCO)=2c(OH-)+c(CO),由于CO的水解程度大于HCO,则c(CO)<c(HCO),故2c(H+)+3c(H2CO3)+c(CO)<2c(OH-)+c(HCO),C项错误;混合后得等量的HCN和NaCN,由电荷守恒得c(H+)+c(Na+)=c(CN-)+c(OH-),pH>7,CN-的水解程度大于HCN的电离程度,则c(HCN)>c(Na+)故c(H+)+c(HCN)>c(OH-)+c(CN-),D项正确。
11.(2020·江西兴国中学测试)已知:25 ℃时,0.1 mol·L-1 CH3COOH的电离度()约为1%。该温度下,用0.100 0 mol·L-1氨水滴定10.00 mL 0.100 0 mol·L-1 CH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法正确的是( A )
A.M点→N点,水的电离程度逐渐增大
B.25 ℃时,CH3COOH的电离常数约为1.0×10-2
C.N点溶液中,c(CH3COO-)=c(NH)=0.05 mol·L-1
D.当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH)
[解析] 本题考查弱电解质的电离平衡以及弱酸和弱碱的中和反应。M点溶液中溶质主要是醋酸,抑制水的电离,N点醋酸和一水合氨恰好反应,溶质主要是醋酸铵,促进水的电离,M点→N点,水的电离程度逐渐增大,故A正确;25 ℃时,0.1 mol·L-1 CH3COOH的电离度约为1%,则c(CH3COOH)=0.1 mol·L-1×(1-1%)=0.099 mol·L-1,c(H+)≈c(CH3COO-)=0.1 mol·L-1×1%=0.001 mol·L-1,则CH3COOH的电离常数Ka=≈1.0×10-5,故B错误;N点溶液中,CH3COOH和NH3·H2
O恰好反应生成CH3COONH4,若不发生水解,则c(CH3COO-)=c(NH)==0.05 mol·L-1,但实际上CH3COO-和NH均发生水解,溶液中含CH3COOH和NH3·H2O,当pH=7时,c(CH3COO-)=c(NH)<0.05 mol·L-1,故C错误;当滴入20 mL氨水时,溶液中溶质为醋酸铵和一水合氨,溶液呈碱性,根据电荷守恒:c(CH3COO-)+c(OH-)=c(NH)+c(H+),因c(OH-)>c(H+),所以c(CH3COO-)Y
C.若升高温度,Y、Z点对应溶液的pH均不变
D.将X点溶液与Z点溶液等体积混合,所得溶液呈碱性
[解析] 本题考查酸和碱溶液的稀释、水的电离程度、溶液的酸碱性等。由图可知,将X点HA溶液稀释10倍(即lg n增大1),pH变化小于1,则HA是弱酸;将Y点MOH溶液稀释10倍,pH减小1,则MOH是强碱,A错误。酸、碱均抑制水的电离,X点溶液中c(H+)=10-5 mol·L-1,由水电离出的c(H+)=c(OH-)=10-9 mol·L-1,Y、Z点溶液中c(OH-)分别为10-4 mol·L-1、10-5 mol·L-1,则由水电离出的c(H+)分别为10-10 mol·L-1、10-9 mol·L-1,故水的电离程度:X=Z>Y,B正确。MOH是强碱,升高温度,溶液中c(OH-)几乎不变,但KW增大,c(H+)变大,溶液的pH减小,C错误。将X点溶液与Z点溶液等体积混合,发生中和反应后,HA有剩余,所得混合液呈酸性,D错误。
13.(2020·山东潍坊检测)已知碳酸、次氯酸的电离常数如下表,下列有关说法正确的是( C )
H2CO3
Ka1=4.4×10-7
Ka2=4.7×10-11
HClO
Ka=3.2×10-8
A.同温同浓度下溶液的pH:NaClO>Na2CO3>NaHCO3
B.向次氯酸钠溶液中通入少量二氧化碳,反应的离子方程式:2ClO-+CO2+H2O===CO+2HClO
C.常温下,pH=8的NaHCO3溶液中:
c(H2CO3)-c(CO)=9.9×10-7mol·L-1
D.物质的量浓度之比为1︰2的NaClO、NaHCO3混合溶液中:
c(HClO)+c(ClO-)=2c(HCO)+2c(H2CO3)+2c(CO)
[解析] 本题考查电解质溶液,意在考查考生对水溶液中离子平衡理论的理解能力。酸性:H2CO3>HClO>HCO,则相同浓度时盐溶液的碱性:NaHCO3 pH(乙)(填“>”“<”或“=”)。
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为V(甲) < V(乙)(填“>”“<”或“=”)。
(5)已知25 ℃时,三种酸的电离平衡常数如下:
化学式
CH3COOH
H2CO3
HClO
Ka1
1.8×10-5
4.3×10-7
3.0×10-8
Ka2
—
5.6×10-11
—
下列四种离子结合H+能力最强的是 B (填序号)。
A.HCO B.CO
C.ClO- D.CH3COO-
写出下列反应的离子方程式。
CH3COOH+Na2CO3(少量): 2CH3COOH+CO===2CH3COO-+CO2↑+H2O ;
HClO+Na2CO3(少量): HClO+CO===ClO-+HCO 。
[解析] 本题考查弱电解质的电离平衡及移动分析、电离常数及应用、离子方程式等。
(1)CH3COOH溶液中存在电离平衡:CH3COOHH++CH3COO-,加水稀释过程中,平衡正向移动,但溶液中c(H+)、c(CH3COO-)均减小,A符合题意;CH3COOH的电离平衡常数Ka=,则有=,加水稀释时,c(CH3COO-)减小,但Ka不变,则增大,B不符合题意;由于温度不变,则c(H+)·c(OH-)=KW不变,C不符合题意;加水稀释时,溶液中c(H+)减小,由于c(H+)·c(OH-)=KW不变,则c(OH-)增大,故增大,D不符合题意。
(2)醋酸溶液中加入等体积的水,醋酸的电离平衡向右移动,电离程度增大;醋酸溶液中加入少量无水醋酸钠固体,c(CH3COO-)增大,电离平衡逆向移动,据CH3COOH的电离平衡常数Ka=推知,=,由于温度不变,Ka不变,c(CH3COO-)增大,则溶液中的值减小。
(3)常温下,pH=2的盐酸(甲)和pH=2的醋酸溶液(乙),取等体积的甲、乙两溶液,分别加水稀释100倍,醋酸的电离平衡正向移动,pH变化小,则所得溶液的pH:pH(甲)>pH(乙)。
(4)pH均为2的盐酸和醋酸溶液相比,其浓度:c(HCl)n(HCl),分别用等浓度的NaOH稀溶液中和,醋酸溶液消耗NaOH溶液的体积大于盐酸。
(5)由表中电离平衡常数可知,各种酸的酸性强弱CH3COOH>H2CO3>HClO>HCO,则酸的电离程度由易到难的顺序:CH3COOH>H2CO3>HClO>HCO,而酸越易电离,则电离产生的酸根离子结合质子(H+)的能力越弱,因此四种离子结合H+的能力:CH3COO-H2CO3>HClO>HCO,则CH3COOH与Na2CO3(少量)反应生成CH3COONa、CO2和H2O,离子方程式为2CH3COOH+CO===2CH3COO-+CO2↑+H2O;HClO与Na2CO3(少量)反应生成NaClO和NaHCO3,离子方程式为HClO+CO===ClO-+HCO。