- 1.19 MB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020-2021 年高考化学一轮复习第六单元 化学反应速率和化学平衡测
试题
1.用活性炭还原氮氧化物可防止空气污染。向 1L 密闭容器加入一定量的活性炭和 NO,某温度下发生反应:
已知:①C(s)+2NO(g) N2(g)+CO2 (g) ΔH
②C(s)+O2(g) CO2 (g) ΔH1= -393.5 kJ/mol
③N2(g)+O2(g) 2NO(g) ΔH2= +180.5 kJ/mol
下列说法错误的是
A.ΔH= -574.0 kJ/mol
B.当容器内气体密度不变时,反应①达到平衡状态
C.反应③正反应的活化能大于 180.5 kJ/mol
D.反应①达到平衡后,增大压强平衡向正反应方向移动
2.三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g)
SiH2Cl2(g)+SiCl4(g),在 50 ℃和 70 ℃ K 时 SiHCl3 的转化率随时间变化的结果如图所示。
下列叙述不正确...的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数 K =0.112/0.782
D.增大压强,可以提高 SiHCl3 的平衡转化率,缩短达平衡的时间
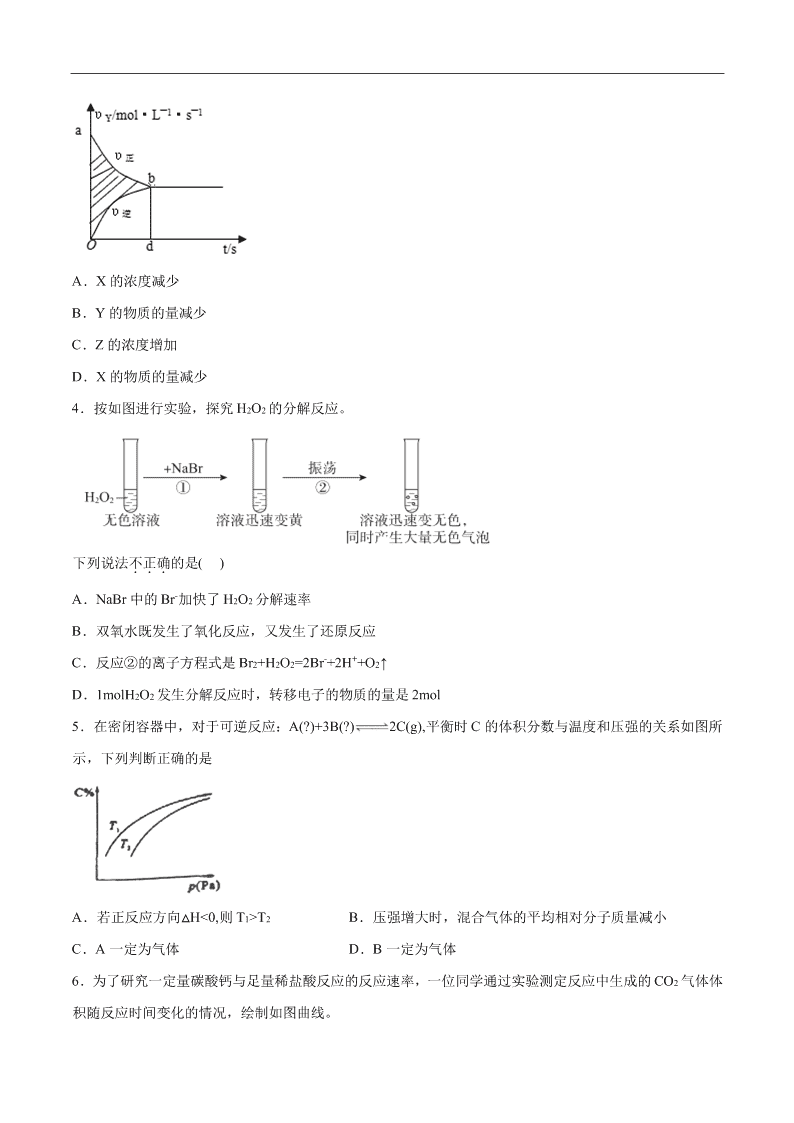
3.在容积固定的 4L 密闭容器里,进行可逆反应:X(g)+2Y(g) 2Z(g), 并达到平衡,在此过程中,以
Y 的浓度改变 表示的反应速率 v(正)、v(逆)与时间 t 的关系如图。则图中阴影部分面积表示( )
A.X 的浓度减少
B.Y 的物质的量减少
C.Z 的浓度增加
D.X 的物质的量减少
4.按如图进行实验,探究 H2O2 的分解反应。
下列说法不正确...的是( )
A.NaBr 中的 Br-加快了 H2O2 分解速率
B.双氧水既发生了氧化反应,又发生了还原反应
C.反应②的离子方程式是 Br2+H2O2=2Br-+2H++O2↑
D.1molH2O2 发生分解反应时,转移电子的物质的量是 2mol
5.在密闭容器中,对于可逆反应:A(?)+3B(?) 2C(g),平衡时 C 的体积分数与温度和压强的关系如图所
示,下列判断正确的是
A.若正反应方向△H<0,则 T1>T2 B.压强增大时,混合气体的平均相对分子质量减小
C.A 一定为气体 D.B 一定为气体
6.为了研究一定量碳酸钙与足量稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的 CO2 气体体
积随反应时间变化的情况,绘制如图曲线。
下列说法不正确...的是
A.由图像可知,该反应是放热反应
B.0—t1 时间段,CO2 的化学反应速率 v=
V1
1t (mL·min-1)
C.根据(V3—V2)<(V2—V1),推测反应速率减慢的原因可能是盐酸浓度减小
D.由图像可知,0—t1 的反应速率比 t1—t2 的反应速率快
7.2019 年 9 月,我国科研人员研制出 Ti·H·Fe 双温区催化剂,其中 Ti—H 区域和 Fe 区域的温度差可超过
100℃。Ti—H—Fe 双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列
说法错误的是( )
A.①②③在高温区发生,④⑤在低温区发生
B.在高温区加快了反应速率,低温区提高了氨的产率
C.该历程中能量变化最大的是 2.46eV,是氮分子中氮氮三键的断裂过程
D.使用 Ti—H—Fe 双温区催化合成氨,不会改变合成氨反应的反应热
8.工业上常用铁碳混合物处理含 Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中
Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。
下列推论不合理...的是
A.活性炭对 Cu2+具有一定的吸附作用
B.铁屑和活性炭会在溶液中形成微电池,铁为负极
C.增大铁碳混合物中铁碳比(x),一定会提高废水中 Cu2+的去除速率
D.利用铁碳混合物回收含 Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
9.CH4—CO2 催化重整可以得到合成气(CO 和 H2),有利于减小温室效应,其主要反应为 CH4(g)+CO2(g)⇌
2CO(g)+2H2(g) ΔH=+247 kJ·mol−1,同时存在以下反应:积碳反应:CH4(g) ⇌C(s) +2H2(g) ΔH=+75
kJ·mol−1;消碳反应:CO2(g) +C(s) ⇌2CO(g) ΔH=+172 kJ·mol−1,积碳会影响催化剂的活性,一定时间内
积碳量和反应温度的关系如下图。
下列说法正确的是
A.高压利于提高 CH4 的平衡转化率并减少积碳
B.增大 CO2 与 CH4 的物质的量之比有助于减少积碳
C.温度高于 600℃,积碳反应的化学反应速率减慢,消碳反应的化学反应速率加快,积碳量减少
D.升高温度,积碳反应的化学平衡常数 K 减小,消碳反应的 K 增大
10.I-可以作为水溶液中 SO2 歧化反应的催化剂,可能的催化过程如下。i.SO2+4I-+4H+ S↓+2I2+2H2O
ii.I2+2H2O+SO2 SO42- +4H++2I-
探究 i、ii 反应速率与 SO2 歧化反应速率的关系,实验如下:分别将 18 mL SO2 饱和溶液加入到 2 mL 下列试
剂中,密闭放置观察现象。(已知:I2 易溶解在 KI 溶液中)
序号 Ⅰ Ⅱ Ⅲ Ⅳ
试剂组成 0.4 mol·L-1 KI
a mol·L-1 KI
0.2 mol·L-1
H2SO4
0.2 mol·L-1
H2SO4
0.2 mol·L-1 KI
0.0002 mol I2
实验现象
溶液变黄,一段时
间后出现浑浊
溶液变黄,出现浑
浊较 A 快
无明显现象
溶液由棕褐色很快
褪色,变成黄色,出
现浑浊较 A 快
下列说法不正确...的是( )
A.水溶液中 SO2 歧化反应方程式为 3SO2+2H2O 2H2SO4 +S↓
B.II 是 I 的对比实验,则 a=0.4
C.比较 I、II、III,可得出的结论是:I−是 SO2 歧化反应的催化剂,H+单独存在时不具有催化作用,但 H+
可以加快歧化反应速率
D.实验表明,SO2 的歧化反应速率 IV>I,原因是反应 i 比 ii 快;IV 中由反应 ii 产生的 H+使反应 i 加快
11.2020 年 2 月,科学家报道了利用磁性纳米 Fe3O4 颗粒除去水体草甘膦污染物的方法,其原理如下图所示:
(Fe3O4 颗粒在水中表面会带-OH,在水体 pH≈4 时除污效果最好)。下列说法不正确...的是
A.草甘膦既可以和盐酸反应,又可以和氢氧化钠溶液反应
B.Fe3O4 纳米颗粒除去草甘膦的过程有化学键的形成和断裂
C.Fe3O4 纳米颗粒粒径越小、水体 pH 越大除污效果越好
D.处理完成后,Fe3O4 纳米颗粒可利用磁铁回收,经加热活化重复使用
12.某化工厂生产硝酸的流程如图 l 所示;其他条件相同时,装置③中催化剂铂网的成分、温度与氧化率的
关系如图 2 所示。下列说法不正确的是
A.该流程中,装置①③④中发生了氧化还原反应
B.装置②中利用氨易液化的性质实现反应物和生成物的分离
C.装置③中最佳反应条件是铂网成分为纯铂、温度为 900℃
D.装置④中通入过量空气可以提高硝酸的产率
13.将浓度均为 0.01 mol/L 的 H2O2、H2SO4、KI、Na2S2O3 溶液及淀粉混合,一定时间后溶液变为蓝色。该
实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
(资料)该“碘钟实验”的总反应:H2O2+2S2O32-+2H+=S4O62-+2H2O
反应分两步进行:
反应 A:H2O2+2I-+2H+=I2+2H2O
反应 B:……
(1)反应 B 的离子方程式是______。对于总反应,I-的作用相当于_____。
(2)为证明反应 A、B 的存在,进行实验Ⅰ。
A.向酸化的 H2O2 溶液中加入试剂 X 的水溶液,溶液变为蓝色
B.再向得到的蓝色溶液中加入 Na2S2O3 溶液,溶液的蓝色褪去。
试剂 X 是_____。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为 0.01 mol/L)
用量(mL)
试剂序号
H2O2 溶液
H2SO4 溶
液
Na2S2O3 溶
液
KI 溶液(含
淀粉)
H2O
实验Ⅱ 5 4 8 3 0
实验Ⅲ 5 2 x y z
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是 30 min、实验Ⅲ是 40 min。
①实验Ⅲ中,x、y、z 所对应的数值分别是_____、_____、_____。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是_____。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。(溶液浓度均为 0.01 mol/L)
用量(mL)
试剂序号
H2O2 溶液 H2SO4 溶液 Na2S2O3 溶液 KI 溶液(含淀粉) H2O
实验Ⅳ 4 4 9 3 0
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应 A 与反应 B 速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的
原因:______。
14.氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
Ⅰ.( 1)氮的固定是几百年来科学家一直研究的课题。
下表列举了不同温度下大气固氮和工业固氮的部分 K 值。
反应
大气固氮
N2(g)+O2(g) 2NO
(g)
工业固氮
N2(g)+3H2(g) 2NH3
(g)
温度/℃ 27 2000 25 400 450
K 3.8×10-31 0.1 5×108 0.507 0.152
①分析数据可知:大气固氮反应属于_____(填“吸热”或“放热”)反应。
②分析数据可知;人类不适合大规模模拟大气固氮的原因_____。
(2)NaNO2 是一种食品添加剂(有毒性,市场上常误与食盐混淆)。可用酸性 KMnO4 溶液检验,完成其反
应的离子方程式。MnO -
4 +NO -
2 +_____=Mn2++NO -
3 +H2O。
(3)工业生产以 NH3 和 CO2 为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g)
CO(NH2)2(l)+ H2O(l) △H<0。T1℃时,在 2 L 的密闭容器中充入 NH3 和 CO2 模拟工业生产,
若原料气中的 NH3 和 CO2 的物质的量之比(氨碳比) 3
2
n(NH )
n(CO ) = x,如图是 CO2 平衡转化率(α)与氨碳比
(x)的关系。
其它条件不变时,α 随着 x 增大而增大的原因是____;图中的 B 点处 NH3 的平衡转化率为____。
II.(4)红磷 P(s)和 Cl2 (g)发生反应生成 PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g)=2PCl3(g) △H1=-612 kJ· mol-1
2P(s) + 5Cl2(g)=2PCl5(g) △H2=-798 kJ· mol-1
气态 PCl5 生成气态 PCl3 和 Cl2 的热化学方程式为________。
(5)直链聚磷酸是由 n 个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。直链低聚磷酸铵
的化学式可表示为(NH4)(n+2)PnOx,x=___(用 n 表示)。
(6)一定温度下,向浓度均为 0.20 mol·L-1 的 MgCl2 和 CaCl2 混合溶液中逐滴加入 Na3PO4,先生成__沉淀
(填化学式);当测得溶液中钙离子沉淀完全(浓度小于 10-5 mol·L-1)时,溶液中的另一种金属阳离子的
物质的量浓度 c = ______mol·L-1。(已知:Ksp[Mg3(PO4)2] =6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。)
15.关于水煤气变换反应 CO(g)+H2O CO2(g)+H2(g)(简称 WGS),目前普遍接受的表面氧化还原机理的可
能基元反应步骤如下:
①H2O+* H2O* ②H2O*+* OH*+H* ③OH*+* O*+H* ④2H*+* H2+2*
⑤CO+* CO* ⑥CO*+O* CO2*+* ⑦CO2* CO2+*
其中*表示催化剂表面活性位,X*表示金属表面吸附物种。
表 1 WGS 反应中可能基元反应步骤的活化能数值(单位:kJ·mol-1)
注:表中 X(111)表示不同金属的同一晶面,110 与 111 表示不同晶面。
(1)分析表中数据,该机理中 WGS 反应的速率控制步骤是___________(填序号)。
(2)由表中数据可计算 Cu(111)催化 WGS 反应的焓变△H=____kJ·mol-1。
(3)WGS 反应的速率表达式:V 正=k 正·c(CO)·c(H2O),v 逆=k 逆·c(CO2)·c(H2)(k 正、k 逆为化学反应速率常数,只
与温度有关)。图 1 是反应速率常数的自然对数与温度倒数的关系图像。由图 1 可判断 550K~600K 温度范
围内,四种催化剂中活性最好的是_______________。
(4)已知 T1 时 WGS 反应的 KP=18。温度分别为 T2、T3(已知 T1>T2>T3)时 WGS 反应中 CO 和 CO2 分压随时间
变化关系如图 2 所示,催化剂为 Au(111),实验初始时体系中的 p(H2O)和 p(CO)相等,p(CO2)和 p(H2)相等。
则 T2 时,表示 p(CO)、p(CO2)的曲线分别是_________、_________;T2、T3 时 WGS 反应的 KP 分别为______、
_______。
16.某空间站中宇航员的呼吸保障系统原理如图所示。
Sabatier 系统中发生反应为:
反应 I:CO2(g)+4H2(g) CH4(g)+2H2O(g)△H1
反应 II:CO2(g)+H2(g) CO(g)+H2O(g)△H2=+41.2kJ/mol
(1)常温常压下,已知:
①H2 和 CH4 的燃烧热(△H)分别为-285.5kJ·mol-1 和-890.0kJ·mol-1;
②H2O(l)=H2O(g)△H3=+44.0kJ·mol-1。则△H1=__________kJ·mol-1。
(2)按 2
2
n(H )
n(CO ) =4 的混合气体充入 Sabatier 系统,当气体总压强为 0.1MPa,平衡时各物质的物质的量分数
如图所示;不同压强时,CO2 的平衡转化率如图所示:
①Sabatier 系统中应选择适宜的温度是__________。
②200~550℃时,CO2 的物质的量分数随温度升高而增大的原因是__________。
③当温度一定时,随压强升高,CO2 的平衡转化率增大,其原因是__________。
(3)一种新的循环利用方案是用 Bosch 反应[CO2(g)+2H2(g) C(s)+2H2O(g)]代替 Sabatier 系统。
①分析 Bosch 反应的熵值变化为:△S__________0(选填“>”或“<”)。
②温度一定时,在 2L 密闭容器中按 =2 投料进行 Bosch 反应,达到平衡时体系的压强为原来压强
p0 的 0.7 倍,该温度下反应平衡常数 Kp 为__________(用含 p0 的表达式表示,用平衡分压代替平衡浓度计算,
分压=总压×物质的量分数)。
③下列措施能提高 Bosch 反应中 CO2 转化率的是_________(填标号)。
A.加快反应器中气体的流速 B.提高原料气中 CO2 所占比例
C.增大催化剂的表面积 D.反应器前段加热,后段冷却
参考答案
1.D【解析】A.②C(s)+O2(g) CO2 (g) ΔH1= -393.5 kJ/mol,③N2(g)+O2(g) 2NO(g) ΔH2= +180.5
kJ/mol,根据盖斯定律,将②-③得:C(s)+2NO(g) N2(g)+CO2 (g) ΔH=(-393.5 kJ/mol)-(+180.5
kJ/mol)=-574.0 kJ/mol,故 A 正确;
B.C(s)+2NO(g) N2(g)+CO2 (g)是气体质量逐渐增大的反应,当容器内气体密度不变时,说明气体的质
量不变,说明反应达到了平衡状态,故 B 正确;
C.反应的焓变=正反应的活化能-逆反应的活化能,反应③N2(g)+O2(g) 2NO(g) ΔH2= +180.5 kJ/mol,
则正反应的活化能大于 180.5 kJ/mol,故 C 正确;
D.反应①C(s)+2NO(g) N2(g)+CO2 (g)为气体的物质的量不变的反应,容器中的气体的压强始终不变,
达到平衡后,增大压强平衡不移动,故 D 错误;
故选 D。
2.D【解析】A. 升高温度,SiHCl3 的平衡转化率增大,所以该反应为吸热反应,故 A 正确;
B. a、b 两点的浓度相同,a 点的温度大于 b 点,所以反应速率大小:va >vb,故 B 正确;
C. 70 ℃时,达到平衡时 SiHCl3 的平衡转化率为 22%,
2SiHCl3(g) SiH2Cl2(g)+SiCl4(g)
n 0 0
0.22n 0.11n 0.11n
0.78n 0.11n 0.11n
平衡常数 K =(0.11n)2/(0.78n)2=0.112/0.782,故 C 正确;
D. 增大压强,平衡不移动,增大压强不能提高 SiHCl3 的平衡转化率,故 D 错误。
选 D。
3.C【解析】观察图象,纵坐标为反应速率,横坐标为时间,二者之积为浓度,Y 和 Z 的反应速率相等,
则阴影部分不可能为 X 的浓度减少。Sabdo 表示 Y 向正反应方向进行时减少的浓度,而 Sbod 则表示 Y 向逆反
应方向进行时增大的浓度,所以,Saob=Sabdo-Sbod,表示 Y 向正反应方向进行时“净”减少的浓度,而 Y 的反
应速率与 Z 的反应速率相等,则阴影部分可表示 Y 的浓度的减小或 Z 的浓度的增加。
所以 C 选项是正确的。
4.D【解析】A.由题意和实验现象可知,首先过氧化氢把溴离子氧化生成溴单质,而后溴单质又被还原成
为溴离子,过程中放出氧气速率加快,反应前后溴离子没有变化,因此溴离子加快了过氧化氢的分解速率,
起到了催化剂的作用,故 A 正确;
B.由 A 的分析可知,①中过氧化氢发生了还原反应,②中过氧化氢发生了氧化反应,故 B 正确;
C.由 A 分析可知,反应②为溴单质氧化过氧化氢生成氧气自身被还原成溴离子的过程,方程式正确,故 C
正确;
D.由以上分析可知,过氧化氢分解的总反应为:
2 2 2 22H O H O+O2=
催化剂
,2mol 过氧化氢分解,转移 2mol
电子,故 D 错误;
答案选 D。
5.D【解析】温度不变,增大压强,C 的体积分数增大,平衡右移,平衡向着气体体积减少的方向移动,A
可能为气态、固态或液态,B 只能是气态;压强不变,温度由 T2 升高到 T1,C 的体积分数增大,平衡右移,
该反应正反应为△H>0,与判据矛盾,A、C 错误;B.若 A、B 均为气态,反应前后气体的总质量不变,气
体的总量减少,混合气体的平均相对分子质量增大;若只有 B 均为气态,反应后气体的总质量增大,气体
的总量减少,混合气体的平均相对分子质量增大;B 错误;答案选 D。
6.D【解析】A. 由图像可知,该反应在开始的一段时间内化学反应速率随着反应浓度的减小而逐渐增大,
因此该反应是放热反应,温度升高对化学反应速率产生了影响,A 说法正确;
B. 0—t1 时间段,CO2 的体积变化量为 V1mL,所以这段时间内的平均速率为 v=
V1
1t (mL·min-1),B 说法正
确;
C. 减小反应物的浓度可以减小化学反应速率,在相同时间内,生成的二氧化碳越多则化学反应速率越大,
根据(V3—V2)<(V2—V1)推测反应速率减慢的原因可能是盐酸浓度减小,C 说法正确;
D. 由图像可知,(V1—0)<(V2—V1),说明 0—t1 的反应速率比 t1—t2 的反应速率慢,D 说法不正确。
本题答案为 D。
7.C【解析】A.①为催化剂吸附 N2 的过程,②为形成过渡态的过程,③为 N2 解离为 N 的过程,以上都
是吸热反应,需要在高温时进行,而④氮原子的转移,⑤化学键的生成,为了增大氨气的平衡产率,需要
在低温下进行,故 A 正确;
B.升高温度,加快反应速率,在高温区加快了反应速率,由于合成氨的反应是放热反应,降低温度,平衡
向合成氨的方向移动,则低温区提高了氨的产率,故 B 正确;
C.该历程中能量变化最大的是 2.46eV,是经历①过程之后的能量变化,由图可知,①过程只发生了氮气分
子被催化剂吸附,并没有变成氮原子,①过程中氮氮三键没有断裂,故 C 错误;
D.催化剂只影响化学反应速率,化学反应不会因加入催化剂而改变反应热,故 D 正确;
答案为 C。
8.C【解析】A 项,活性炭具有许多细小微孔,且表面积巨大,具有很强的吸附能力,由图像可知,Cu2+
在纯活性炭中浓度减小,表明活性炭对 Cu2+具有一定的吸附作用,故不选 A 项;
B 项,铁屑和活性炭在溶液中形成微电池,其中铁具有较强的还原性,易失去电子形成 Fe2+,发生氧化反应,
因此铁作负极,故不选 B 项;
C 项,由图像可知,随着铁碳混合物中铁含量的增加至 x=2:1,Cu2+的去除速率逐渐增加;但当铁碳混合物
变为纯铁屑时,Cu2+的去除速率降低。当铁碳混合物中铁的含量过大时,正极材料比例降低,铁碳在废液中
形成的微电池数量减少,Cu2+的去除速率会降低,因此增大铁碳混合物中铁碳比(x),不一定会提高废水中
Cu2+的去除速率,故选 C 项;
D 项,在铁碳微电池中,碳所在电极发生还原反应,Cu2+得到电子生成铜单质;因此该微电池的总反应方程
式为 Fe+Cu2+=Fe2++Cu,故不选 D 项。
综上所述,本题正确答案为 C。
9.B【解析】A.反应 CH4(g)+CO2(g)⇌2CO(g)+2H2(g)和 CH4(g)⇌C(s)+2H2(g),正反应是气体体积增大的反
应,增大压强,平衡逆向移动,可减少积碳,但 CH4 的平衡转化率降低,故 A 错误;
B.假设 CH4 的物质的量不变,增大 CO2 的物质的量,CO2 与 CH4 的物质的量之比增大,对于反应
CH4(g)+CO2(g)⇌2CO(g)+2H2(g)平衡正向移动,CH4 的浓度减小,对于积碳反应:CH4(g) ⇌C(s) +2H2(g),由
于甲烷浓度减小,平衡逆向移动,碳含量减少;增大 CO2 的物质的量,对于消碳反应:CO2(g) +C(s) ⇌2CO(g),
平衡正向移动,碳含量也减少,综上分析,增大 CO2 与 CH4 的物质的量之比,有助于减少积碳,故 B 正确;
C.根据图像,温度高于 600℃,积碳量减少,但温度升高,存在的反应体系中反应速率都加快,故 C 错误;
D.平衡常数只与温度有关,积碳反应和消碳反应都是吸热反应,升高温度,平衡向吸热的方向移动,即向
正向移动,两个反应的平衡常数 K 都增大,故 D 错误;
答案选 B。
10.D【解析】A、由 i+ ii×2 得反应 3SO2+2H2O 2H2SO4 +S↓,选项 A 正确;B、B 是 A 的对比实验,
采用控制变量法,B 比 A 多加了 0.2mol/LH2SO4,A 与 B 中 KI 浓度应相等,则 a=0.4,选项 B 正确;C、对
比 A 与 B,加入 H+可以加快 SO2 歧化反应的速率;对比 B 与 C,单独 H+不能催化 SO2 的歧化反应;比较 I、
II、III,可得出的结论是:I−是 SO2 歧化反应的催化剂,H+单独存在时不具有催化作用,但 H+可以加快歧化
反应速率,选项 C 正确;D、对比 D 和 A,D 中加入 KI 的浓度小于 A,D 中多加了 I2,反应 i 消耗 H+和 I-,
反应 ii 中消耗 I2,D 中“溶液由棕褐色很快褪色,变成黄色,出现浑浊较 A 快”,反应速率 D>A,由此可见,
反应 ii 比反应 i 速率快,反应 ii 产生 H+使 c(H+)增大,从而反应 i 加快,选项 D 不正确。答案选 D。
11.C【解析】A. 草甘膦分子中含有羧基,能够与 NaOH 发生反应,含有亚氨基,也能够和盐酸反应,A
正确;
B. Fe3O4 颗粒在水中表面会带-OH,-OH 与草甘膦分子中的-OH 结合为 ,然后脱水形成
,所以 Fe3O4 纳米颗粒除去草甘膦的过程有化学键的形成和断裂,B 正确;
C. Fe3O4 纳米颗粒在水体 pH≈4 时除污效果最好,不是 pH 越大除污效果越好,C 错误;
D. 处理完成后,Fe3O4 纳米颗粒在 450℃加热 30 分钟,Fe3O4 纳米颗粒与草甘膦完全分离,利用磁铁回收
Fe3O4,经加热活化后就可以重复使用,D 正确;
故合理选项是 C。
12.C【解析】A.该流程中,装置①③④中发生了氧化还原反应,A 项正确;
B.装置②中利用氨易液化的性质实现反应物和生成物的分离,B 项正确;
C.装置③中最佳反应条件是铂网成分为含 10%铑的铂、温度为 900℃,C 项错误;
D.装置④中通入过量空气可以提高硝酸的产率,D 项正确;
答案选 C。
13.( 1)I2+2S2O32-=2I-+S4O62-;催化剂(2)淀粉、碘化钾(3)①8、3、2②其它条件不变,增大氢离子浓度
可以加快反应速率(4)n(H2O2):n(Na2S2O3)<1:2,v(A)<v(B),所以未出现溶液变蓝的现象
【解析】 (1)该“碘钟实验”的总反应:①H2O2+2S2O32-+2H+=S4O62-+2H2O,反应分两步进行:反应 A:②
H2O2+2I-+2H+=I2+2H2O,用总反应方程式减去反应 A 方程式,可得反应 B 方程式:I2+2S2O32-=2I-+S4O62-,
可见,对于总反应,I-的作用相当于催化剂;
(2)过氧化氢具有氧化性会将 KI 氧化为碘单质,碘单质遇到淀粉变蓝色,碘单质具有氧化性,可以氧化
Na2S2O3 溶液,发生反应 I2+2S2O32-=2I-+S4O62-,碘单质被还原为 I-,则试剂 X 为 KI、淀粉溶液;
(3)①为了方便研究在反应中要采取控制变量方法进行研究,即只改变一个反应条件,其它条件相同,依据
表格数据可知,实验Ⅲ跟实验Ⅱ比硫酸体积减少,所以其它条件都要相同,而且混合后总体积也要相同,
故实验Ⅲ中,x、y、z 所对应的数值分别是:8、3、2;
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是:在其它条件不变时,溶液酸性越强,氢离子浓度越大,增
大氢离子浓度可以加快反应速率;
(4)对比实验Ⅱ、实验Ⅳ,可知溶液总体积相同,该变量是过氧化氢、Na2S2O3 溶液,过氧化氢减少,Na2S2O3
增大,由于 n(H2O2):n(Na2S2O3)<1:2,v(A)<v(B),所以未出现溶液变蓝的现象。
14.Ⅰ(1)①吸热②K 值小,正向进行的程度小(或转化率低),不适合大规模生产(2)2MnO -
4 +5NO -
2
+6H+=2Mn2++5NO -
3 +3H2O(3)x 增大,相当于 c(NH3)增大,CO2 转化率增大;25% II(4)PCl5(g) PCl3
(g) + Cl2(g) △H = +93 kJ·mol-1(5)3n+1(6)Mg3(PO4)2;10-6
【解析】Ⅰ(1)①由表格数据可知,温度越高,K 越大,说明升高温度,平衡正移,则正反应方向为吸热反
应;
②由表格数据可知,2000℃时,K=0.1,K 值很小,则转化率很小,不适合大规模生产,所以人类不适合大
规模模拟大气固氮;故答案为:K 值小,正向进行的程度小(或转化率低),不适合大规模生产;
(2)NaNO2 可用酸性 KMnO4 溶液检验,根据氧化还原反应相关配平原则,遵守质量守恒定律、电荷守恒定律,
可以推出反应方程式为:2MnO +5NO +6H+=2Mn2++5NO +3H2O;
(3)工业以 NH3 和 CO2 为原料合成尿素[CO(NH2)2]:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O
(l) △H<0,CO2 平衡转化率(α)随(氨碳比) 3
2
n(NH)
n(CO) = x 的变化如图所示,氨碳比(x)越大,相
当于增大 3n(NH ) ,故平衡正向移动,CO2 平衡转化率(α)随之增大;B 点对应 =4,且反应后 CO2
转化率为 50%,物质的转化量之比与化学计量数呈比例关系,假设投料: =4X,则 2n(CO ) =x,又
二氧化碳转化 0.5x,氨气转化的是二氧化碳的 2 倍,故氨气转化 x,氨气的转化率为: x 100%=25%4x ;
故答案为:x 增大,相当于 c(NH3)增大,CO2 转化率增大;25%;
II(4)根据盖斯定律及热化学方程式的书写原则,第一个反应减去第二个反应可得出气态 PCl5 生成气态 PCl3
和 Cl2 的热化学方程式为:2PCl5(g) 2PCl3(g)+2 Cl2(g) △H = +186 kJ·mol-1;简化后为:
PCl5(g) ⇌ PCl3(g) + Cl2(g) △H = +93 kJ·mol-1;
(5)已知直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,根据化学式的书写原则,化学式的总化合价为
0,铵根的化合价为+1,又氧元素为-2 价,PnOx 的总化合价为-(n+2)价 ,可以列式: 5n2xn2 ,
可得 x=3n+1;
(6)Ca3(PO4)2 与 Mg3(PO4)2 是同类型沉淀,已知:Ksp[Mg3(PO4)2] =6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10
-26,故一定温度下,向浓度均为 0.20 mol·L-1 的 MgCl2 和 CaCl2 混合溶液中逐滴加入 Na3PO4,溶度积常数小
的先生成沉淀,先生成 Mg3(PO4)2 沉淀;当测得溶液中钙离子沉淀完全,则钙离子浓度为 10-5mol·L-1,
根据 Ca3(PO4)2 沉淀溶解平衡可知:
26
342
2
23
4 33 5
Ksp CaPO 6[]cPO=
c 1
.010 6.010
Ca 0
-
-11( )
,则在
Mg3(PO4)2 沉淀溶解平衡中:
3-18
23
29
2 3
4
42Ksp MgPO 6.010Mg 6.0
[]c= 10 10
cPO
-
-11
( )
,则
-6 -2+ 1Mc =10 mol Lg 。
15.( 1)②(2)-44(3)Cu(110) (4)d;a;25;49
【解析】(1)分析表中数据,反应所需的活化能越高,反应越难发生,故该机理中 WGS 反应的速率控制步骤
是②。
(2)由表中数据可知,正反应的活化能是 7 个正向基元反应的活化能的和,逆反应的活化能是 7 个逆向基元
反应的活化能的和,Cu(111)催化 WGS 反应的焓变△H=E 正-E 逆=(109+67+63+46+21)kJ·mol-1-
(58-8-88-29-50-117)kJ·mol-1=-44kJ·mol-1。
(3)图 1 是反应速率常数的自然对数与温度倒数的关系图像。由图 1 可判断 550K~600K 温度范围内,Cu(110)
的反应速率常数值最高,四种催化剂中活性最好的是 Cu(110)。
(4)温度分别为 T2、T3(已知 T1>T2>T3)时 WGS 反应中 CO 和 CO2 分压随时间变化关系如图 2 所示,催化剂为
Au(111),反应为放热反应,降低温度,反应正向移动,平衡常数增大,实验初始时体系中的 p(H2O)和 p(CO)
相等,p(CO2)和 p(H2)相等。已知 T1 时 WGS 反应的 KP=18>1,则平衡时 p(CO2)> p(CO)。计算对应温度下的
平衡常数,若平衡时两气体为图中实线,则 K=
22
2
22
( ) 7 49( ) 1
p CO
p CO ,若平衡时两气体为图中虚线,则 K=
22
2
22
( ) 6 25( ) 1.2
p CO
p CO 。T2>T3,则 T2 平衡常数应比 T3 小,故 T2 时,表示 p(CO)、p(CO2)的曲线分别是 d、
a; T2、T3 时 WGS 反应的 KP 分别为 25、49。
16.( 1)-164.0 (2)①200℃②△H1<0、△H2>0,温度升高时,反应 I 向左移动 CO2 增加的量比反应 II 向
右移动 CO2 减少的量多③反应 II 增压平衡不移动,反应 I 增压平衡向右移动,故 CO2 的平衡转化率增大(3)
① <②
0
2430
P ③D
【解析】 (1)已知:H2 和 CH4 的燃烧热分别为−285.5kJ∙mol−1 和−890.0kJ∙mol−1,可知热化学方程式:
a.H2(g)+ 1
2 O2(g)=H2O(1)△H=−285.5kJ∙mol−1,
b.CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=−890.0kJ∙mol−1,
c.H2O(1)═H2O(g)△H3=44.0kJ∙mol−1,根据盖斯定律,4a+2c−b 得,CO2(g)+4H2(g) CH4(g)+2H2O(g)△
H1=−164.0kJ∙mol−1;
(2)①产物的物质的量分数越大,反应物的转化率越高,Sabatier 系统中 CO2 和 H2 为反应物,H2O、CH4、
CO 为产物,由图所示,200℃时 CO2 转化率最高,H2O、CH4 的物质的量分数最大,Sabatier 系统中应选择
适宜的温度 200℃;
②反应 I△H1<0、反应Ⅱ△H2>0,恒压条件下,升高温度时反应 I 的平衡向逆向移动使 CO2 的量增加,反
应 II 的平衡正向移动使 CO2 的量减少,但反应Ⅰ向左移动增加的 CO2 的量大于反应Ⅱ向右移动减少的 CO2
的量,所以 CO2 的物质的量分数随温度升高而增大;
③相同温度下,反应 II 正向是前后气体分子数不变,反应 I 正向为气体分子数缩小的反应,压强改变不影
响其平衡移动,反应 I 正向为气体分子数缩小的反应,增大压强,反应 I 的平衡向正反应方向移动、反应 II
的平衡,所以相同温度时,压强越大,CO2 的平衡转化率越大;
(3)①Bosch 反应为 CO2(g)+2H2(g) C(s)+2H2O(g),由反应可知正反应为气体分子数目减少的体系,平衡
体系混乱度减小,则△S<0;
②温度一定时,在 2L 密闭容器中按 2
2
n(H )
n(CO ) =2 投料进行 Bosch 反应,设设氢气与二氧化碳初始投料分别
为 2mol 和 1mol,二氧化碳的转化物质的量为 xmol,列三段式:
222
(mol)120
(mol)x2x2
CO g2H g
x
(m
C
o
s2
l)
HO
1-22x
g
x-2x
始
变
平
+ +
达到平衡时体系的压强为原来压强 p0 的 0.7 倍,即1-x+2-2x+2x =0.71+2
,解得 x=0.9,则平衡时体系中 CO2、
H2、2H2O(g)的物质的量分别为 0.1mol、0.2mol、1.8mol,混合气体的总物质的量=0.1+0.2+1.8=2.1mol,p(CO2)=
0
0.1 0.72.1 p = 00.1p
3
,p(H2)= 0
0.2 0.72.1 p = 00.2p
3
,p(H2O)= 0
1.8 0.72.1 p =0.6p0,该温度下反应平衡常数 Kp=
2
20
2
2
2 00
2
2
=() 0.10.2
3
pHO0.6p
pCH
3
Op pp
=
0
2430
p ;
③A.加快反应器中气体的流速,相当于减小浓度,平衡逆向移动,二氧化碳转化率减小,故 A 不符合题
意;
B.提高原料气中 CO2 所占比例,平衡正向移动,但二氧化碳转化率减小,故 B 不符合题意;
C.增大催化剂的表面积,反应速率加快,但平衡不移动,二氧化碳转化率不变,故 C 不符合题意;
D.反应器前段加热,后段冷却,平衡正向移动,二氧化碳转化率增大,故 D 符合题意;
答案选 D。