- 324.00 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
晶体结构与性质
一、选择题
1.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2与SO3 ②C3N4(硬度大,熔点高)与SiC ③CO2与SO2 ④晶体氖与晶体氮 ⑤NaCl与AlCl3 ⑥NH4Cl与NaOH ⑦MgCl2与SiCl4
A.①③⑥ B.②③⑥ C.②④⑥ D.⑤⑥⑦
答案 B
解析 ①SiO2为原子晶体,SO3为分子晶体,错误;②C3N4与SiC均是含有共价键的原子晶体,正确;③CO2与SO2分子中都只含极性共价键,都属于分子晶体,正确;④晶体氖与晶体氮都是分子晶体,但晶体氖中不含化学键,晶体氮的分子中含有共价键,错误;⑤NaCl为离子晶体,AlCl3为分子晶体,错误;⑥NH4Cl与NaOH均为离子晶体,均含有离子键和共价键,正确;⑦MgCl2属于离子晶体,SiCl4属于分子晶体,错误。
2.下列说法正确的是( )
A.区分晶体和非晶体的最可靠的科学方法是对固体进行X射线衍射
B.1 mol金刚石中的C—C键数是2NA,1 mol SiO2晶体中的Si—O键数也是2NA
C.水晶和干冰在熔化时,晶体中的共价键都会断裂
D.晶体中分子间作用力越大,分子越稳定
答案 A
解析 A项,晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列,X射线衍射可以看到微观结构;B项,金刚石中1个C原子与另外4个C原子形成C—C单键,这个C原子对每个单键的贡献只有,所以1 mol C原子形成的C—C键为4×=2 mol,而二氧化硅晶体中1个Si原子分别与4个O原子形成4个Si—O单键,则1 mol SiO2晶体中Si—O键为4 mol;C项,水晶是原子晶体,熔化时共价键断裂,而分子晶体干冰熔化时,分子间作用力被削弱而共价键不断裂;D项,分子的稳定性取决于化学键的强弱。
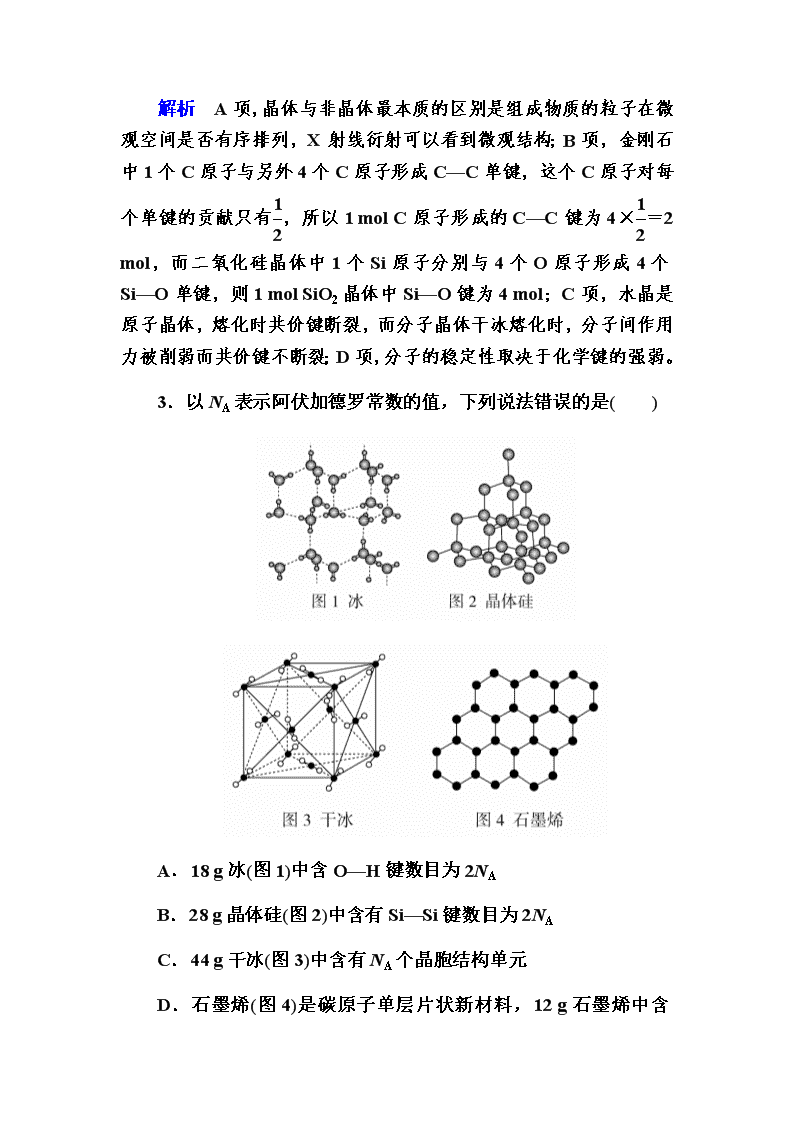
3.以NA表示阿伏加德罗常数的值,下列说法错误的是( )
A.18 g冰(图1)中含O—H键数目为2NA
B.28 g晶体硅(图2)中含有Si—Si键数目为2NA
C.44 g干冰(图3)中含有NA个晶胞结构单元
D.石墨烯(图4)是碳原子单层片状新材料,12 g石墨烯中含
C—C键数目为1.5NA
答案 C
解析 1个水分子中含有2个O—H键,18 g冰的物质的量为1 mol,含O—H键数目为2NA,A项正确;28 g晶体硅中含有1 mol Si原子,每个硅原子与其他4个Si形成4个Si—Si键,每个硅原子形成的共价键为×4=2,则1 mol单质硅含有2 mol Si—Si键,B项正确;1个晶胞结构单元含有4个二氧化碳分子,44 g干冰中含有晶胞结构单元个数小于NA个,C项错误;在石墨烯中,每个碳原子形成3个共价键,所以每个碳原子实际占化学键为1.5个,12 g石墨烯即1 mol所含碳碳键数目为1.5NA,D项正确。
4.下面的排序不正确的是( )
A.晶体熔点由低到高:CF4碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF>NaCl>NaBr>NaI
答案 C
解析 选项A中晶体熔点与分子间作用力有关,相对分子质量越大,分子间作用力越大,选项A正确;选项B中硬度与共价键的键能有关,由于Si—Si键的键长大于C—Si键的键长大于C—C键的键长,键长越长,键能越小,选项B正确;选项C中熔点与金属键的强弱有关,金属性强,金属键弱,因此正确的顺序为Al>Mg>Na;选项D中晶格能的大小与离子半径和离子所带电荷数有关,选项D正确。
5.关于晶体的叙述中,正确的是( )
A.原子晶体中,共价键的键能越大,熔、沸点越高
B.分子晶体中,分子间的作用力越大,该分子越稳定
C.分子晶体中,共价键的键能越大,熔、沸点越高
D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
答案 A
解析 B项,分子的稳定性取决于分子内部共价键的强弱,与分子间作用力无关;C项,分子晶体熔、沸点的高低,取决于分子间作用力的大小;D项,也可能是分子晶体,如HCl。
6.高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )
A.与K+最近且距离相等的K+有6个
B.超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O
C.晶体中与每个K+距离最近的O有6个
D.晶体中,所有原子之间都以离子键相结合
答案 C
解析 根据题给信息,超氧化钾晶体是面心立方晶体,超氧化钾晶体(KO2)是离子化合物,阴、阳离子分别为O、K+,晶体中K+与O间形成离子键,O中O-O键为共价键。作为面心立方晶体,每个晶胞中含有K+:8×+6×=4(个),O:1+12×=4(个),晶胞中与每个K+最近且距离相等的O有6个,最近且距离相等的K+有12个。
7.下列有关离子晶体的数据大小比较不正确的是( )
A.熔点:NaF>MgF2>AlF3
B.晶格能:NaF>NaCl>NaBr
C.阴离子的配位数:CsCl>NaCl>CaF2
D.硬度:MgO>CaO>BaO
答案 A
解析 由于r(Na+)>r(Mg2+)>r(Al3+),且Na+、Mg2+、Al3+所带电荷依次增大,所以NaF、MgF2、AlF3的离子键依次增强,晶格能依次增大,故熔点依次升高。r(F-)MgO>CaO>KCl
(3)Cu 6
(4)体心立方堆积 b3∶4a3
解析 (2)离子晶体中,离子半径越小,离子所带电荷越多,晶格能越大、熔点越高。
(3)某离子X+中所有电子正好充满K、L、M三个电子层,该离子含有28个电子,则X+为Cu+;采用X、Y、Z三轴切割的方法知与N3-相连的Cu+个数是6。
(4)δ晶胞原子堆积名称为体心立方堆积。根据晶胞结构可知,α-Fe晶胞、γ-Fe晶胞中含有的铁原子分别为1个和4个,所以有:ρ(α-Fe)=,ρ(γ-Fe)=,α-Fe和γ-Fe两种晶体的密度比为b3:4a3。
11.](15分)1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等。回答下列问题:
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于________(填“晶体”或“非晶体”)。
(2)基态铜原子有________
个未成对电子,二价铜离子的电子排布式为____________________________,在CuSO4溶液中滴入过量氨水,形成深蓝色溶液的溶质的化学式为________________。
答案 (1)晶体
(2)1 1s22s22p63s23p63d9(或[Ar]3d9)
[Cu(NH3)4]SO4
解析 (1)晶体中粒子在三维空间里呈周期性有序排列,有自范性,而非晶体中原子排列相对无序,无自范性,故该金属互化物属于晶体。
12.(15分)图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。回答下列问题(需要用到元素符号或分子式的,请用相应元素的元素符号或分子式作答):
图1
(1)a与b对应的元素可形成10电子中性分子X,写出带一个单位正电荷的1个X的等电子体________。将X溶于水后的溶液滴入到CuSO4溶液中至过量,再加入适量乙醇,可析出一种深蓝色晶体,其化学式为__________________________________。
(2)元素c位于元素周期表的____________区,d原子次外层有
____________对自旋相反的电子,c、d单质的晶体堆积方式类型分别是________、________。
A.简单立方堆积 B.体心立方堆积
C.六方最密堆积 D.面心立方最密堆积
(3)d的一种氯化物为白色立方结晶,熔点430 ℃,沸点1490 ℃,其熔融态导电性差,晶胞结构如图2。该氯化物固体属于______晶体,其中氯原子的配位数为________。
图2
(4)e元素与氧可形成如图3中A所示的正四面体离子eO,其中e在正四面体的体心,eO四面体通过共用顶角氧离子可形成B,则B的化学式为________。
图3
(5)单质a、f对应的元素以1∶1的原子个数比形成的分子(相同条件下对H2的相对密度为39)中含__________个σ键和____________个π键,其中f原子的杂化轨道类型为
____________________。
答案 (1)H3O+ [Cu(NH3)4]SO4·H2O
(2)s 9 B D
(3)分子 4
(4)Si3O
(5)12 1 sp2杂化
解析 根据c、d均是热和电的良导体,且d的熔点高于c,确定c是Na,d是Cu。根据熔点高低可判断a是H2,b是N2,e是Si,f是金刚石。
(1)a与b对应的关系为H与N,形成的10电子中性分子X是NH3,与NH3互为等电子体的带一个单位正电荷的是H3O+。NH3与Cu2+可形成配位键,故深蓝色晶体为[Cu(NH3)4]SO4·H2O。
(2)Na位于第三周期ⅠA族,位于s区,Cu原子的M层有9个轨道,均充满电子,故有9对自旋相反的电子,钠单质采用体心立方堆积,铜单质采用面心立方最密堆积。
(3)根据这种氯化物熔沸点较低、熔融态导电性差确定其应为分子晶体,其中与氯原子相连的Cu原子有4个,故配位数为4。
(4)B中含有3个Si原子和9个O原子,根据化合价可判断其化学式为Si3O。
(5)该分子的式量=39×2=78,则化学式为C6H6,分子中含有6个C—C σ键和6个C—H σ键,形成一个大π键,C原子采用sp2杂化。