- 1.10 MB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题6 化学能和热能
备考篇提纲挈领
【考情探究】
课
标
解
读
考点
化学反应中的热效应及热化学方程式
盖斯定律及其应用
解读
1.了解化学能与热能的相互转化及其应用。了解吸热反应、放热反应、反应热(焓变)等概念
2.了解热化学方程式的含义,能正确书写热化学方程式
理解盖斯定律,并能运用盖斯定律进行有关反应热的简单计算
考情分析
本专题的考题以容易题或中等题为主。设题形式通常有选择题和填空题。选择题通常以已知热化学方程式为载体,考查学生运用盖斯定律对未知热化学方程式进行正误判断,或根据生活常识以及所学知识对ΔH的正、负号进行判断;填空题通常根据已知热化学方程式运用盖斯定律求算未知热化学方程式的ΔH
备考指导
2021年高考备考重点关注热化学方程式的书写及正误判断,ΔH的求算及正、负号判断
【真题探秘】
基础篇固本夯基
【基础集训】
考点一 化学反应中的热效应及热化学方程式
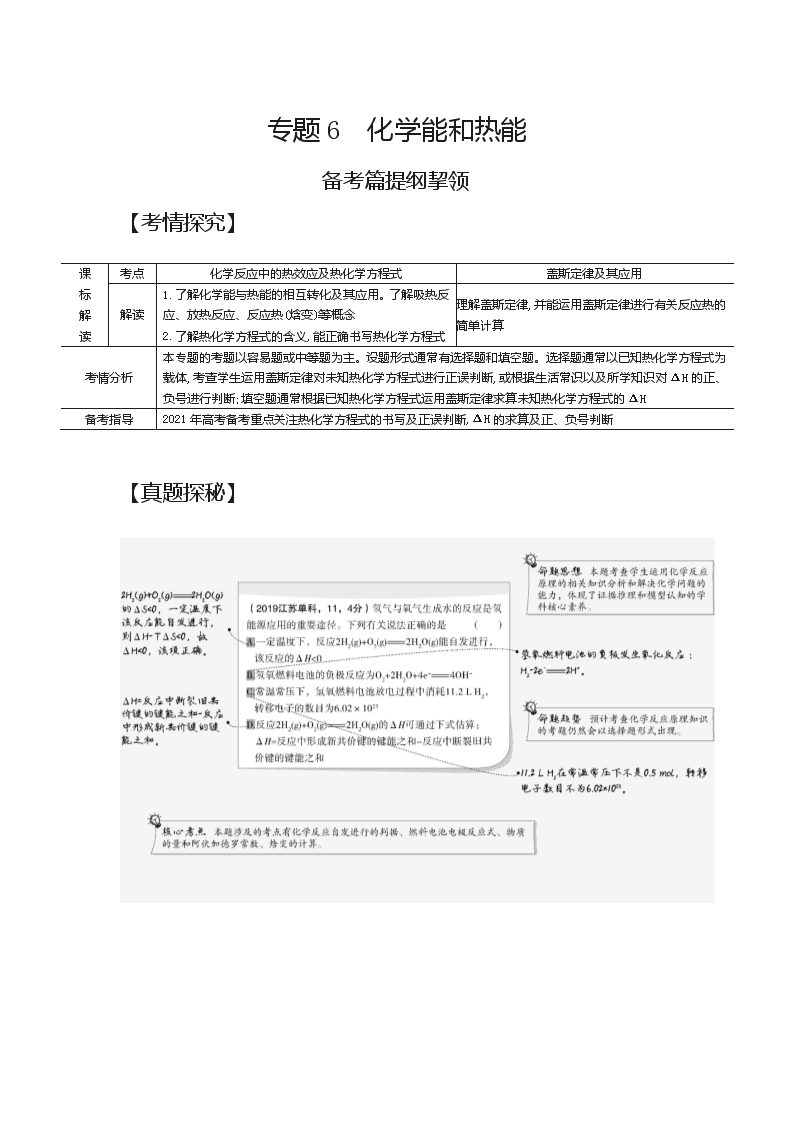
1.下列图示与对应的叙述相符的是( )
A.图甲表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图乙表示可逆反应中物质的浓度随时间的变化,且在t时刻达到平衡
C.图丙表示CH3COOH溶液中通入NH3至过量的过程中溶液的导电性变化
D.图丁表示0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HCl溶液的滴定曲线
答案 D
2.用Cl2生产某些含氯有机物时会产生副产物HCl。利用如下反应,可实现氯的循环利用:
4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH=-115.6kJ·mol-1
下列说法正确的是( )
A.升高温度能提高该反应中HCl的转化率
B.加入催化剂,能使该反应的焓变减小
C.1molCl2转化为2molCl原子放出243kJ热量
D.断裂H2O(g)中1molH—O键比断裂HCl(g)中1molH—Cl键所需能量高
答案 D
3.氢能是发展中的新能源。回答下列问题:
(1)氢气可用于制备绿色氧化剂H2O2。
已知:H2(g)+X(l)Y(l) ΔH1
O2(g)+Y(l)X(l)+H2O2(l) ΔH2
其中X、Y为有机物,两反应均为自发反应,则H2(g)+O2(g)H2O2(l)的ΔH<0,其原因是
。
(2)硼氢化钠(NaBH4)是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为 。
答案 (1)ΔH=ΔH1+ΔH2,且ΔH1<0,ΔH2<0,故ΔH1+ΔH2<0
(2)NaBH4+2H2ONaBO2+4H2↑
考点二 盖斯定律及其应用
4.现代火法炼锌过程中发生了以下三个主要反应:
①2ZnS(s)+3O2(g)2ZnO(s)+2SO2(g) ΔH1=akJ·mol-1;
②2C(s)+O2(g)2CO(g) ΔH2=bkJ·mol-1;
③ZnO(s)+CO(g)Zn(g)+CO2(g) ΔH3=ckJ·mol-1。
下列说法正确的是( )
A.以上三个反应中,只有反应①是放热反应
B.反应②的作用是仅为反应③提供还原剂
C.反应ZnS(s)+C(s)+2O2(g)Zn(g)+SO2(g)+CO2(g)的ΔH=a+b+2c2kJ·mol-1
D.用这种方法得到的是纯净的锌单质
答案 C
5.CO、H2、C2H5OH三种燃料燃烧的热化学方程式如下:
①CO(g)+12O2(g)CO2(g) ΔH1=akJ·mol-1;
②H2(g)+12O2(g)H2O(g) ΔH2=bkJ·mol-1;
③C2H5OH(l)+3O2(g)2CO2(g)+3H2O(g) ΔH3=ckJ·mol-1。
下列说法正确的是( )
A.ΔH1>0
B.2H2O(l)2H2(g)+O2(g) ΔH=-2bkJ·mol-1
C.CO2与H2合成C2H5OH反应的原子利用率为100%
D.2CO(g)+4H2(g)H2O(g)+C2H5OH(l) ΔH=(2a+4b-c)kJ·mol-1
答案 D
6.将甘油(C3H8O3)转化成高附加值产品是当前研究热点,甘油和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ:C3H8O3(l)+3H2O(g)3CO2(g)+7H2(g) ΔH1
反应Ⅱ:2C3H8O3(l)+3O2(g)6CO2(g)+8H2(g) ΔH2=akJ·mol-1
反应Ⅲ:2H2(g)+O2(g)2H2O(g) ΔH3=bkJ·mol-1
ΔH1= 。
答案 12(a-3b)kJ·mol-1
综合篇知能转换
【综合集训】
1.(2020届盐城中学学情测试一,4)化学家已发现在高压下氮气会聚合成高聚氮晶体(用N表示),该晶体中相邻氮原子间以氮氮单键连接形成空间网状结构,每个氮原子最外层均满足8电子稳定结构。这种高聚氮的N—N键键能为160kJ/mol(N2的键能为942kJ/mol)。下列有关高聚氮说法不正确的是( )
A.该晶体中每个氮原子与其他3个氮原子相连
B.该晶体属于分子晶体,它与N2属于同素异形体
C.理论上该高聚氮可作为高能炸药,爆炸后生成氮气,通过计算得该反应为放热反应
D.高聚氮爆炸生成氮气的反应在任何温度下均可自发进行
答案 B
2.(2019苏南苏北五校联考二,10)关于下图所示转化关系(X代表卤素)的说法不正确的是( )
A.2H(g)+2X(g)2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1=ΔH2+ΔH3
C.Cl、Br、Ⅰ的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
答案 C
3.(2018徐淮连宿期末,8)通过以下反应均可获得O2。下列有关说法不正确的是( )
①光催化分解水制氧气:2H2O(l)2H2(g)+O2(g) ΔH1=+571.6kJ·mol-1
②过氧化氢分解制氧气:2H2O2(l)2H2O(l)+O2(g) ΔH2=-196.4kJ·mol-1
③一氧化氮分解制氧气:2NO(g)N2(g)+O2(g) ΔH3=-180.5kJ·mol-1
A.反应①是人们获取H2的途径之一
B.反应②、③都是将化学能转化为热能
C.反应H2O2(l)H2O(g)+12O2(g)的ΔH=-98.2kJ·mol-1
D.反应2H2(g)+2NO(g)N2(g)+2H2O(l)的ΔH=-752.1kJ·mol-1
答案 C
4.[2020届南通如皋中学阶段测试一,20(1)]大气污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。
(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。
使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)2NO(g) ΔH1=+180.5kJ·mol-1
2C(s)+O2(g)2CO(g) ΔH2=-221kJ·mol-1
C(s)+O2(g)CO2(g) ΔH3=-393.5kJ·mol-1
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式:
。
答案 (1)2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-746.5kJ·mol-1
应用篇知行合一
【应用集训】
1.(2020届扬州中学开学测试一,9)接触法制硫酸工艺三个步骤中的热化学方程式如下,下列说法正确的是( )
①4FeS2(s)+11O2(g)2Fe2O3(s)+8SO2(g) ΔH1=-3412kJ·mol-1
②2SO2(g)+O2(g)2SO3(g) ΔH2=-196.6kJ·mol-1
③SO3(g)+H2O(l)H2SO4(l) ΔH3=-130.3kJ·mol-1
A.反应①为吸热反应
B.反应②使用催化剂V2O5,ΔH2减小
C.反应③在接触室中进行
D.以FeS2为原料,理论上生产2molH2SO4(l)所释放出的热量为1310.2kJ
答案 D
2.(2019盐城期中,15)MAN公司提出的“VHRO”系统(V、H、R、O表示相应部位的某种催化剂)是一种净化柴油机尾气的模型,其示意图及相应热化学方程式如下所示:
①(V) 2NO(g)+O2(g)2NO2(g) ΔH1=-114.0kJ·mol-1
②(H) CO(NH2)2(aq)+H2O(l)2NH3(g)+CO2(g)
ΔH2=+119.2kJ·mol-1
③(R) 2NH3(g)+NO(g)+NO2(g)2N2(g)+3H2O(g) ΔH3=-759.0kJ·mol-1
④(O) 4NH3(g)+3O2(g)2N2(g)+6H2O(g)
ΔH4=-1530.0kJ·mol-1
下列说法正确的是( )
A.反应②为放热反应,其余为吸热反应
B.反应N2(g)+O2(g)2NO(g)的ΔH>0
C.反应4NH3(g)+4NO(g)+O2(g)4N2(g)+6H2O(g)的ΔH=-1632.0kJ·mol-1
D.设计反应④是为了提高“VHRO”系统所需的工作温度
答案 BC
3.[2020届扬州中学开学测试,19(3)]CO2的资源化对于构建低碳社会具有重要意义。
(3)利用CO2制备CH3OH的反应如下:
反应a:CO2(g)+H2(g)CO(g)+H2O(g) ΔH1=+41.19kJ·mol-1
反应b:CO(g)+2H2(g)CH3OH(g) ΔH2=-90.77kJ·mol-1
反应c:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH3
①反应a在一定条件下能自发进行的原因是 。ΔH3= kJ·mol-1,反应c的平衡常数表达式K= 。
②T℃时反应c的平衡常数为2.5,并测得该温度下反应c在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.1、0.5、0.3、0.15,则此时反应c将 移动(填“正向”“逆向”或“不”)。
答案 (3)①ΔS>0 -49.58 c(CH3OH)·c(H2O)c(CO2)·c3(H2)
②逆向
4.[2019盐城期中,20(2)]氨在化肥生产、储氢及环境治理等领域正发挥着重要作用。
(2)2017年Dr.KatsutoshiNagaoka等带领的研究团队开发了一种可以“快速启动的氨制氢工艺”(如图所示)。已知下列键能数据:
化学键
N—H
OO
H—H
O—H
键能(kJ·mol-1)
390.8
497.3
436.0
946
462.8
则反应NH3(g)+0.25O2(g)H2(g)+0.5N2(g)+0.5H2O(g)的ΔH= kJ·mol-1(结果保留整数)。
答案 (2)-75
【五年高考】
考点一 化学反应中的热效应及热化学方程式
1.(2016江苏单科,8,2分)通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)2H2(g)+O2(g) ΔH1=571.6kJ·mol-1
②焦炭与水反应制氢:C(s)+H2O(g)CO(g)+H2(g) ΔH2=131.3kJ·mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH3=206.1kJ·mol-1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)C(s)+2H2(g)的ΔH=74.8kJ·mol-1
答案 D
2.(2015江苏单科,3,2分)下列说法正确的是( )
A.分子式为C2H6O的有机化合物性质相同
B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能
途径a:CCO+H2CO2+H2O
途径b:CCO2
C.在氧化还原反应中,还原剂失去电子的总数等于氧化剂得到电子的总数
D.通过化学变化可以直接将水转变为汽油
答案 C
3.(2019北京理综,7,6分)下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)( )
A
B
C
D
NaCl溶于水
电解CuCl2溶液
CH3COOH在
水中电离
H2与Cl2反应
能量变化
NaClNa++Cl-
CuCl2
Cu2++2Cl-
CH3COOH
CH3COO-+H+
H2(g)+Cl2(g)
2HCl(g)
ΔH=-183kJ·mol-1
答案 B
考点二 盖斯定律及其应用
4.[2018江苏单科,20(1),2分]NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)HNO3(aq)+HNO2(aq) ΔH=-116.1kJ·mol-1
3HNO2(aq)HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9kJ·mol-1
反应3NO2(g)+H2O(l)2HNO3(aq)+NO(g)的ΔH= kJ·mol-1。
答案 (1)-136.2
5.(2019课标Ⅱ,27,15分)环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:(g)(g)+H2(g) ΔH1=100.3kJ·mol-1 ①
H2(g)+I2(g)2HI(g) ΔH2=-11.0kJ·mol-1 ②
对于反应:(g)+I2(g)(g)+2HI(g) ③ ΔH3= kJ·mol-1。
(2)某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为 ,该反应的平衡常数Kp= Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有 (填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是 (填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45mol·L-1
(4)环戊二烯可用于制备二茂铁[Fe(C5H5)2,结构简式为],后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
该电解池的阳极为 ,总反应为 。电解制备需要在无水条件下进行,原因为 。
答案 (1)89.3
(2)40% 3.56×104 BD
(3)CD
(4)Fe电极
水会阻碍中间物Na的生成;水会电解生成OH-,进一步与Fe2+反应生成Fe(OH)2
教师专用题组
考点一 化学反应中的热效应及热化学方程式
1.(2012江苏单科,4,2分)某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
答案 C
2.(2017天津理综,3,6分)下列能量转化过程与氧化还原反应无关的是( )
A.硅太阳能电池工作时,光能转化成电能
B.锂离子电池放电时,化学能转化成电能
C.电解质溶液导电时,电能转化成化学能
D.葡萄糖为人类生命活动提供能量时,化学能转化成热能
答案 A
3.(2015北京理综,9,6分)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
答案 C
考点二 盖斯定律及其应用
4.(2014江苏单科,10,2分)已知:C(s)+O2(g)CO2(g) ΔH1
CO2(g)+C(s)2CO(g) ΔH2
2CO(g)+O2(g)2CO2(g) ΔH3
4Fe(s)+3O2(g)2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5
答案 C
5.(2015重庆理综,6,6分)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)K2S(s)+N2(g)+3CO2(g) ΔH=xkJ·mol-1
已知:碳的燃烧热ΔH1=akJ·mol-1
S(s)+2K(s)K2S(s) ΔH2=bkJ·mol-1
2K(s)+N2(g)+3O2(g)2KNO3(s) ΔH3=ckJ·mol-1
则x为( )
A.3a+b-c B.c-3a-b
C.a+b-c D.c-a-b
答案 A
6.[2011江苏单科,20(1),2分]氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=206.2kJ·mol-1
CH4(g)+CO2(g)2CO(g)+2H2(g)
ΔH=247.4kJ·mol-1
2H2S(g)2H2(g)+S2(g) ΔH=169.8kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
答案 (1)CH4(g)+2H2O(g)CO2(g)+4H2(g) ΔH=165.0kJ·mol-1
7.(2010江苏单科,17,8分)下表列出了3种燃煤烟气脱硫方法的原理。
方法Ⅰ
用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4
方法Ⅱ
用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫
方法Ⅲ
用Na2SO3溶液吸收SO2,再经电解转化为H2SO4
(1)方法Ⅰ中氨水吸收燃煤烟气中SO2的化学反应为:
2NH3+SO2+H2O(NH4)2SO3
(NH4)2SO3+SO2+H2O2NH4HSO3
能提高燃煤烟气中SO2去除率的措施有 (填字母)。
A.增大氨水浓度
B.升高反应温度
C.使燃煤烟气与氨水充分接触
D.通入空气使HSO3-转化为SO42-
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的CO2,原因是 (用离子方程式表示)。
(2)方法Ⅱ中主要发生了下列反应:
2CO(g)+SO2(g)S(g)+2CO2(g)
ΔH=8.0kJ·mol-1
2H2(g)+SO2(g)S(g)+2H2O(g)
ΔH=90.4kJ·mol-1
2CO(g)+O2(g)2CO2(g)
ΔH=-566.0kJ·mol-1
2H2(g)+O2(g)2H2O(g)
ΔH=-483.6kJ·mol-1
S(g)与O2(g)反应生成SO2(g)的热化学方程式可表示为 。
(3)方法Ⅲ中用惰性电极电解NaHSO3溶液的装置如下图所示。阳极区放出气体的成分为 (填化学式)。
答案 (1)AC HCO3-+SO2CO2+HSO3-
(2)S(g)+O2(g)SO2(g) ΔH=-574.0kJ·mol-1
(3)O2、SO2
8.(2015四川理综,11,16分)为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
稀H2SO4 活化硫铁矿 FeCO3 空气
硫铁矿烧渣滤液滤液滤液FeSO4晶体
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O15FeSO4+8H2SO4,不考虑其他反应。
请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:
4Fe(s)+3O2(g)2Fe2O3(s) ΔH=-1648kJ/mol
C(s)+O2(g)CO2(g) ΔH=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)2FeCO3(s)
ΔH=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2Fe+2Li2S,正极反应式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%。将akg质量分数为b%的硫酸加入到ckg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
答案 (1)Fe2O3+6H+2Fe3++3H2O
(2)C
(3)Fe2+被氧化为Fe3+,Fe3+水解产生H+
(4)4FeCO3(s)+O2(g)2Fe2O3(s)+4CO2(g) ΔH=-260kJ/mol
(5)FeS2+4Li++4e-Fe+2Li2S或FeS2+4e-Fe+2S2-
(6)0.0118ab-0.646c或29ab2450-1131c1750
9.(2015广东理综,31,16分)用O2将HCl转化为Cl2,可提高效益,减少污染。
(1)传统上该转化通过如图所示的催化循环实现。其中,反应①为:
2HCl(g)+CuO(s)H2O(g)+CuCl2(s) ΔH1
反应②生成1molCl2(g)的反应热为ΔH2,则总反应的热化学方程式为 (反应热用ΔH1和ΔH2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl~T曲线如图所示,则总反应的ΔH 0(填“>”“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 。
②在上述实验中若压缩体积使压强增大,画出相应αHCl~T曲线的示意图,并简要说明理由: 。
③下列措施中,有利于提高αHCl的有 。
A.增大n(HCl) B.增大n(O2)
C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t/min
0
2.0
4.0
6.0
8.0
n(Cl2)/10-3mol
0
1.8
3.7
5.4
7.2
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol·min-1为单位,写出计算过程)。
答案 (1)4HCl(g)+O2(g)2H2O(g)+2Cl2(g) ΔH=2ΔH1+2ΔH2
(2)①< K(A)
②
相同温度时,压强越大,HCl的平衡转化率越大;相同压强时,升高温度,HCl的平衡转化率降低 ③BD
(3)v(HCl)=5.4×10-3mol-1.8×10-3mol4.0min×2=1.8×10-3mol·min-1
【三年模拟】
一、选择题(每题4分,共40分)
1.(2020届南通通州学情调研一,13)根据下列图示所得出的结论正确的是( )
A.图甲表示H2和O2反应生成H2O过程中的能量变化曲线,可推知H2O比O2稳定
B.图乙表示70℃时不同条件下H2O2的浓度随时间变化的曲线,可推知H2O2只有在碱性条件下才发生水解
C.图丙表示KNO3、NaCl的溶解度随温度变化的曲线,可推知提纯含有少量NaCl杂质的KNO3晶体,应采用蒸发结晶的方法
D.图丁表示光照下氯水的pH随时间的变化曲线,可推知光照后溶液中Cl-浓度增大
答案 D
2.(2020届连云港新海中学开学测试,10)下列图示与对应叙述相符合的是( )
A.由图甲可知,从能量角度考虑,金刚石比石墨稳定
B.图乙表示CO2通入饱和Na2CO3溶液中,溶液导电能力的变化
C.图丙表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应2NO2(g)N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
D.图丁表示某可逆反应的反应速率随时间的变化,t0时刻改变的条件一定是使用了催化剂
答案 C
3.(2020届扬州中学开学测试,10)下列图像与对应叙述相符的是 ( )
A.图甲表示等体积等浓度的盐酸和醋酸的pH加水稀释后的变化
B.图乙表示2SO2(g)+O2(g)2SO3(g) ΔH<0,在t1时刻降低温度SO2浓度的变化
C.由图丙可知H2的燃烧热为-285.8kJ/mol
D.图丁表示以铜为电极电解硫酸铜溶液时阳极产物的物质的量与转移电子的关系
答案 C
4.(2020届仿真冲刺练二,10)下列说法正确的是( )
A.甲烷燃烧时,化学能全部转化为热能
B.反应3Si(s)+2N2(g)Si3N4(s)能自发进行,则该反应为放热反应
C.1molCl2与足量的NaOH溶液充分反应,转移电子的数目为2×6.02×1023
D.常温下,pH=2的醋酸溶液与pH=12的NaOH溶液混合后的溶液呈酸性
答案 B
5.(2019苏锡常镇一模,13)下列图示与对应的叙述相符的是( )
A.由图甲可知,2SO3(g)2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1
B.图乙表示Al3+与OH-反应时溶液中含铝微粒浓度变化,a点溶液中存在大量Al3+
C.图丙表示温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)
D.图丁表示反应N2(g)+3H2(g)2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
答案 C
6.(2019江苏七市二模,7)已知:①N2O(g)+3H2(g)N2H4(l)+H2O(l) ΔH1
②N2(g)+3H2(g)2NH3(g) ΔH2
③2NH3(g)+3N2O(g)4N2(g)+3H2O(l) ΔH3
④3N2H4(l)4NH3(g)+N2(g) ΔH
下列有关说法正确的是( )
A.ΔH=3(ΔH2-ΔH1)+ΔH3
B.使用催化剂可使ΔH1变小
C.反应②在一定条件下能自发进行,则ΔH2>0
D.反应③若生成28gN2,转移的电子数为6.02×1023
答案 A
7.(2019苏州期末,8)以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确的是( )
①6CO2(g)+6H2O(l)C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)2CO2(g)+3H2O(l) ΔH3
A.2ΔH3=-ΔH1-ΔH2
B.植物的光合作用通过反应①将热能转化为化学能
C.在不同油耗汽车中发生反应③,ΔH3会不同
D.若反应①生成1.12LO2,则转移的电子数为0.2×6.02×1023
答案 A
8.(2019泰州中学、宜兴中学联考,8)已知:①2H2S(g)+SO2(g)3S(s)+2H2O(l) ΔH1=-154kJ·mol-1
②S(s)+O2(g)SO2(g) ΔH2=-297kJ·mol-1
③2H2S(g)+O2(g)2S(s)+2H2O(l) ΔH3
④2H2S(g)+3O2(g)2SO2(g)+2H2O(l) ΔH4
下列说法正确的是( )
A.ΔH3=+143kJ·mol-1
B.ΔH3>ΔH4
C.S(g)+O2(g)SO2(g) ΔH,则ΔH>ΔH2
D.常温下还原性:H2SA
C.图丙表示镁条放入盐酸中生成氢气的速率随时间的变化,0~t1反应速率加快的原因可能是该反应为放热反应
D.图丁表示常温下稀释pH相同的氢氟酸与盐酸时溶液pH与加入水体积的关系,则氢氟酸为弱酸,且a点KW的数值比b点的大
答案 C
10.(2018苏南苏北七市三模,10)向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响。反应原理如下:
Cu(s)+Cu2+(aq)2Cu+(aq) ΔH1=akJ·mol-1
Cl-(aq)+Cu+(aq)CuCl(s) ΔH2=bkJ·mol-1
实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。
下列说法正确的是( )
A.溶液pH越大,Ksp(CuCl)越大
B.向电解液中加入稀硫酸,有利于Cl-的去除
C.反应达到平衡后增大c(Cu2+),c(Cl-)减小
D.12Cu(s)+12Cu2+(aq)+Cl-(aq)CuCl(s)的ΔH=(a+2b)kJ·mol-1
答案 C
二、非选择题(共40分)
11.[2020届连云港新海中学学情检测二,20(1)](2分)烟气中的氮氧化物是造成大气污染的重要因素。
(1)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
则N2(g)和O2(g)反应生成NO(g)的热化学方程式为
。
答案 (1)N2(g)+O2(g)2NO(g) ΔH=+184kJ·mol-1
12.(2020届仿真冲刺练二,20Ⅰ)(6分)甲醇不仅是重要的化工原料,还是性能优良的能源和车用燃料。
Ⅰ.甲醇水蒸气重整制氢是电动汽车氢氧燃料电池理想的氢源,生产过程中同时也产生CO,CO会损坏燃料电池的交换膜。相关反应如下:
反应①:CH3OH(g)+H2O(g)CO2(g)+3H2(g) ΔH1
反应②:H2(g)+CO2(g)CO(g)+H2O(g) ΔH2=+41kJ·mol-1
如图表示恒压容器中0.5molCH3OH(g)和0.5molH2O(g)转化率达80%时的能量变化。
(1)计算反应①的ΔH1= 。
(2)反应①能够自发进行的原因是 ,升温有利于提高CH3OH的转化率,但也存在一个明显的缺点是 。
答案 Ⅰ.(1)+49kJ·mol-1
(2)该反应为熵增反应 CO含量升高,损坏燃料电池的交换膜
13.(2020届仿真冲刺练一,20)(14分)工业上以煤和水为原料通过一系列转化可产生清洁能源氢气或工业原料甲醇。
(1)已知:①C(s)+O2(g)CO2(g) ΔH1
②2H2(g)+O2(g)2H2O(l) ΔH2
③H2O(l)H2O(g) ΔH3
则碳与水蒸气反应C(s)+2H2O(g)CO2(g)+2H2(g)的ΔH= 。
(2)工业上也可以仅利用碳和水蒸气反应得到的CO2和H2进一步合成甲醇,反应的热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0。
①此生产过程中CO2和H2的转化率 (填“前者大”“后者大”“一样大”或“无法判断”);为了既提高甲醇的产率又加快反应速率,可以采取的措施是 。
②在一恒温恒容密闭容器中充入1molCO2和3molH2进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。该温度下的平衡常数为 (保留三位有效数字)。
(3)改变温度,使反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器),反应过程中部分数据见下表:
反应时间/
min
n(CO2)/mol
n(H2)/mol
n(CH3OH)/
mol
n(H2O)/mol
反应Ⅰ
恒温恒容
0
2
6
0
0
10
4.5
20
1
30
1
反应Ⅱ
绝热恒容
0
0
0
2
2
①达到平衡时,反应Ⅰ、反应Ⅱ对比:平衡常数K(Ⅰ) (填“>”“<”或“=”,下同)K(Ⅱ);平衡时CH3OH的浓度c(Ⅰ) c(Ⅱ)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)= ,若30min时向容器中再充入1molCO2(g)和1molH2O(g),则平衡 (填“正向”“逆向”或“不”)移动。
答案 (1)ΔH1-ΔH2-2ΔH3
(2)①后者大 增大压强(或增大CO2和H2的浓度)
②5.33
(3)①< < ②0.025mol·L-1·min-1 不
14.[2019南通一模,20(1)](2分)消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)2NO(g) ΔH=akJ·mol-1
2NO(g)+O2(g)2NO2(g) ΔH=bkJ·mol-1
4NH3(g)+5O2(g)4NO(g)+6H2O(l) ΔH=ckJ·mol-1
反应8NH3(g)+6NO2(g)7N2(g)+12H2O(l) ΔH= kJ·mol-1。
答案 (1)2c-3b-7a
15.[2019第一次全国大联考·江苏卷,20(1)](2分)Cu2O广泛用作颜料、光敏材料、能源行业的催化剂。
(1)已知还原法制备Cu2O的原理为:
N2H4(l)+O2(g)N2(g)+2H2O(l) ΔH1=-akJ·mol-1
Cu(OH)2(s)CuO(s)+H2O(l) ΔH2=+bkJ·mol-1
4CuO(s)2Cu2O(s)+O2(g) ΔH3=+ckJ·mol-1
则由N2H4和Cu(OH)2反应制备Cu2O的热化学方程式为 。
答案 (1)N2H4(l)+4Cu(OH)2(s)2Cu2O(s)+N2(g)+6H2O(l) ΔH=(-a+4b+c)kJ·mol-1
16.[2019徐州、淮安、连云港调研,20(1)](2分)SO2、NO是大气污染物,NH4NO3、H2SO4等是水体污染物,有效去除这些污染物是一项重要课题。
(1)NO、SO2可以先氧化,后用碱吸收。其氧化过程的反应原理如下:
NO(g)+O3(g)NO2(g)+O2(g) ΔH1=-200.9kJ·mol-1
SO2(g)+O3(g)SO3(g)+O2(g) ΔH2=-241.6kJ·mol-1
2SO2(g)+O2(g)2SO3(g) ΔH3=-196.6kJ·mol-1
则反应2NO2(g)2NO(g)+O2(g)的ΔH= kJ·mol-1。
答案 (1)+115.2
17.[2019江苏七市三模,20(1)](2分)有效去除废水中的H2SiF6、F-,改善水质是环境部门的重要研究课题。
(1)AlF3是有机合成中常用催化剂,利用废水中的H2SiF6可转变制得,相关的热化学方程式如下:
3H2SiF6(aq)+2Al(OH)3(s)Al2(SiF6)3(aq)+6H2O(l)
ΔH=akJ·mol-1
Al2(SiF6)3(aq)+6H2O(l)2AlF3(aq)+3SiO2(s)+12HF(aq) ΔH=bkJ·mol-1
3HF(aq)+Al(OH)3(s)AlF3(aq)+3H2O(l) ΔH=ckJ·mol-1
反应H2SiF6(aq)+2Al(OH)3(s)2AlF3(aq)+SiO2(s)+4H2O(l)的ΔH= kJ·mol-1。
答案 (1)a+b+4c3
18.[2018南京、盐城、连云港二模,20(1)(2)](6分)氨氮是水体中氮的主要形态之一,氨氮含量过高会对水中生物的生存构成威胁。
(1)一定条件下,可将水中的氨氮转化为氮气而除去。
已知:2NH4+(aq)+3O2(g)2NO2-(aq)+2H2O(l)+4H+(aq) ΔH1=akJ·mol-1
2NO2-(aq)+O2(g)2NO3-(aq) ΔH2=bkJ·mol-1
5NH4+(aq)+3NO3-(aq)4N2(g)+9H2O(l)+2H+(aq) ΔH3=ckJ·mol-1
则4NH4+(aq)+3O2(g)2N2(g)+6H2O(l)+4H+(aq) ΔH= kJ·mol-1(用含a、b、c的代数式表示)。
(2)实验室用电解法模拟处理含氨氮的废水。电解时,不同氯离子浓度对溶液中剩余氨氮浓度的影响如图所示。增大氯离子浓度可使氨氮去除率 (填“增大”“减小”或“不变”),其主要原因可能是
。
答案 (1)14(3a+3b+2c)
(2)增大 阳极生成的Cl2能够将NH4+氧化为N2而除去
19.[2018常州教育学会学业水平监测,20(1)](4分)铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2(g)2Cu2O(s)+2SO2(g) ΔH1=-768.2kJ·mol-1
2Cu2O(s)+Cu2S(s)6Cu(s)+SO2(g) ΔH2=+116kJ·mol-1
①Cu2S(s)+O2(g)2Cu(s)+SO2(g) ΔH= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极。
答案 (1)①-217.4 ②阳