- 238.50 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
配套作业
1.下列说法中,不正确的是( )
A
B
钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀
钢铁表面水膜的酸性较强,发生析氢腐蚀
C
D
将锌板换成铜板对钢闸门保护效果更好
钢闸门作为阴极而受到保护
答案 C
解析 金属活泼性:Zn>Fe>Cu,所以若将锌板换成铜板,则先腐蚀活泼金属Fe,C错误;钢闸门与电源的负极相连而被保护,D正确。
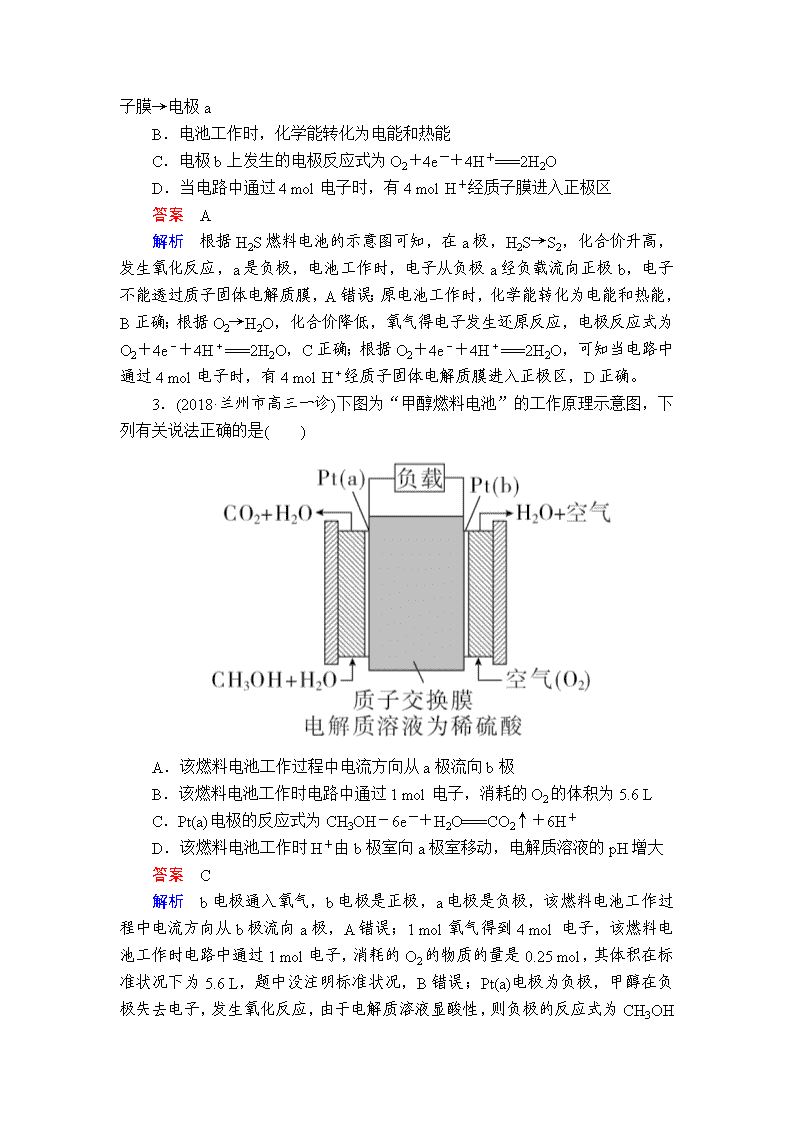
2.(2018·茂名市高三二模)H2S是一种剧毒气体,如图为质子固体电解质膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述错误的是( )
A.a是负极,电池工作时,电子的流动方向是:电极a→负载→电极b→
质子膜→电极a
B.电池工作时,化学能转化为电能和热能
C.电极b上发生的电极反应式为O2+4e-+4H+===2H2O
D.当电路中通过4 mol电子时,有4 mol H+经质子膜进入正极区
答案 A
解析 根据H2S燃料电池的示意图可知,在a极,H2S→S2,化合价升高,发生氧化反应,a是负极,电池工作时,电子从负极a经负载流向正极b,电子不能透过质子固体电解质膜,A错误;原电池工作时,化学能转化为电能和热能,B正确;根据O2→H2O,化合价降低,氧气得电子发生还原反应,电极反应式为O2+4e-+4H+===2H2O,C正确;根据O2+4e-+4H+===2H2O,可知当电路中通过4 mol电子时,有4 mol H+经质子固体电解质膜进入正极区,D正确。
3.(2018·兰州市高三一诊)下图为“甲醇燃料电池”的工作原理示意图,下列有关说法正确的是( )
A.该燃料电池工作过程中电流方向从a极流向b极
B.该燃料电池工作时电路中通过1 mol电子,消耗的O2的体积为5.6 L
C.Pt(a)电极的反应式为CH3OH-6e-+H2O===CO2↑+6H+
D.该燃料电池工作时H+由b极室向a极室移动,电解质溶液的pH增大
答案 C
解析 b电极通入氧气,b电极是正极,a电极是负极,该燃料电池工作过程中电流方向从b极流向a极,A错误;1 mol氧气得到4 mol 电子,该燃料电池工作时电路中通过1 mol电子,消耗的O2的物质的量是0.25 mol,其体积在标准状况下为5.6 L,题中没注明标准状况,B错误;Pt(a)电极为负极,甲醇在负极失去电子,发生氧化反应,由于电解质溶液显酸性,则负极的反应式为CH3OH
-6e-+H2O===CO2↑+6H+,C正确;原电池中阳离子向正极移动,该燃料电池工作时H+由a极室向b极室移动,D错误。
4.一种微生物燃料电池的结构如图所示,关于该电池的叙述错误的是( )
A.P电极上发生氧化反应
B.H+由Q电极向P电极移动
C.Q电极上的电极反应式为MnO2+4H++2e-===Mn2++2H2O
D.当电路中有2 mol电子通过时,P电极上会有0.5 mol CO2生成
答案 B
解析 形成原电池时,微生物所在电极区发生氧化反应,Cm(H2O)n 被氧化生成水和二氧化碳,MnO2被还原生成Mn2+,为原电池的正极。P电极是负极发生氧化反应,A正确;原电池工作时,阳离子向正极移动,B错误;MnO2被还原生成Mn2+,为原电池的正极,电极反应式为MnO2+4H++2e-===Mn2++2H2O,C正确;P电极上发生Cm(H2O)n~4me-→mCO2,故电路中转移2 mol e-时,P电极上产生0.5 mol CO2,D正确。
5.据报道,某公司新推出一款功能手机,该款手机使用新型锂钒氧化物电池,续航时间可达到27天。已知电池的总反应为V2O5+xLiLixV2O5,下列说法正确的是( )
A.电池在放电时,Li+向电源负极移动
B.充电时阳极的反应为LixV2O5-xe-===V2O5+xLi+
C.放电时负极失重7.0 g,则转移2 mol电子
D.该电池以Li、V2O5为电极,酸性溶液作介质
答案 B
解析 电池在放电时,Li+向正极移动,A错误;电池充电时阳极发生氧化反应,电极反应式是LixV2O5-xe-===V2O5+xLi+,B
正确;负极的反应为Li-e-===Li+,每消耗1 mol Li(7.0 g)则转移1 mol电子,C错误;Li是活泼金属,会与酸反应产生H2,因而电池介质不会是酸溶液,D错误。
6.(2018·合肥市高三质检)利用LiOH和钴氧化物可制备锂离子电池正极材料。可电解LiCl溶液制备LiOH,装置如图所示。下列说法正确的是( )
A.惰性电极B连接电源正极
B.A极区电解液为LiCl溶液
C.阳极反应式为:2H2O+2e-===H2↑+2OH-
D.每生成1 mol H2,有1 mol Li+通过阳离子交换膜
答案 B
解析 B极区产生H2,同时生成LiOH,故B极区电解液为LiOH溶液,惰性电极B上水电离出的H+发生还原反应生成H2,惰性电极B为阴极,与电源负极相连,A错误;惰性电极A为阳极,阳极上Cl-发生氧化反应,A极区电解液为LiCl溶液,B正确;阳极上Cl-发生氧化反应:2Cl--2e-===Cl2↑,C错误;每生成1 mol H2,转移2 mol电子,则有2 mol Li+通过阳离子交换膜,D错误。
7.用氟硼酸(HBF4,属于强酸)溶液代替稀硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,总反应方程式为Pb+PbO2+4HBF42Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质,下列说法正确的是( )
A.放电时,负极反应式为PbO2+4H++2e-===Pb2++2H2O
B.放电时,当正极质量减少23.9 g时,溶液中转移0.2 mol电子
C.充电时,PbO2电极附近溶液的pH减小
D.充电时,Pb电极的电极反应式为PbO2+4H++2e-===Pb2++2H2O
答案 C
解析 由总反应方程式知,Pb是还原剂,Pb在负极上失去电子,A错误;放电时正极上电极反应式为PbO2+4H++2e-===Pb2++2H2O,23.9 g就是减少的PbO2的质量,其物质的量为0.1 mol,转移电子的物质的量为0.2 mol,但电子只能通过导线转移,B错误:充电时PbO2电极与电源正极相连作阳极,电极反应式为Pb2++2H2O-2e-===PbO2+4H+,电极附近溶液pH减小,C正确;充电时,Pb电极为阴极,发生还原反应,电极反应式为Pb2++2e-===Pb,D错误。
8.(2018·湖北四校联考)用固体氧化物作电解质的甲醇-氧气燃料电池电解Na2SO4溶液制备白色的Fe(OH)2。其原理如图所示:
下列有关说法正确的是( )
A.Fe为阴极
B.碳棒Y上的电极反应式为O2+4e-+4H+===2H2O
C.碳棒X上的电极反应式为CH3OH-6e-+3O2-===CO2↑+2H2O
D.C电极的表面观察到Fe(OH)2白色沉淀
答案 C
解析 Fe失电子生成Fe2+,发生氧化反应,作阳极,A错误;固体氧化物作为电解质,因此电极反应式中不应出现H+,B错误、C正确;Fe(OH)2白色沉淀应在两极之间形成,而不是在电极表面,D错误。
9.(2018·福州市高三期末)电解法处理酸性含铬废水(主要含有Cr2O)过程,溶液中发生反应:Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,之后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
A.阳极反应为Fe-2e-===Fe2+
B.可用铁板作阴、阳极
C.电解过程中可能有Fe(OH)3沉淀生成
D.每有1 mol Cr2O被还原,电路中转移6 mol电子
答案 D
解析 电解法处理酸性含铬废水需要Fe2+,故应用Fe板作阳极,阳极反应为Fe-2e-===Fe2+,A正确;在电解池中,阴极不放电,故可用铁板作阴、阳极,B正确;电解时阴极反应为:2H++2e-===H2↑,随着溶液中c(H+) 减少,pH增大,Fe3+水解加剧,所以可能有Fe(OH)3 沉淀生成,C正确;根据关系式:6Fe~12e-~6Fe2+~Cr2O,可知每有1 mol Cr2O被还原,电路中转移12 mol电子,D错误。
10.(2018·石家庄市高三质检)NaBH4燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是( )
A.离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B.该燃料电池的负极反应式为BH+8OH--8e-===BO+6H2O
C.电解池中的电解质溶液可以选择CuSO4溶液
D.每消耗2.24 L O2(标准状况)时,A电极的质量减轻12.8 g
答案 D
解析 燃料电池中,通入燃料的电极为负极,通入氧化剂(O2)的电极为正极,原电池放电时,电解质溶液中阳离子向正极移动,由图可知,左极室中的电极为负极,右极室中的电极为正极,右极室中氢氧化钠浓度增大,则离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移,A正确;该燃料电池的负极反应式为BH+8OH--8e-===BO+6H2O,B正确;电解精炼铜时用含铜离子的电解质溶液做电解液,CuSO4溶液符合要求,C正确;电解精炼铜时,粗铜作阳极,与电源正极相连,放电时不只铜放电,杂质铁或锌也会放电,D错误。
11.(2018·南昌市高三一模)氨硼烷(NH3·BH3)电池可在常温下工作,
装置如图所示。该电池工作时的总反应为:NH3·BH3+3H2O2===NH4BO2+4H2O。下列说法正确的是( )
A.正极附近溶液的pH减小
B.电池工作时,H+通过质子交换膜向负极移动
C消耗3.1 g氨硼烷,理论上通过内电路的电子为0.6 mol
D.负极电极反应为:NH3·BH3+2H2O-6e-===NH+BO+6H+
答案 D
解析 根据原电池原理和总反应:NH3·BH3+3H2O2===NH4BO2+4H2O分析,正极是H2O2得电子发生还原反应,电极反应式为3H2O2+6H++6e-===6H2O,正极消耗氢离子,正极附近溶液的pH增大,A错误;放电时,阳离子向正极移动,H+通过质子交换膜向正极移动,B错误;左侧NH3·BH3在负极失电子发生氧化反应,负极电极反应式为NH3·BH3+2H2O-6e-===NH4BO2+6H+,则消耗3.1 g即0.1 mol氨硼烷,理论上通过外电路的电子为0.6 mol,C错误,D正确。