- 469.69 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时规范练12 氯、溴、碘及其化合物
(时间:45分钟 满分:100分)
一、选择题(本题共8小题,每小题6分,共48分,每小题只有一个选项符合题目要求)
1.下列叙述中正确的是( )。
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使润湿的淀粉-KI试纸变蓝色的物质一定是Cl2
C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
答案:A
解析:由于液溴容易挥发,密度大于水的密度,所以在存放液溴的试剂瓶中应加水封,A项正确;能使润湿的淀粉-KI试纸变蓝,不一定是氯气,B项错误;某溶液中加入CCl4,CCl4层显紫色,证明溶液中存在碘单质,C项错误;某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液可能含有Ag+或SO42-,D项错误。
2.实验室既可利用浓盐酸与MnO2在加热时反应制备Cl2,也可利用KMnO4与浓盐酸在常温下反应制备Cl2,下列有关说法不正确的是( )。
A.KMnO4的氧化性比MnO2的强
B.制备Cl2的整个实验过程中,只需要使用氧化剂与还原剂
C.用排空气法收集氯气,不需要利用其他试剂就能确定集气瓶中是否收集满气体
D.用足量MnO2与含有4 mol HCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol
答案:B
解析:比较反应的条件即可判断KMnO4的氧化性强于MnO2,A项正确;Cl2有毒,需要用碱溶液吸收尾气,B项错误;当集气瓶中充满黄绿色时表明已收集满了氯气,C项正确;浓盐酸变稀后不再与MnO2反应,故生成Cl2的物质的量小于1mol,D项正确。
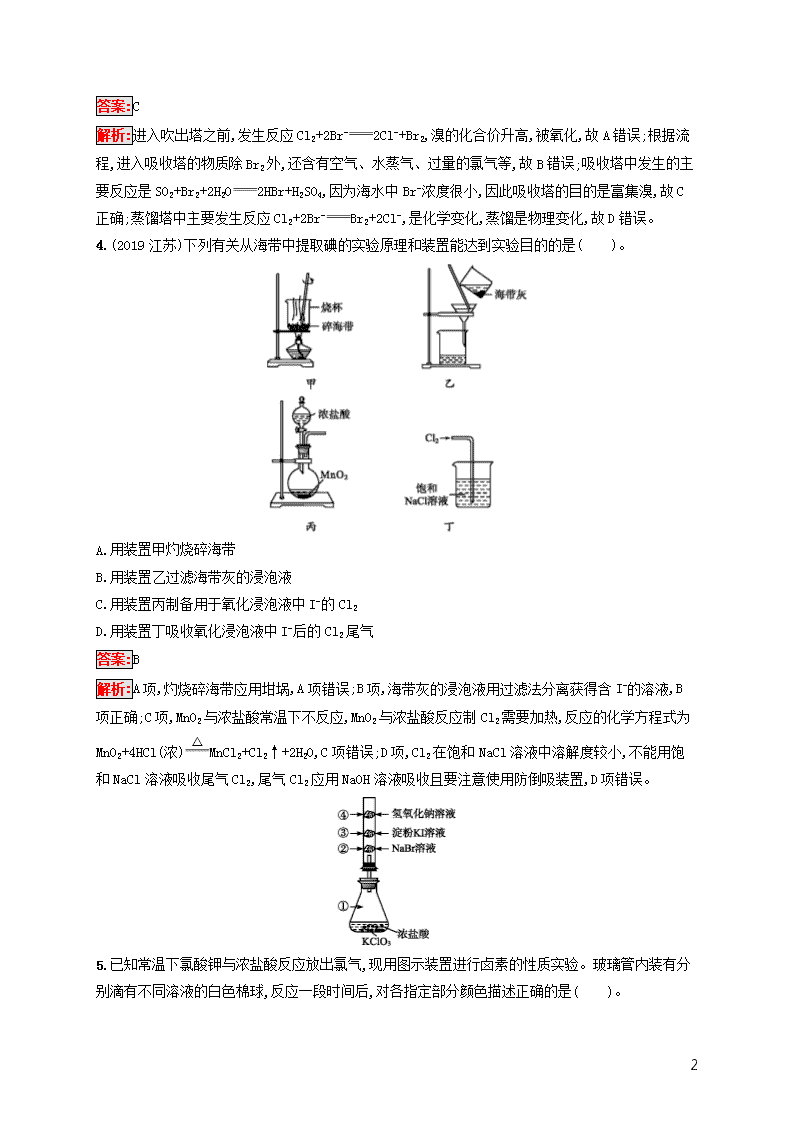
3.(2019北京海淀高三一模)“空气吹出法”海水提Br2的工艺流程如下:
下列说法中,正确的是( )。
A.进入吹出塔前,Br-被还原成了Br2
B.从吹出塔进入吸收塔的物质只有Br2
C.经过吸收塔后,溴元素得到了富集
D.蒸馏塔中只发生了物理变化
8
答案:C
解析:进入吹出塔之前,发生反应Cl2+2Br-2Cl-+Br2,溴的化合价升高,被氧化,故A错误;根据流程,进入吸收塔的物质除Br2外,还含有空气、水蒸气、过量的氯气等,故B错误;吸收塔中发生的主要反应是SO2+Br2+2H2O2HBr+H2SO4,因为海水中Br-浓度很小,因此吸收塔的目的是富集溴,故C正确;蒸馏塔中主要发生反应Cl2+2Br-Br2+2Cl-,是化学变化,蒸馏是物理变化,故D错误。
4.(2019江苏)下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( )。
A.用装置甲灼烧碎海带
B.用装置乙过滤海带灰的浸泡液
C.用装置丙制备用于氧化浸泡液中I-的Cl2
D.用装置丁吸收氧化浸泡液中I-后的Cl2尾气
答案:B
解析:A项,灼烧碎海带应用坩埚,A项错误;B项,海带灰的浸泡液用过滤法分离获得含I-的溶液,B项正确;C项,MnO2与浓盐酸常温下不反应,MnO2与浓盐酸反应制Cl2需要加热,反应的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,C项错误;D项,Cl2在饱和NaCl溶液中溶解度较小,不能用饱和NaCl溶液吸收尾气Cl2,尾气Cl2应用NaOH溶液吸收且要注意使用防倒吸装置,D项错误。
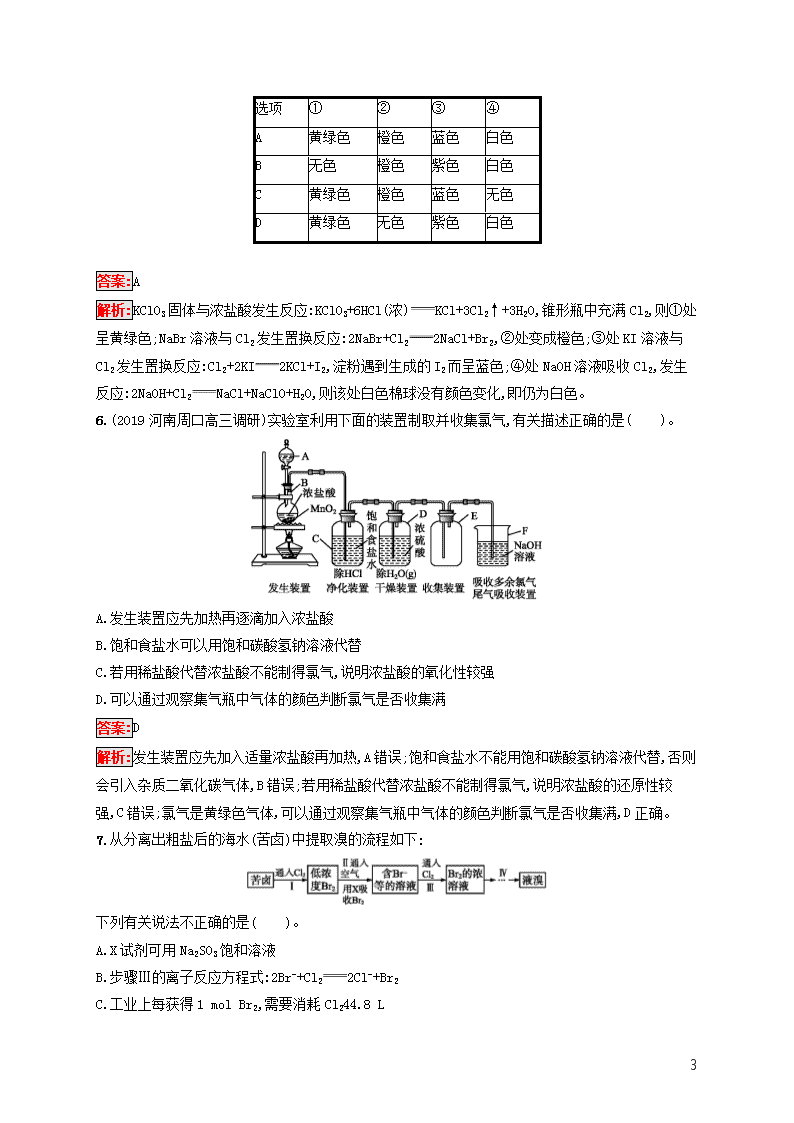
5.已知常温下氯酸钾与浓盐酸反应放出氯气,现用图示装置进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对各指定部分颜色描述正确的是( )。
8
选项
①
②
③
④
A
黄绿色
橙色
蓝色
白色
B
无色
橙色
紫色
白色
C
黄绿色
橙色
蓝色
无色
D
黄绿色
无色
紫色
白色
答案:A
解析:KClO3固体与浓盐酸发生反应:KClO3+6HCl(浓)KCl+3Cl2↑+3H2O,锥形瓶中充满Cl2,则①处呈黄绿色;NaBr溶液与Cl2发生置换反应:2NaBr+Cl22NaCl+Br2,②处变成橙色;③处KI溶液与Cl2发生置换反应:Cl2+2KI2KCl+I2,淀粉遇到生成的I2而呈蓝色;④处NaOH溶液吸收Cl2,发生反应:2NaOH+Cl2NaCl+NaClO+H2O,则该处白色棉球没有颜色变化,即仍为白色。
6.(2019河南周口高三调研)实验室利用下面的装置制取并收集氯气,有关描述正确的是( )。
A.发生装置应先加热再逐滴加入浓盐酸
B.饱和食盐水可以用饱和碳酸氢钠溶液代替
C.若用稀盐酸代替浓盐酸不能制得氯气,说明浓盐酸的氧化性较强
D.可以通过观察集气瓶中气体的颜色判断氯气是否收集满
答案:D
解析:发生装置应先加入适量浓盐酸再加热,A错误;饱和食盐水不能用饱和碳酸氢钠溶液代替,否则会引入杂质二氧化碳气体,B错误;若用稀盐酸代替浓盐酸不能制得氯气,说明浓盐酸的还原性较强,C错误;氯气是黄绿色气体,可以通过观察集气瓶中气体的颜色判断氯气是否收集满,D正确。
7.从分离出粗盐后的海水(苦卤)中提取溴的流程如下:
下列有关说法不正确的是( )。
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应方程式:2Br-+Cl22Cl-+Br2
C.工业上每获得1 mol Br2,需要消耗Cl244.8 L
8
D.步骤Ⅳ包含萃取、分液和蒸馏
答案:C
解析:Na2SO3+Br2+H2ONa2SO4+2HBr,A项正确;步骤Ⅲ利用氯气与含Br-溶液的置换反应制取Br2,B项正确;反应Ⅰ和反应Ⅲ均使用了Cl2,故制取1molBr2共消耗2mol氯气,但未标明氯气所处的温度和压强,无法确定其体积,C项错误;从浓溴水中提取溴,可利用有机溶剂(如苯)萃取溴,然后分液得到溴的有机溶液,再经蒸馏可得纯净的溴,D项正确。
8.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )。
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
答案:D
解析:氯水中存在化学平衡:Cl2+H2OH++Cl-+HClO,其中只有Cl2分子呈黄绿色,所以A项正确;在上述粒子中,能与Ag+生成不溶于强酸的白色沉淀的只有Cl-,所以B项正确;在上述粒子中,能使HCO3-转化为CO2气体的是H+,所以C项正确;Fe2+与Cl2反应也会生成Fe3+,使溶液变为棕黄色,所以D项错误。
二、非选择题(本题共3个小题,共52分)
9.(16分)某小组同学用如图装置进行实验探究(a、b、c表示止水夹)。请评价或完善其方案:
(1)将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①氯元素在元素周期表中的位置为 。
②写出装置A中反应的离子方程式: 。
③写出装置E中氢氧化钠溶液的作用: 。
在装置C中加入适量的水可制得氯水。将所得氯水分成两份进行实验,其操作、现象和结论如下表:
实验序号
实验操作
现象
结论
Ⅰ
将氯水滴入品红溶液
品红溶液褪色
氯气有漂白性
Ⅱ
氯水中加入碳酸氢钠粉末
有无色气体产生
氯气与水反应的产物具有酸性
8
④实验Ⅰ推出的相应结论是否合理? (填“合理”或“不合理”,下同),若不合理,请说明理由(若合理,无须填写,下同): 。
⑤实验Ⅱ推出的相应结论是否合理? ,若不合理,请说明理由: 。
(2)将装置B、D、E相连,在装置B中装浓硝酸和铜片,可制得NO2。写出装置B中反应的化学方程式: 。
答案:(1)①第3周期第ⅦA族
②MnO2+2Cl-+4H+Mn2++2H2O+Cl2↑
③吸收多余的Cl2(尾气处理)
④不合理 没有对比实验证明干燥的氯气有无漂白性
⑤不合理 制取的氯气中含HCl气体,其溶于水能与NaHCO3反应产生CO2气体
(2)Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O
解析:(1)①氯原子的核电荷数是17,氯元素在元素周期表中位于第3周期第ⅦA族;②MnO2和浓盐酸在加热条件下制取氯气,反应的离子方程式为MnO2+2Cl-+4H+Mn2++2H2O+Cl2↑;③氯气有毒,装置E中氢氧化钠溶液的作用是吸收氯气,防止污染;④没有对比实验证明干燥的氯气有无漂白性,无法确认有漂白作用的是氯气还是氯气与水反应的产物(实际上干燥的氯气没有漂白性),所以推论不合理;⑤用浓盐酸制取的氯气中含HCl气体,其溶于水能与NaHCO3反应产生CO2气体,不能证明氯气与水反应的产物具有酸性。
(2)浓硝酸和铜片反应的化学方程式为Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O。
10.(20分)微型实验具有设计简单、节约药品等优点,某化学活动小组利用所学知识设计氯气制备和性质实验如下。回答下列问题:
Ⅰ.氯气的制备:
(1)若实验室通过反应2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O制取少量氯气,反应的最佳装置应选用下图中 。
(2)利用下图装置收集纯净的氯气,其连接顺序为:发生装置 (按气流方向,用字母表示)。
8
(3)A、B两组同学分别用两种方法制取氯气,A组用含146 g HCl的浓盐酸与足量的二氧化锰反应;B组用87 g二氧化锰与足量的浓盐酸反应,则所得氯气物质的量的大小关系为A (填“>”“<”或“=”)B。
Ⅱ.氯气微型实验:
(1~6处分别为蘸有溶液的棉花球)
(4)根据图示,完成下表。
位置
实验现象
解释原因
6
溶液变黄色
离子方程式
5
Cl2+HS-2Cl-+S↓+H+
4
氯气的氧化性强于碘单质
(5)仔细观察上述装置,利用该套装置 (填“能”或“不能”)证明溴单质的氧化性强于碘,若能应如何操作(若不能请解释为什么) 。
答案:(1)C
(2)c→d→a→b→g→f→e
(3)<
(4)Cl2+2Br-2Cl-+Br2 有黄色固体析出 溶液变蓝色
(5)能 打开2下方的弹簧夹,使氯气缓慢上升到2位置,待溶液变黄色立即夹住弹簧夹,不使氯气上升。然后取下上节玻璃管,在2处微微加热,观察1处现象
解析:(1)根据化学方程式可知,用高锰酸钾制取氯气为固液不加热制气,A装置为固液加热装置;B装置为固固加热装置;C装置为固液不加热装置,且能控制盐酸的加入量;D装置也是固液不加热装置,但是一次性加入盐酸,产生氯气的量无法控制且KMnO4易溶,在带孔隔板上放不住,故最佳装置为C。
8
(2)实验装置的连接顺序为:气体发生装置→除杂装置→收集装置→尾气处理装置;除杂装置中长导管进气、短导管出气;因为饱和食盐水中有水,浓硫酸的作用是使氯气干燥,所以先连接盛有饱和食盐水的装置后连接盛浓硫酸的装置。氯气的密度大于空气,用向上排空气法收集,故导管连接顺序为:发生装置c→d→a→b→g→f→e。
(3)反应的化学方程式为4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O。n(HCl)=146g36.5g·mol-1=4mol,n(MnO2)=87g87g·mol-1=1mol,浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,所以含146gHCl的浓盐酸与足量MnO2反应生成的n(Cl2)<1mol;而B组同学的实验由于浓盐酸足量,87gMnO2完全反应,生成的n(Cl2)=1mol,即所得Cl2的物质的量的关系是A