- 219.50 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题十二 物质结构与性质
1.铜具有多种化合物,在工业生产中有重要作用。如醋酸二氨合铜溶液用来吸收合成氨工业中的CO,防止催化剂中毒,该反应是:[Cu(NH3)2]Ac+CO+NH3[Cu(NH3)3CO]Ac(Ac-代表CH3COO-)。回答下列问题:
(1)基态铜原子的电子排布式为________。
(2)C、N、O三种元素的电负性由大到小的顺序为________。
(3)NH3的VSEPR构型为________。
(4)配合物[Cu(NH3)3CO]Ac中铜元素的化合价为________,中心原子的配位数为________,CH3COO-中碳原子的杂化方式为________,该化合物存在的化学键类型为________________。
(5)从电子排布的角度解释Cu+比Cu2+稳定的原因______________。
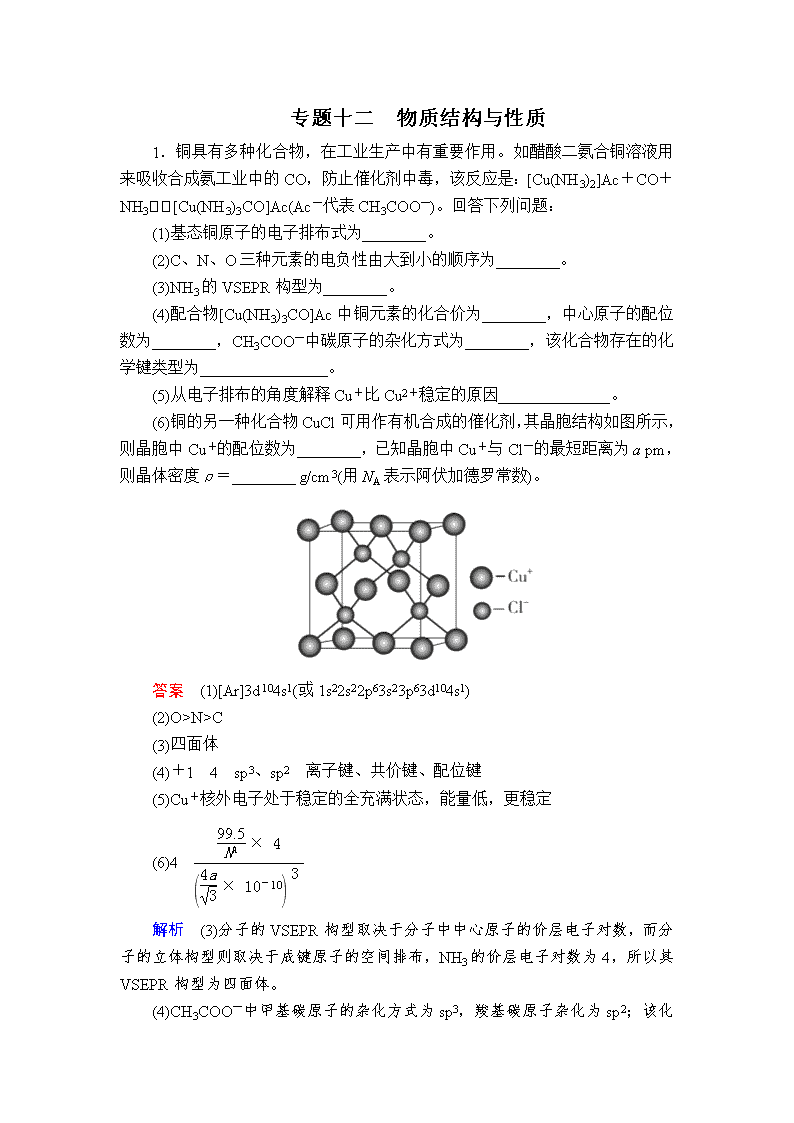
(6)铜的另一种化合物CuCl可用作有机合成的催化剂,其晶胞结构如图所示,则晶胞中Cu+的配位数为________,已知晶胞中Cu+与Cl-的最短距离为a pm,则晶体密度ρ=________ g/cm3(用NA表示阿伏加德罗常数)。
答案 (1)[Ar]3d104s1(或1s22s22p63s23p63d104s1)
(2)O>N>C
(3)四面体
(4)+1 4 sp3、sp2 离子键、共价键、配位键
(5)Cu+核外电子处于稳定的全充满状态,能量低,更稳定
(6)4
解析 (3)分子的VSEPR构型取决于分子中中心原子的价层电子对数,而分子的立体构型则取决于成键原子的空间排布,NH3的价层电子对数为4,所以其VSEPR构型为四面体。
(4)CH3COO-中甲基碳原子的杂化方式为sp3,羧基碳原子杂化为sp2
;该化合物存在的化学键类型为离子键、共价键、配位键。
(6)晶胞中Cl-的配位数为4,CuCl的原子个数比为1∶1,所以晶胞中Cu+的配位数也为4;晶体密度ρ=晶胞质量÷晶胞体积。晶胞中Cu+与Cl-的最短距离为体对角线的,为a pm,所以晶胞的棱长为×10-10 cm,晶胞体积为 cm3。晶胞质量为×4 g。所以晶体密度ρ= g/cm3。
2.磷是生物中不可缺少的元素之一,它能形成多种化合物。
(1)磷元素位于周期表的________区,基态磷原子中电子占据的最高能层符号是________,该能层具有的原子轨道数为________。
(2)第三周期中第一电离能位于铝元素和磷元素之间的有________种。
(3)白磷(P4)分子是正四面体结构,其键角为________,磷原子杂化方式为________,3.1 g白磷中σ键的数目为________,P4易溶于CS2,难溶于H2O,原因是_____________________。
(4)磷酸与Fe3+可形成H3[Fe(PO4)2],基态Fe3+的核外电子排布式为______________,Fe、P、O电负性由大到小的顺序是________。
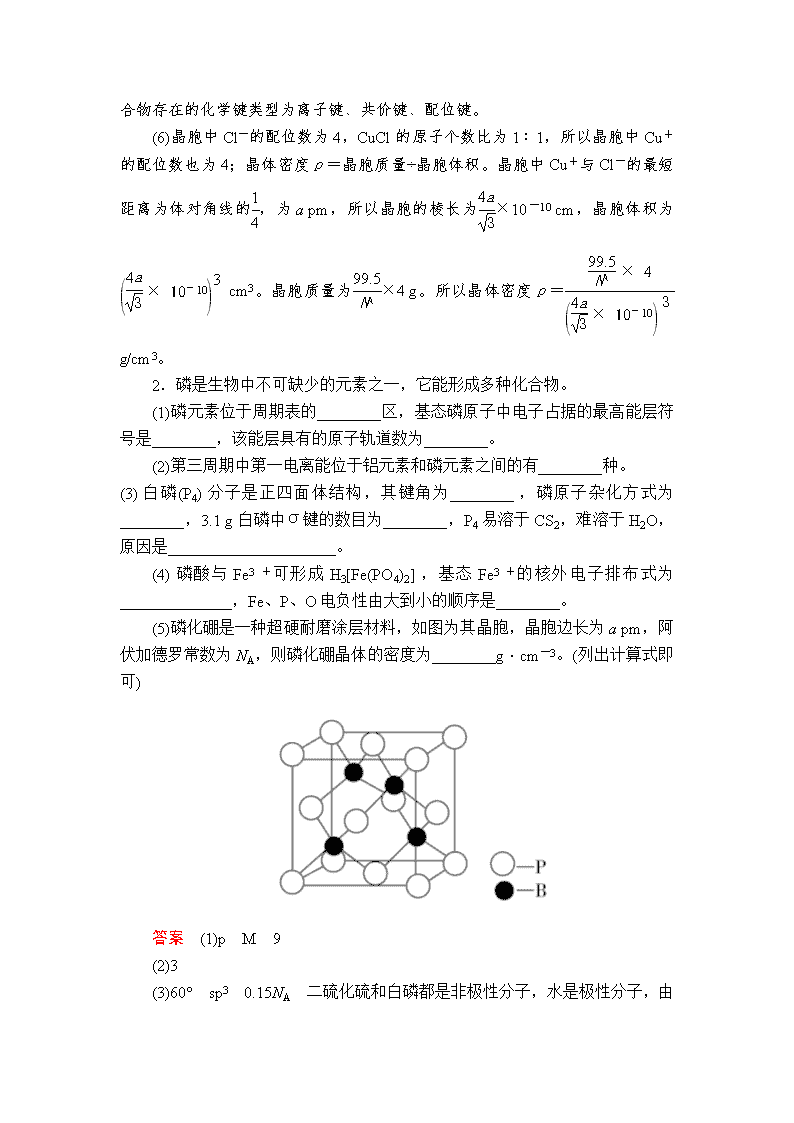
(5)磷化硼是一种超硬耐磨涂层材料,如图为其晶胞,晶胞边长为a pm,阿伏加德罗常数为NA,则磷化硼晶体的密度为________g·cm-3。(列出计算式即可)
答案 (1)p M 9
(2)3
(3)60° sp3 0.15NA 二硫化硫和白磷都是非极性分子,水是极性分子,由相似相溶原理可知,白磷易溶于二硫化硫,难溶于水
(4)1s22s22p63s23p63d5(或[Ar]3d5) O>P>Fe
(5)
解析 (1)磷元素的外围电子排布式为3s23p3,所以磷元素位于周期表的p区,其最高能层为第三层,符号为M,每个能层具有的原子轨道数为能层数的平方,M能层具有9个原子轨道。
(2)第三周期主族元素为Na、Mg、Al、Si、P、S、Cl,由于Mg原子3s轨道上电子全充满,故Mg的第一电离能大于Al,由于P原子3p轨道上电子半充满,故P的第一电离能大于S,所以Mg、Si、S三种元素的第一电离能介于Al和P之间。
(3)P4为正四面体结构,其键角为60°,P原子的杂化方式为sp3杂化,P4中共价键全部是σ键,1 mol P4中含有6 mol σ键,则3.1 g P4中含有的σ键的数目为×6×NA mol-1=0.15NA。
(4)元素的非金属性越强,电负性越大,则电负性:O>P>Fe。
(5)根据磷化硼的晶胞结构可知,1个磷化硼晶胞含有的P原子数为8×+6×=4,B原子数为4,故磷化硼的化学式为BP,1个磷化硼晶胞中含有4个BP,故密度ρ== g·cm-3。
3.甲醇(CH3OH )是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为____________________,其核外电子共占据________个能级。
②甲醇和甲醛中碳原子的杂化方式分别为________,其组成元素的电负性由小到大的顺序为________。
(2)在一定条件下,甲醇(沸点64.7 ℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1 ℃)。
①乙酸甲酯分子σ键和π的个数之比为________。
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为__________________。
(3)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T—碳,T—碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,如图所示。
①T—碳与金刚石互称为________;一个T—碳晶胞中含有________个碳原子。
②T—碳的密度非常小,约为金刚石的一半。试计算T—碳晶胞的边长和金刚石晶胞的边长之比为________。
答案 (1)① 7
②sp3、sp2 H、C、O
(2)①10∶1
②乙酸甲酯不易与水形成氢键,而甲醇易与水形成氢键使甲醇沸点升高,使得乙酸甲酯容易从混合物中蒸出
(3)①同素异形体 32
②2∶1
解析 (1)①Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,价层电子的轨道表达式为,其核外电子共占据7个能级。
②甲醇中碳原子的杂化方式为sp3,而甲醛中碳原子的杂化方式为sp2,元素非金属性越强电负性越大,则其组成元素C、H、O的电负性由小到大的顺序为H、C、O。
(2)①一个乙酸甲酯分子中除了碳氧双键中含一个σ键和一个π键外,另有9个σ键,故σ键和π键的个数之比为10∶1。
(3)①T—碳与金刚石是由碳形成的不同单质,互称为同素异形体;金刚石的晶胞是18个碳原子(顶点8个,面心上下左右前后6个,体内两条体对角线各2个共4个),运用均摊法,一个晶胞中的应是8×+6×+4=8个碳原子;T—碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,故含有碳个数为32个。
②T—碳的密度非常小,约为金刚石的一半,而根据构成原子的数目,
质量为金刚石的4倍,根据V=,T—碳晶胞的体积应该是金刚石的8倍,而边长=,则边长为金刚石的2倍,即T—碳晶胞的边长和金刚石晶胞的边长之比为2∶1。
4.下列反应曾用于检测司机是否酒后驾驶:
2Cr2O+3CH3CH2OH+16H++13H2O―→4[Cr(H2O)6]3++3CH3COOH
(1)Cr3+基态核外电子排布式为________;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是________ (填元素符号)。
(2)CH3COOH中C原子轨道杂化类型为________;1 mol CH3COOH分子含有σ键的数目为________。
(3)与H2O互为等电子体的一种阳离子为______________________(填化学式);H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为______________________。
答案 (1)1s22s22p63s23p63d3(或[Ar]3d3) O
(2)sp3和sp2 7NA(或7×6.02×1023)
(3)H2F+ H2O与CH3CH2OH之间可以形成氢键
解析 (1)Cr为24号元素,基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,形成离子时,失去3个电子,所以Cr3+的核外电子排布式为1s22s22p63s23p63d3或[Ar]3d3。H2O中的O含有孤对电子,所以O为配位原子。
(2)甲基中的C原子为sp3杂化,羧基中的C原子为sp2杂化。单键全部为σ键,1个双键中有1个π键、1个σ键,所以1 mol CH3COOH中含有7 mol σ键。
(3)H2O和H2F+互为等电子体。H2O分子与
CH3CH2OH分子之间可以形成氢键,且两者都是极性分子,故两者是互溶的。