- 123.50 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
泰安四中2019届高二上学期第一次月考试题
化学试题
2018.10
一、选择题(本题包括16小题,每题3分,共48分)
1.在生产和生活中,人们广泛利用着化学反应释放的能量。下列说法正确的是( )
A.物质发生化学变化并不一定都伴随着能量变化
B.用实验方法和理论方法研究反应热的化学称为热化学
C.有能量变化的都是化学变化
D.任何反应中的能量变化都表现为热量变化
2.废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是( )
A.石墨 B.二氧化锰
C.锌 D.汞
3.我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是( )
A.此腐蚀过程有化学腐蚀也有电化学腐蚀
B.发生电化学腐蚀时的正极反应为
2H2O+O2+4e-===4OH-
C.在化学腐蚀过程中有氢气产生
4.已知2Zn(s)+O2(g)===2ZnO(s)
ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)2HgO(s)
ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为( )
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
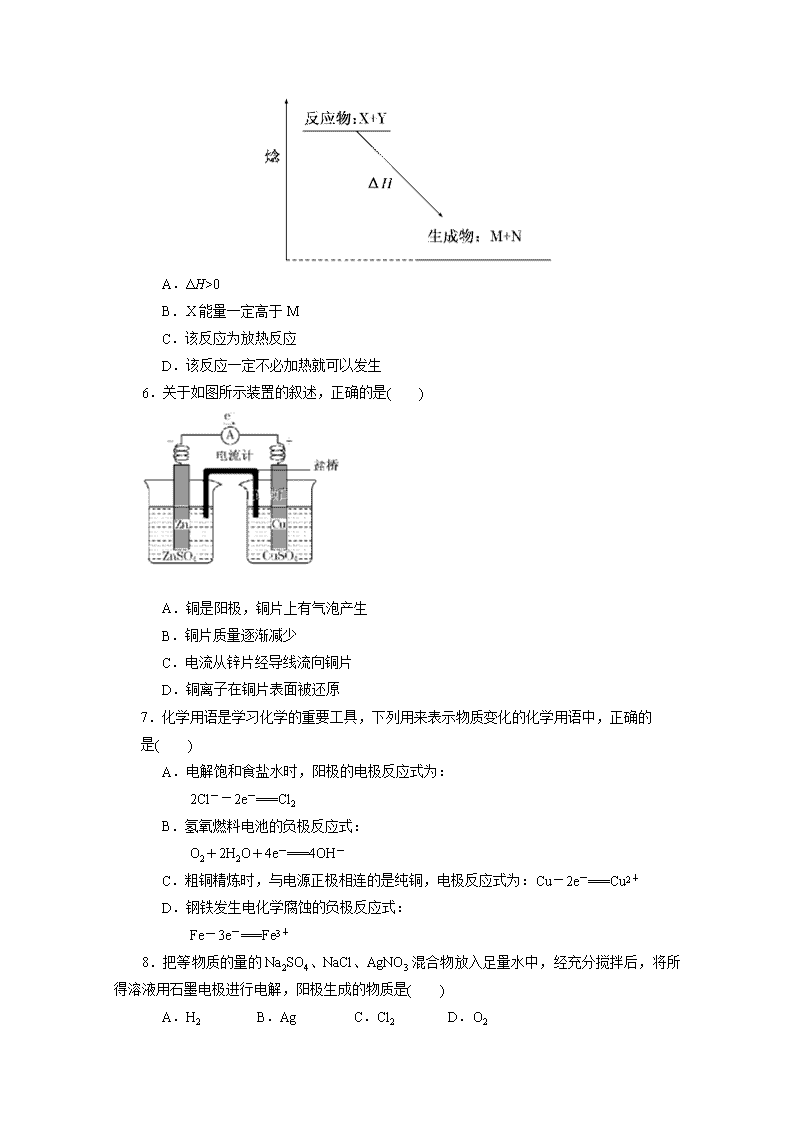
5.如图为某反应的焓变示意图,下列有关该反应的说法中正确的是( )
A.ΔH>0
B.X能量一定高于M
C.该反应为放热反应
D.该反应一定不必加热就可以发生
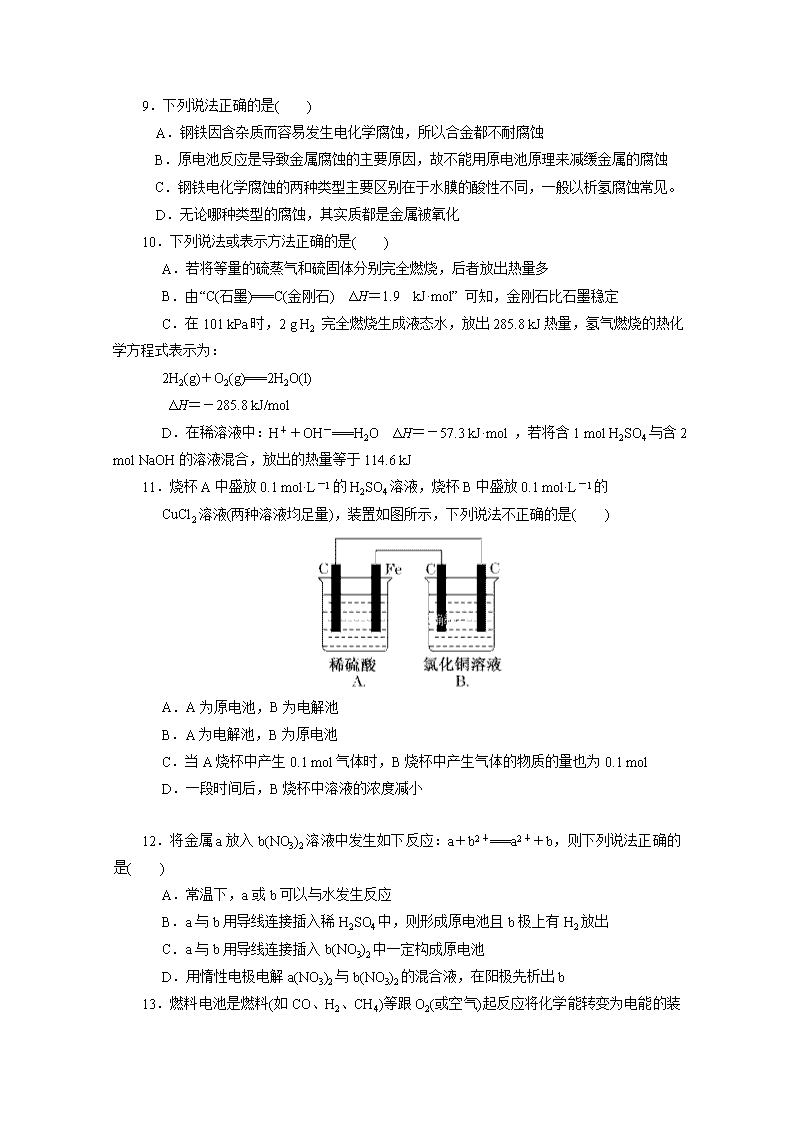
6.关于如图所示装置的叙述,正确的是( )
A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.铜离子在铜片表面被还原
7.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的
是( )
A.电解饱和食盐水时,阳极的电极反应式为:
2Cl--2e-===Cl2
B.氢氧燃料电池的负极反应式:
O2+2H2O+4e-===4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-===Cu2+
D.钢铁发生电化学腐蚀的负极反应式:
Fe-3e-===Fe3+
8.把等物质的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,经充分搅拌后,将所得溶液用石墨电极进行电解,阳极生成的物质是( )
A.H2 B.Ag C.Cl2 D.O2
9.下列说法正确的是( )
A.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
B.原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀
C.钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,一般以析氢腐蚀常见。
D.无论哪种类型的腐蚀,其实质都是金属被氧化
10.下列说法或表示方法正确的是( )
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)===C(金刚石) ΔH=1.9 kJ·mol” 可知,金刚石比石墨稳定
C.在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:
2H2(g)+O2(g)===2H2O(l)
ΔH=-285.8 kJ/mol
D.在稀溶液中:H++OH-===H2O ΔH=-57.3 kJ·mol ,若将含1 mol H2SO4与含2 mol NaOH的溶液混合,放出的热量等于114.6 kJ
11.烧杯A中盛放0.1 mol·L-1的H2SO4溶液,烧杯B中盛放0.1 mol·L-1的
CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
A.A为原电池,B为电解池
B.A为电解池,B为原电池
C.当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol
D.一段时间后,B烧杯中溶液的浓度减小
12.将金属a放入b(NO3)2溶液中发生如下反应:a+b2+===a2++b,则下列说法正确的是( )
A.常温下,a或b可以与水发生反应
B.a与b用导线连接插入稀H2SO4中,则形成原电池且b极上有H2放出
C.a与b用导线连接插入b(NO3)2中一定构成原电池
D.用惰性电极电解a(NO3)2与b(NO3)2的混合液,在阳极先析出b
13.燃料电池是燃料(如CO、H2、CH4)等跟O2
(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如KOH)溶液,下列关于甲烷燃料电池的说法中不正确的是( )
A.通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应
B.负极的电极反应式为CH4+10OH--8e-===CO+7H2O
C.随着反应的进行,电解质溶液的pH保持不变
D.甲烷燃料电池的能量利用率比甲烷燃烧的大
14.某蓄电池放电、充电时的反应为
Fe+Ni2O3+3H2OFe(OH)2+2Ni(OH)2
下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是:Fe(OH)2
+2e-===Fe+2OH- ③充电时,Ni(OH)2为阳极 ④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.①②④
C.①③④ D.②③④
15.通常人们把拆开1 mol某化学键所吸收的能量或形成1 mol某化学
键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热
(ΔH),已知
化学健
H-H
Cl-Cl
H-Cl
键能
436 kJ·mol-1
243 kJ·mol-1
431 kJ·mol-1
则下列热化学方程式不正确的是( )
A.H2(g)+Cl2(g)===HCl(g)
ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)===2HCl(g)
ΔH=-183 kJ·mol-1
C.H2(g)+Cl2(g)===HCl(g)
ΔH=91.5 kJ·mol-1
D.2HCl(g)===H2(g)+Cl2(g)
ΔH=183 kJ·mol-1
16.用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,
假设电解时温度不变,且用惰性电极,下列说法不正确的是( )
A.当电池负极消耗m g气体时,电解池阴极同时有m g气体生成
B.电池的正极反应式为:O2+2H2O+4e-===4OH-
C.电解后c(Na2CO3)不变,且溶液中有晶体析出
D.电池中c(KOH)不变;电解池中溶液pH变大
二、非选择题(本题包括6小题,共52分)
17.(6分)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)ΔH=-1 160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
18.(6分)将1 L含有0.4 mol CuSO4和0.2 mol NaCl 的水溶液用惰性电极电解一段时间后。
(1)若在一个电极上得到0.1 mol Cu,另一电极上析出气体(在标准状况下)的体积
是________ L。
(2)若在一个电极上恰好得到0.4 mol Cu,另一电极上再析出气体(在标准状况下)
的体积是________ L。
19.(8分)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀________________。
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
①A电极对应的金属是________(写元素名称),B电极的电极反应式是_ _______________________。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
____________________________________________________________________
____________________________________________________________。
20.(9分)某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ
:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为
__________________________________________________________________。
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反
应式。
正极反应式:________________________________________________________。
负极反应式:________________________________________________________。
21.(11分)请按要求回答下列问题。
(1)根据图1回答①②:
①若断开K2,闭合K1。
A电极可观察到的现象________________________________________________;
B极的电极反应式为__________________________________________________。
②若断开K1,闭合K2,A电极可观察到的现象是________________;B极的电极反应式为____________。
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为________________,电解反应的离子方程式为________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
22.(12分)(1)合成氨反应的热化学方程式:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.2 kJ·mol-1
已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下,N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,至少在反应混合物中
要投放N2的物质的量为________ mol。
(2)肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式:__________________________,
负极的电极反应式:__________________________。
(3)如图是一个电解过程示意图。
①锌片上发生的电极反应式是:________________________________________
_______________________________________________________________。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的氧气________L。