- 382.50 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019届化学工艺流程题解题秘笈
【高考考向】
1.分析流程图的能力、提取有效信息及知识的迁移能力
2.应用化学反应原理、平衡移动原理等解决物质的转化、反应条件的控制等问题3.物质的制备和分离的实验操作技能考查
4.从绿色化学观点和综合经济效益的视角全面分析和解决实际问题
【前置作业】
1.阅读“解题指导”:
①粗读试题,尽量弄懂流程图。对照原料和产品,明确核心反应和除杂任务。
②明确流程图中箭头方向和代表的含义。流程图中箭头进入的是反应物(投料),箭头出去的是生成物(产物、副产物),返回的箭头一般是“循环利用”的物质。
③图中一般会出现陌生知识,要读懂流程图以外的文字描述、表格信息、后续设问中的提示性信息,并在下一步分析和解题中随时进行联系和调用。
④带着问题去精心研究某一步或某一个物质。
⑤注意化学语言的规范性。
2.完成下列化学工艺流程图
题头:介绍该工艺生产的原材料、目的、原理
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可由电镀废渣(除镍外,还含有Cu、Zn、Fe等杂质)为原料获得。工艺流程如下:
题干:用框图形式将操作或物质转化或分离提纯等主要生产工艺流程表示出来
题尾:根据流程中涉及的化学知识设问
(1)往废渣中加H2SO4酸浸,要充分搅拌,其目的是
。
(2)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式 。
(3)加6%的H2O2时,温度不能过高,其目的是 。
(4)除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,用NaClO3氧化Fe2+的离子方程式为 。
(5)上述流程中滤液III的溶质的主要成分是: 。(填化学式)
(6)操作I包括以下过程:过滤,用H2SO4溶解, 、 、过滤、洗涤获得产品。
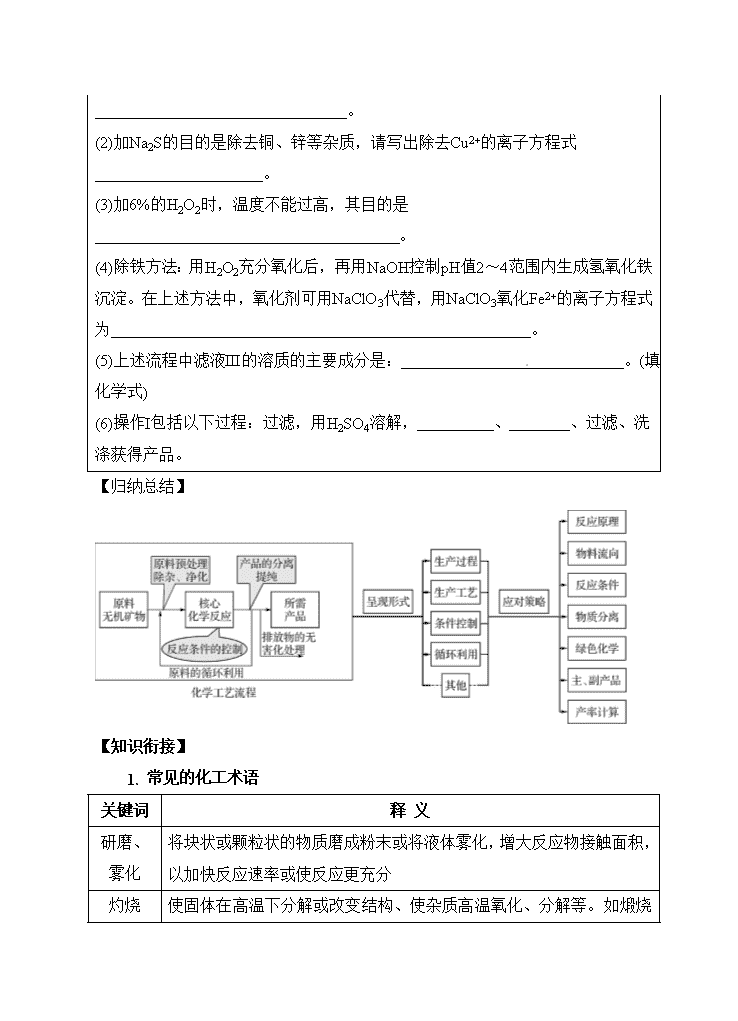
【归纳总结】
【知识衔接】
1. 常见的化工术语
关键词
释 义
研磨、
雾化
将块状或颗粒状的物质磨成粉末或将液体雾化,增大反应物接触面积,以加快反应速率或使反应更充分
灼烧
(煅烧)
使固体在高温下分解或改变结构、使杂质高温氧化、分解等。如煅烧石灰石、高岭土、硫铁矿
浸取
向固体中加入适当溶剂或溶液,使其中可溶性的物质溶解,包括水浸取、酸溶、碱溶、醇溶等
浸出率
固体溶解后,离子在溶液中的含量的多少
酸浸
在酸性溶液中使可溶性金属离子进入溶液,不溶物通过过滤除去的过程
水浸
与水接触反应或溶解
过滤
固体与液体的分离
滴定
定量测定,可用于某种未知浓度物质的物质的量浓度的测定
蒸发结晶
蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出
蒸发浓缩
蒸发除去一部分溶剂,提高溶液的浓度
水洗
用水洗去可溶性杂质,类似的还有酸洗、醇洗等
酸作用
溶解、去氧化物(膜)、抑制某些金属离子的水解、除去杂质离子等
碱作用
去油污,去铝片氧化膜,溶解铝、二氧化硅,调节pH、促进水解(沉淀)
2. 常见的操作与答题
常见的操作
答题要考虑的角度
加过量试剂
使反应完全进行(或增大转化率、产率)等
加氧化剂
氧化某物质,生成目标产物或除去某些离子
判断能否
加其他物质
要考虑是否引入杂质(或影响产物的纯度)等
分离、提纯
过滤、蒸发、萃取、分液、蒸馏等常规操作;
从溶液中得到含结晶水的盐,一般采用“蒸发浓缩、冷却结晶、过滤、洗涤、干燥”的方法。
提高原子利用率
绿色化学(物质的循环利用、废物处理、原子利用率、能量的充分利用)
在空气中或在其他气体中进行的反应或操作
要考虑O2、H2O、CO2或其他气体是否参与反应或能否达到隔绝空气,防氧化、水解、潮解等目的
判断沉淀是否洗涤干净
取少量最后一次洗涤滤液,检验其中是否还有某种离子存在等
检验是否完全沉淀
静置,向上层清液中(或取上层清液)继续滴加沉淀剂,若无沉淀生成,则沉淀完全。
控制溶液的pH
①调节溶液的酸碱性,抑制水解(或使其中某些金属离子形成氢氧化物沉淀)
②“酸作用”还可除去氧化物(膜)
③“碱作用”还可除去油污,除去铝片氧化膜,溶解铝、二氧化硅等
④特定的氧化还原反应需要的酸性条件(或碱性条件)
控制温度
①防止副反应的发生;防止某反应物及目标产物分解
②使化学平衡移动;控制化学反应的方向
③控制固体的溶解与结晶(如趁热过滤能防止某物质降温时析出)
④控制反应速率;使催化剂达到最大活性
⑤升温:促进溶液中的气体逸出,使某物质达到沸点挥发
⑥加热煮沸:促进水解,聚沉后利于过滤分离
⑦趁热过滤:减少因降温而析出的溶质的量
⑧降温:防止物质高温分解或挥发;降温(或减压)可以减少能源成本,降低对设备的要求
洗涤晶体
①水洗:通常是为了除去晶体表面水溶性的杂质
②“冰水洗涤”:能洗去晶体表面的杂质离子,且防止晶体在洗涤过程中的溶解损耗
③用乙醇洗涤晶体:洗去晶体表面的杂质,降低晶体的溶解度、减少溶解损耗,易于干燥。
④洗涤沉淀方法:往漏斗中加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2~3次
表面处理
用水洗除去表面可溶性杂质,金属晶体可用机械法(打磨)或化学法除去表面氧化物、提高光洁度等
【近年高考工艺流程题中高频问题荟萃】
1、“浸出”步骤中,为提高金属元素(如Fe)的浸出率,可采取的措施有:
答:适当提高反应温度、增加浸出时间,加入过量硫酸,边加硫酸边搅拌等
2、(2016一模)如何提高吸收液和SO2反应速率:
答:适当提高温度、增大吸收液的浓度、或搅拌(增大SO2与吸收液的接触面积)
3、从溶液中得到晶体步骤:
答:蒸发浓缩-冷却结晶-过滤-洗涤-干燥 或 蒸发结晶-趁热过滤-洗涤-干燥(有时需结合信息加一些条件作修饰,如用砂芯漏斗过滤;用冰水洗涤;置于真空干燥箱中干燥等等)
4、过滤用到的三个玻璃仪器:
答:烧杯、漏斗、玻璃棒
5、过滤后滤液仍然浑浊的可能的操作原因:
答:玻璃棒下端靠在滤纸的单层处,导致滤纸破损;漏斗中液面高于滤纸边缘
过滤后滤液仍然浑浊的后续操作:
答:更换滤纸,重新过滤
6、如何洗涤沉淀?
答:向漏斗中加入蒸馏水浸没沉淀,待水自然流下,重复操作2-3次
7、如何检验沉淀是否洗涤干净:
答:(以含表面杂质离子为SO42-为例)取最后一次洗涤滤液少许于试管,先加稀盐酸,再加入BaCl2溶液,若无白色沉淀则说明洗涤干净。
(如含表面杂质离子为Cl-)取最后一次洗涤滤液少许于试管,加入硝酸酸化的AgNO3溶液,若无白色沉淀则说明洗涤干净
8、如何检验溶液中SO42—已除尽的方法:
答:静置分液,在上层清液中继续加入BaCl2溶液,若没有白色沉淀,则表明SO42-已除尽。
9、如何从MgCl2·6H2O中得到无水MgCl2:
答:在干燥的HCl气流中加热。(原理:干燥的HCl气流中抑制了MgCl2的水解,且带走MgCl2·6H2O受热产生的水汽)
10、CuCl2中混有Fe3+加何种试剂调pH值:
答:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等都可以。原因:所加物质消耗了溶液中的H+,促进了Fe3+的水解,生成Fe(OH)3沉淀析出,且不带来其他杂质。
11、调pH值使得Cu2+(4.7-6.2)中的Fe3+(2.1~3.2)沉淀,pH值范围是多少:
答:3.2~4.7。原因:调节溶液的pH值至3.2~4.7,使Fe3+全部以Fe(OH)3沉淀的形式析出而Cu2+不沉淀,且不会引入新杂质
12、产品进一步提纯的操作: 答:重结晶
13、趁热过滤的原因:
答:保持过滤温度,防止温度降低时滤液中某某溶质析出;
14、水浴加热的好处:
答:受热均匀,便于控温,且温度不超过100℃
15、制得的晶体(如CoCl2.6H2O)需减压烘干的原因:
答:常压蒸发温度过高,CoCl2.6H2O易分解; 或者回答:减压烘干降低了烘干温度,可以防止CoCl2.6H2O分解
16、Mg(OH)2沉淀中混有Ca(OH)2应怎样除去:
答:加入MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水水洗涤
17、蒸发浓缩用到的主要仪器有 、 、烧杯、酒精灯等
答:蒸发皿、玻璃棒、坩埚钳(取蒸发皿时要用坩埚钳) 注:灼烧需要坩埚、泥三角、坩埚钳
18、不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是:
答:加热法;取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净
19、检验NH4+的方法是:
答:取溶液少许,加入NaOH溶液后加热,若产生的气体能使润湿的红色石蕊试纸变蓝。则证明含NH4+
20、过滤得到的沉淀欲称重之前的操作:
答:过滤,洗涤,干燥,(在干燥器中)冷却,称重
21、加热蒸发结晶时能不能蒸干?到什么时候停止加热?答:不能蒸干,待出现较多晶体时停止加热,利用余温蒸干。
22、溶液中过量H2O2除去的简便方法是:
答:加热至沸
23、检验Fe(OH)3是否沉淀完全的试验操作是:
答:取少量上层清液或过滤后的滤液,滴加几滴KSCN溶液,若不出现血红色,则表明Fe(OH)3 沉淀完全。
24、检验滤液中是否含有Fe3+的操作是:
答:滴入少量KSCN溶液,若出现血红色,则证明有Fe3+)
25、熔炼制备镁铝合金时通入氩气的目的是:
答:作保护气,防止Mg、 Al被空气氧化
26、以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程中,酸溶及后续过程中均需保持盐酸过量,其目的分别是:
答:酸溶盐酸过量目的:提高铁元素的浸出率 ;后续过程盐酸过量目的:抑制Fe3+水解
27、准确量取40.00ml H2SO4 溶液或高锰酸钾溶液的玻璃仪器是:
答:酸式滴定管
①调节pH所需的物质一般应满足两点:能与H+反应,使溶液pH值增大; 不引入新杂质。
例如:若要除去Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH值
②加热的目的 加快反应速率或促进平衡向某个方向移动或促使溶液中某气体逸出
③降温反应的目的 防止某物质在高温时会分解或挥发;或为使化学平衡向着题目要求的方向移动
④趁热过滤 防止某物质降温时会析出
⑤冰水洗涤
洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗