- 455.50 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
蚌埠市教师“我为高考命题”化学学科试卷
可能用到的相对原子质量:H-1 C-12 O-16 Fe-56 Al-27 Hg-201 Ni-59 一、选择题:本题共 7 小题,每小题 6 分,共 42 分。在每小题给出的四个选项 中,只有一项是符合题目要求的。
7、化学与生活密切相关。下列说法正确的是( ) A.食盐抗结剂 K4[Fe(CN)6]可用 KCN 和 FeCl2 代替 B.水可用于扑灭一般的起火,也适用于金属和电器起火 C.添加碱性蛋白酶等水解酶的洗衣粉,水温越高,酶的活性越高 D.用超临界液态 CO2 代替有机溶剂萃取大豆油,有利于环保
8、NA为阿伏加德罗常数的值。下列说法正确的是( ) A.2.8 g乙烯与2.6 g苯中含碳碳双键数均为0.1NA B.16.2 g淀粉完全水解生成葡萄糖分子数为0.1 NA
C.0.1 mol Cl2溶于水,溶液中Cl-、ClO-数之和为0.2 NA
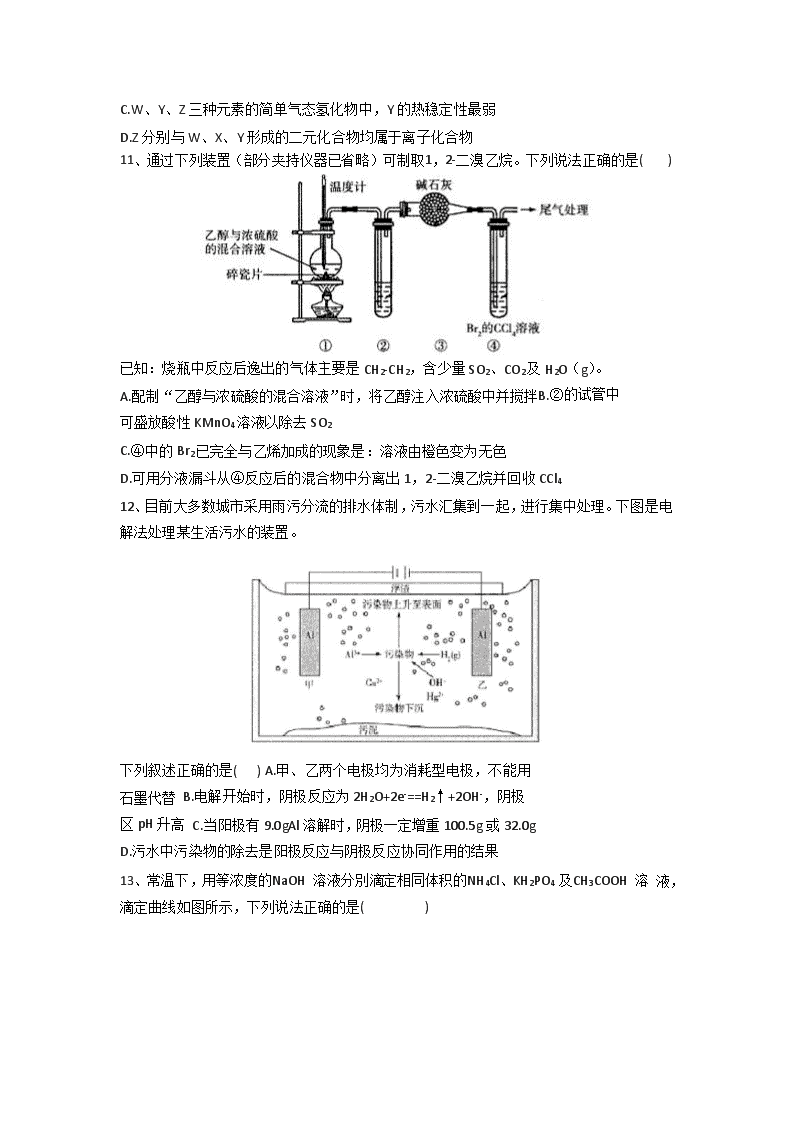
D.恒容密闭容器中,22.4 L(已折合成标准状况)CO2与足量C在高温下充分反应,生成CO
分子数为2 NA
9、合成某药物中间体的片段如下:
下列说法错误的是( ) A.E→F和F→G反应都是取代反应 B.E、F和G都能与Na,NaOH反应 C.E、F和G分子中碳原子都不可能共平面
D.与E的分子式相同且苯环上含2个-OH、1个-CH2COOH的结构有6种
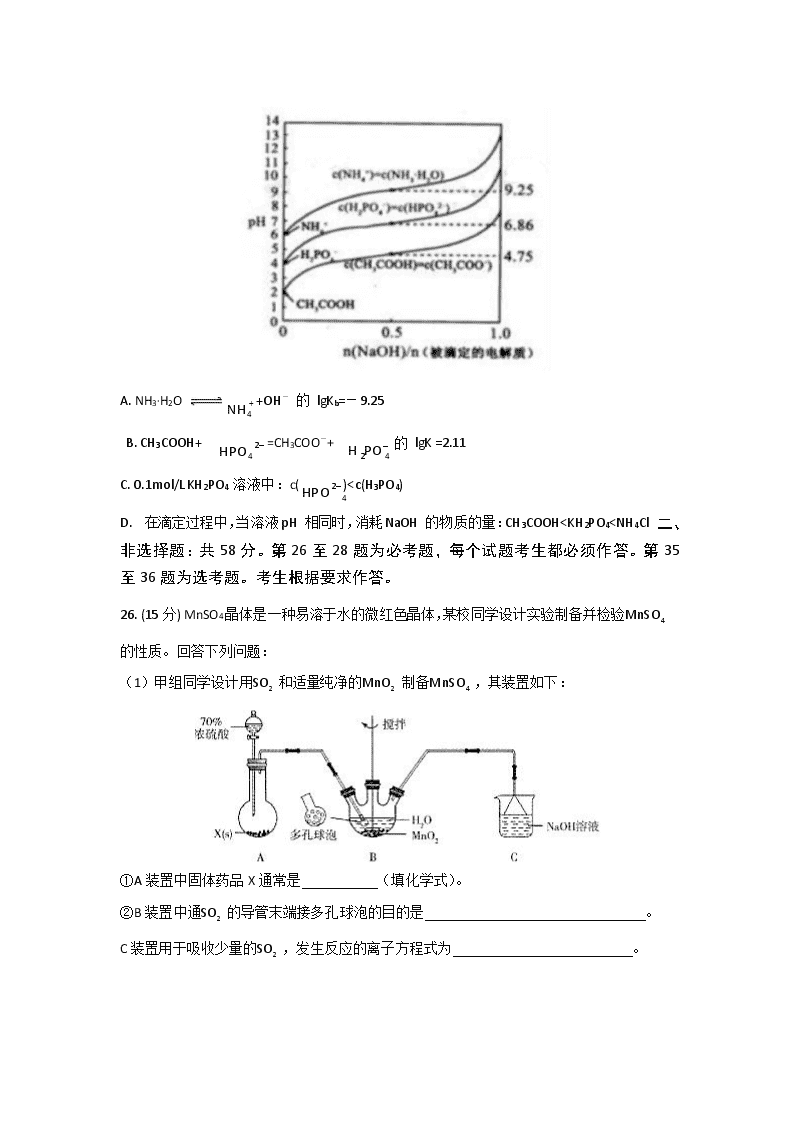
10、短周期主族元素W、X、Y、Z的原子序数依次增大。Y的最高价氧化物与X的最高价氧 化物对应的水化物反应的产物可用于制备木材防火剂,W、Z的最外层电子数之和是Y的最 外层电子数的3倍且Z的最外层电子数与W的核外电子总数相等。下列说法错误的是( ) A.原子半径:w”“<’或“=”)。
②图中 lgK p
[列出用分压 p (CO2 )、p (PH3 )、p (H2 O ) 表示的计算式]。
3
(4)反应 ( CH3 )
AuPH3 ¾¾® ( CH3 ) AuPH3 + C2 H 6 的历程如下:
)
3
第一步: ( CH3
AuPH3
¾¾k1 ® CH
(
k 3
)
-1 3
Au + PH3
(快反应)
第二步: ( CH3
Au ¾k¾2 ® C H
2
)
3
6 + CH3 Au
(慢反应)
第三步: CH Au + PH
¾k¾3 ®(CH ) AuPH
,(快反应)
3 3 3 3
①反应的中间产物有 PH3 、 。
②第 步(填“一”“二”或“三”)反应的活化能最大。
3
3
(5)用 Cu 2+、Pb2+ 液相脱除 PH 的反应为: PH
+ 2O2
Pb2+、Cu2+
===== H3 PO4
其他条件相同时,溶解在溶
液中 O2 的体积分数、 PH3 的净化效率与时间的关系如下图所示:
O2 的体积分数大,PH3 的净化效率高的原因是 (用碰撞理论等说明)。
(5)在 H 的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振 氢谱上有 4 组峰,且峰面积之比为 1∶1∶2∶6 的有机物的结构简式为 。
35 .(15 分) 最近一期《物理评论快报》报道了科学家成功制备了包含钙、钾、铁和砷以及少
量镍的 CaK(Fe1-xNix)4As4 新型化合物材料。 回答下列问题: (1)基态镍原子的电子排布式为[Ar] ;上述材料中所含元素的基态原子中,未成 对电子数最多的是 (填元素符号)。
4
(2)AsCl3 分子中砷的杂化类型是 ; AsO3- 的空间构型是 。
(3)电子亲和能是反映元素性质的参数之一,电子亲和能指基态气态原子得 1 个电子形成负一 价阴离子时释放的能量(kJ•mol-1),第四周期主族元素 Ga、Ge、As、Se、Br 的电子亲和能大 小变化如图所示。砷的电子亲和能“突变”的主要原因是 。
(4)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)6]4-、Fe(CO)5 等。配位原子提供孤电子 对的能力与元素的电负性大小有关,电负性越大,其原子不容易提供孤电子对,则 Fe(CO)5 中提
供孤电子对的原子是 (填元素符号);与 CO 互为等电子体的分子是
。
(5)已知:CaO、K2S 的熔点分别为 2 572 ℃,840 ℃,二者熔点差异的主要原因是 。
(6)氧化镍晶胞如图 1 所示,单原子层氧化镍的结构如图 2 所示。
①图 1 中,原子坐标参数:A(0,0,0)、B(1/2,0,1/2),则 C 原子的坐标参数为 。
②图 2 中,已知氧离子半径为 a pm(忽略镍离子半径),NA 是阿伏加德罗常数的值。每平方米含 氧化镍的质量为 g,(提示:将图 2 中氧离子切割成正六边形作最小基元)
36. (15分) 以芳香烃A和化合物F为原料合成除草剂双苯噁唑酸(I)的一种工艺流程如下:
已知以下信息:
①B、C、D、E中均含有两个苯环。
②E能使Br,的CC1,溶液褪色,其核磁共振氢谱有4组峰,峰面积比为2:2:1:1;F中含 有两种官能团且具有两性;G能发生水解反应。
回答下列问题:
(1)F的化学名称为 。
(2)A生成B、D生成E的反应类型依次为 、 。
(3)E、G的结构简式依次为 、 。
(4)B生成C的化学方程式为 。
(5)芳香化合物X是D的同分异构体,X的苯环上有3个取代基,能与 FeCl3 溶液发生显色反 应,能使 Br2 的 CCl4 溶液褪色,X的核磁共振氢谱有5组峰且峰面积比为6:4:2:1:1,写 出两种符合要求的X的结构简式: 。
(6)根据题给信息,写出以乙醛为原料制备2-丁醇的合成路线: (其他
试剂任用)。
蚌埠市教师“我为高考命题”化学学科试卷参考答案
一、选择题(每小题 6 分,共 42 分)
题号
7
8
9
10
11
12
13
答案
D
B
C
D
C
D
D
二、非选择题(共 58 分)
26.(除标注外,每空 2 分,共 15 分)
(1)① Na 2SO3
②增大 SO2 与液体的接触面积(1 分);
SO2
+ 2OH- ==SO2-
+ H2 O
(2)
AgNO3
2+ 2- -
3
2- +
2Mn
+ 5S2 O8
+ 8H2 O === 2MnO4 + 10SO4
+ 16H
高温
(3)① b; c ② 3MnSO 4 === Mn 3 O 4 + SO 2 +2SO3
(4)铝粉、镁条
27.(除标注外,每空 2 分,共 14 分)
(1)提高硫酸钡和焦炭反应的反应速率和原料利用率(1 分); BaSO4+4CBaS +4CO
(2)BaS+2H+=Ba2+ +H2S↑; CuS(1分)
(3)中和酸,促进A13+、Fe3+完全沉淀
(4)1 ×10-38
(5); 2H2O +2e-=2OH-+H2↑或 2H++2e-=H2↑
28.(除标注外,每空 2 分,共 14 分)
(1) H3PO 4
(2)-30; 2 (3) ①<(1 分)
p4.5 (H O )
② 4.5lgp (H2 O) -6.25lgp (CO2 ) -3lgp (PH3 ) 或 lg
2
p6.25 (CO )
2
3
× p3 (PH )
3
(4)① (CH3 )
Au 和 CH3 Au ; ② 二(1分)
(5)O2 的体积分数越大,有效碰撞的几率增加,氧化更多的 PH3 ,净化效率高(其他合理
答案也可)
35.(除标注外,每空 2 分,共 15 分)
(1)3d84s2(1 分); Fe (1 分) (2)sp3; 正四面体
(3)基态砷原子价层电子排布式为4s24p3,4p能级上电子达到半充满结构
(4)C(1 分); N2(1 分)
(5)CaO、K2S 都是离子晶体,Ca2+ 所带电荷数大于 K+且Ca2+的半径小于K+,O2-的半径 小于S2-,故CaO的晶格能大于K2S
24
(6)①(1/2,1/2,1/2)(1分); ② 75 3 ´10
6a2 N
A
36.(除标注外,每空 2 分,共 15 分)
(1)甘氨酸(或α-氨基乙酸或氨基乙酸)(1 分)
(2)取代反应(1分); 消去反应(1分)
(3) ;
(4)
H2 NCH2 COOC2 H5
(5)
(6)
(4分)