- 558.00 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第2课时 化学键与化学反应中的能量变化
课后篇巩固提升
A组
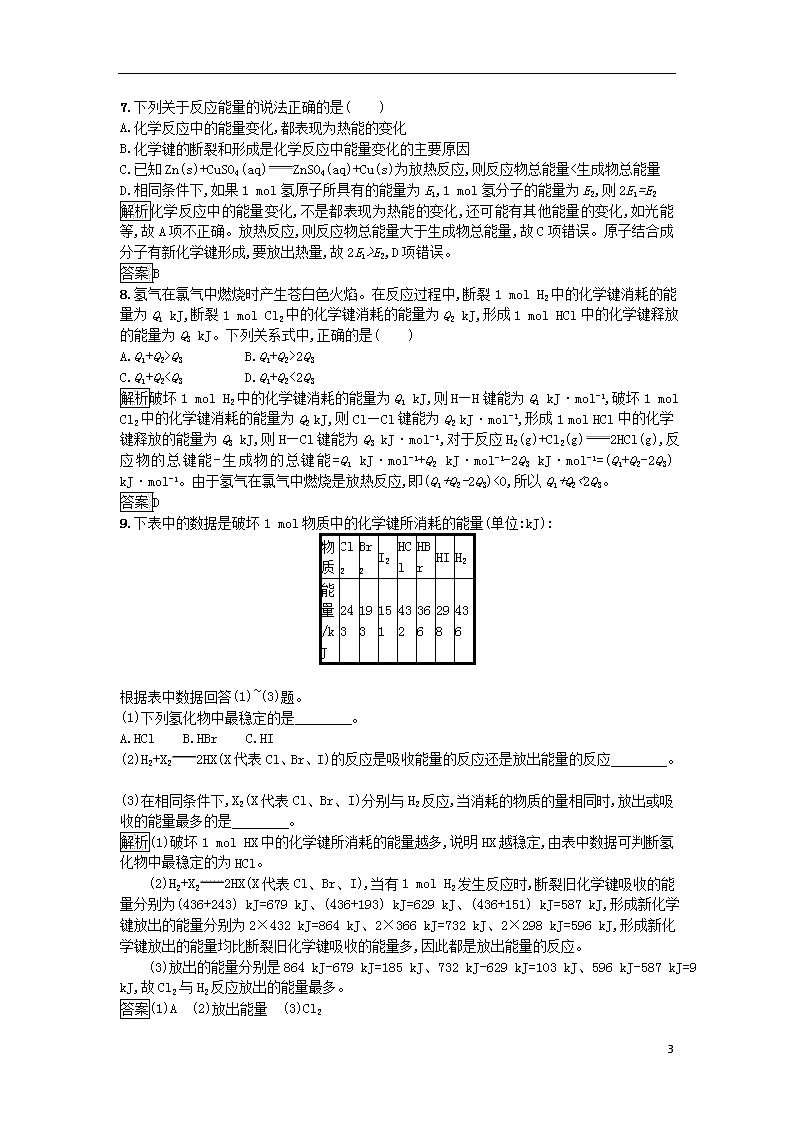
1.下列说法正确的是( )
A.需要加热才能发生的反应一定是吸收能量的反应
B.任何释放能量的反应在常温条件下一定能发生反应
C.旧化学键断裂吸收的能量与新化学键形成所释放的能量的相对多少决定了反应是释放能量还是吸收能量
D.反应物总能量大于生成物总能量,则反应吸收能量
解析从化学反应的实质和反应物、生成物所具有的能量两方面理解吸收能量或放出能量。化学反应的实质是旧化学键断裂和新化学键形成,旧化学键断裂需要吸收能量,新化学键形成需要放出能量;从反应物、生成物所具有的总能量的相对大小来判断化学反应中的能量变化情况,若反应物的总能量大于生成物的总能量,反应释放能量,反之,吸收能量;释放能量的反应和吸收能量的反应在一定条件下都能发生,反应开始时需加热的反应可能是吸收能量的反应,也可能是释放能量的反应。
答案C
2.下列反应过程中的能量变化与右图一致的是( )
A.2Al+Fe2O32Fe+Al2O3
B.C+CO22CO
C.CaCO3CaO+CO2↑
D.C+H2OCO+H2
解析铝热反应是放热反应,故A正确;C与CO2反应生成CO的反应是吸热反应,故B错误;碳酸钙高温分解是吸热反应,故C错误;碳单质与水蒸气高温下生成水煤气的反应是吸热反应,故D错误。
答案A
3.对于放热反应2H2+O22H2O,下列说法正确的是( )
A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量
B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量
C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量
D.反应物H2和O2具有的能量相等
解析由于该反应为放热反应,因此反应物所具有的总能量高于生成物所具有的总能量,故B项正确。
7
答案B
4.有关下列能量转化的认识不正确的是( )
A.植物的光合作用使得太阳能转化为了化学能
B.燃料燃烧时只是将化学能转化为了热能
C.生物体内的化学变化过程在能量转化上比在体外发生的一些能量转化更为合理、有效
D.人类使用照明设备是将电能转化为了光能
解析植物的光合作用是绿色植物和藻类利用叶绿素等光合色素和某些细菌利用其细胞本身,在可见光的照射下,将二氧化碳和水(细菌为硫化氢和水)转化为有机物,并释放出氧气(细菌释放氢气)的生化过程,使得太阳能转化为了化学能,故A正确;燃烧是剧烈的发光放热的氧化还原反应,过程中化学能转化成了光能、热能等,故B错误;人体内的能量变化是一个能量均衡的转化过程,生物体内的化学变化过程在能量转化上比体外发生的一些能量转化更为合理、有效,故C正确;照明需要光能,人类使用照明设备是将电能转化为光能,故D正确。
答案B
5.化学反应A2+B22AB的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.1 mol A—A键和
1 mol B—B键断裂能放出x kJ的能量
C.2 mol A—B键断裂需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
解析由图知, 1 mol A2和1 mol B2的总能量高于2 mol AB的能量,所以该反应放热;化学键断裂时需吸收能量,B项错误,C项正确。
答案C
6.下列图示的变化是吸热反应的是( )
解析A项中生成物的总能量高于反应物的总能量,只能通过吸收能量才能实现;B项则恰好相反;C项中浓硫酸溶于水要放出热量,但此过程是物理变化,没有发生化学反应;D项是典型的放热反应。
答案A
7
7.下列关于反应能量的说法正确的是( )
A.化学反应中的能量变化,都表现为热能的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.已知Zn(s)+CuSO4(aq)ZnSO4(aq)+Cu(s)为放热反应,则反应物总能量<生成物总能量
D.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子的能量为E2,则2E1=E2
解析化学反应中的能量变化,不是都表现为热能的变化,还可能有其他能量的变化,如光能等,故A项不正确。放热反应,则反应物总能量大于生成物总能量,故C项错误。原子结合成分子有新化学键形成,要放出热量,故2E1>E2,D项错误。
答案B
8.氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,断裂1 mol H2中的化学键消耗的能量为Q1 kJ,断裂1 mol Cl2中的化学键消耗的能量为Q2 kJ,形成1 mol HCl中的化学键释放的能量为Q3 kJ。下列关系式中,正确的是( )
A.Q1+Q2>Q3 B.Q1+Q2>2Q3
C.Q1+Q2”或“<”)形成新化学键 (填“吸收”或“放出”)的能量。
(6)该反应在常温下就可进行,说明 。
解析(1)氯化铵属于铵盐,能和强碱氢氧化钡反应生成氨气、水以及氯化钡,化学方程式为Ba(OH)2·8H2O+2NH4ClBaCl2+2NH3↑+10H2O。(2)Ba(OH)2·8H2O晶体和氯化铵晶体之间的反应是固体之间的反应,搅拌可使混合物充分接触并发生反应。(4)氢氧化钡和氯化铵的反应是吸热反应,可以根据用手触摸烧杯外壁变凉、用温度计测混合物的温度降低、玻璃片上结冰现象、烧杯和底部的玻璃片粘在一起等现象来证明。(5)反应吸热,则反应物的总能量小于生成物的总能量,旧键断裂吸收的能量高于新键生成放出的能量。(6)该反应在常温下就可以进行,说明吸热反应不需要加热也可发生。
7
答案(1)Ba(OH)2·8H2O+2NH4ClBaCl2+10H2O+2NH3↑
(2)使反应物充分混合,迅速发生反应,使体系的温度降低
(3)①反应物未进行快速搅拌;②玻璃片上滴加的水太多;③氢氧化钡晶体已部分失水;④环境温度太高;⑤试剂用量太少;⑥氢氧化钡晶体未研成粉末(任选3个,其他答案合理均可)
(4)第一种方案:在烧杯中的反应物中插入温度计,通过测量,发现反应后温度计的示数下降,说明反应是吸热反应;第二种方案:用皮肤感受,感觉烧杯外壁很凉,说明此反应为吸热反应
(5)吸收 吸收 > 放出
(6)有的吸热反应不需要加热也可发生
7
相关文档
- 高中化学 第三章 第二节 乙烯 第12021-08-067页
- 人教版高中化学选修五 2_3卤代烃第2021-08-066页
- 高中化学58个精讲5碱金属元素2021-08-068页
- 人教版高中化学选修五 1_1 有机化2021-08-063页
- 2020高中化学 知识讲解学案 新人教2021-08-064页
- 高中化学 2_2_1 价层电子对互斥理2021-08-065页
- 高中化学人教版选修二练习:2_2_1 海2021-08-064页
- 【化学】福建省宁德市高中同心顺联2021-08-0618页
- 化学·河南省周口市淮阳县朱集高中2021-08-0626页
- 高中化学 4_2化学电源练习 新人教2021-08-069页