- 190.30 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时训练15 金属的腐蚀及防止
基础夯实
1.下列金属制品最易被腐蚀的是( )
A.铁锅 B.铝壶
C.不锈钢的菜刀 D.镀铬的自行车钢圈
解析:铁锅在使用时比较容易与水、空气接触而发生电化学腐蚀;铝表面易形成氧化膜保护内部金属不被腐蚀;不锈钢的菜刀由于改变了金属的内部结构增强了抗腐蚀性;镀铬的自行车钢圈阻止内部金属与外界接触,增强了抗腐蚀性能。
答案:A
2.下列叙述中不正确的是( )
A.金属的电化学腐蚀比化学腐蚀普遍
B.钢铁在干燥空气里不易腐蚀
C.用铝质铆钉焊接铁板,铁板易被腐蚀
D.原电池外电路中电子由负极流入正极
解析:金属腐蚀以电化学腐蚀为主,在潮湿环境中腐蚀快,铝比铁活泼,铝钉铆在铁板上,铝失电子,铁被保护。原电池外电路中电子由负极流入正极。
答案:C
3.下列叙述不正确的是( )
A.锌与稀硫酸反应制取氢气,加入少量的硫酸铜能加快反应速率
B.镀层破损后,白铁(镀锌铁)比马口铁(镀锡铁)更易被腐蚀
C.钢铁表面常易被锈蚀生成Fe2O3·nH2O
D.钢铁发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应
解析:锌与CuSO4发生置换反应后,铜附着在锌的表面上,浸泡在稀硫酸中形成铜锌原电池,负极锌被氧化速率加快,A项正确。白铁中锌为负极、铁为正极,铁被保护;马口铁中铁为负极、锡为正极,加快铁的腐蚀,故B项错误。钢铁的腐蚀主要是吸氧腐蚀,其电极反应为:负极(Fe):Fe-2e-Fe2+,正极(C):2H2O+O2+4e-4OH-。Fe(OH)2在空气中发生反应:4Fe(OH)2+O2+2H2O4Fe(OH)3,久置后2Fe(OH)3Fe2O3·nH2O+(3-n)H2O,所以铁锈的成分是Fe2O3·nH2O,C项正确。钢铁在发生析氢腐蚀和吸氧腐蚀时,负极反应相同,都是Fe-2e-Fe2+,但正极反应不同,分别析出氢气和吸收氧气,D项正确。
答案:B
4.铁是用途最广的金属材料之一。为探究铁的化学性质,某同学将盛有生铁屑的试管塞上蓬松的棉花,然后倒置在水中(如右图所示)。数天后,他观察到的现象是( )(导学号52690103)
A.铁屑不生锈,试管内液面上升
B.铁屑不生锈,试管内液面高度不变
C.铁屑生锈,试管内液面上升
D.铁屑生锈,试管内液面高度不变
解析:装置中的生铁屑在潮湿的空气中发生吸氧腐蚀,电池反应为2Fe+O2+2H2O2Fe(OH)2,4Fe(OH)2+O2+2H2O4Fe(OH)3,最终Fe(OH)3失水生成铁锈,A、B错误;因反应消耗氧气,使试管内气压减小,试管内液面上升,C正确,D错误。
答案:C
5.钢铁“发蓝”是在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130 ℃反应。其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH3Na2FeO2+H2O+NH3↑;
②6Na2FeO2+NaNO2+5H2O3Na2Fe2O4+NH3↑+7NaOH;
③Na2FeO2+Na2Fe2O4+2H2OFe3O4+4NaOH。
下列说法正确的是( )
A.该生产过程不会产生污染
B.反应①②中的还原剂均为NaNO2
C.反应①②③均是氧化还原反应
D.四氧化三铁具有抗腐蚀作用
解析:上述生产中涉及有毒物质NaNO2,且也生成造成大气污染(NH3)和水污染(NaOH)的副产物,故A项不正确;在①②两个反应中NaNO2均被还原为NH3,NaNO2作氧化剂,故B项错误;反应③不是氧化还原反应,故C项不正确;钢铁表面形成Fe3O4薄膜,就是利用了Fe3O4的抗腐蚀性,起保护作用,故D项正确。
答案:D
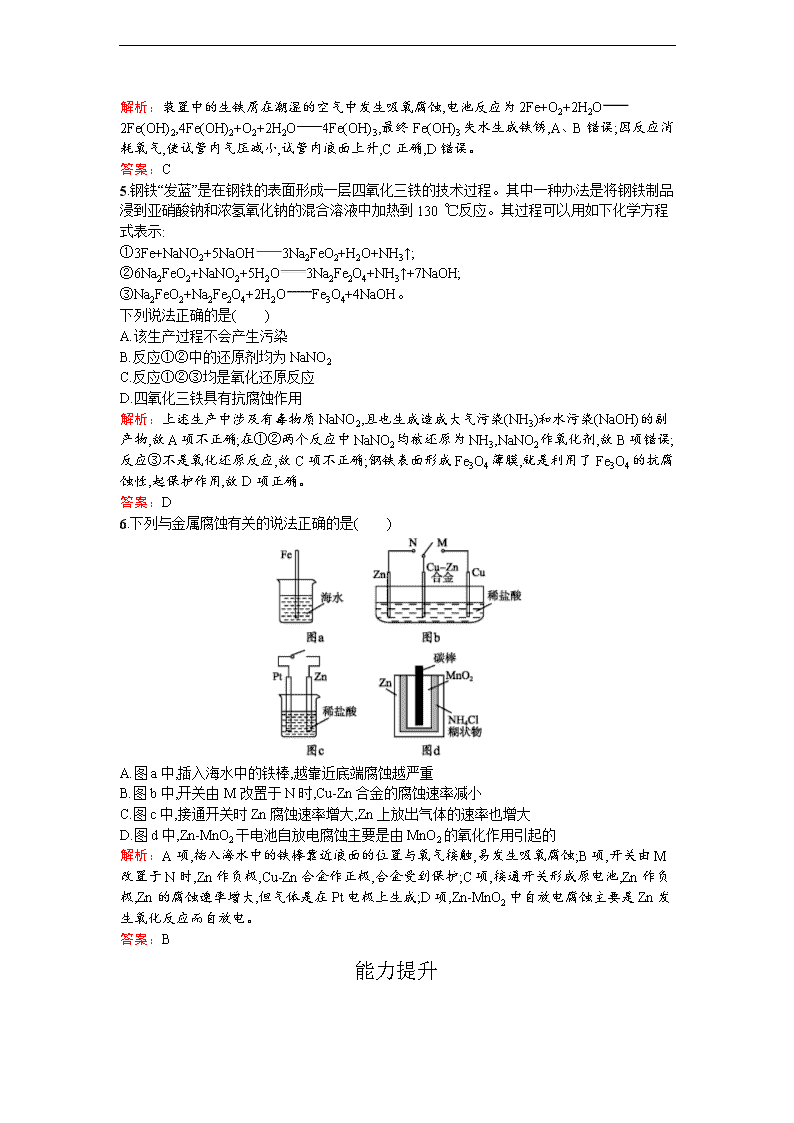
6.下列与金属腐蚀有关的说法正确的是( )
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
解析:A项,插入海水中的铁棒靠近液面的位置与氧气接触,易发生吸氧腐蚀;B项,开关由M改置于N时,Zn作负极,Cu-Zn合金作正极,合金受到保护;C项,接通开关形成原电池,Zn作负极,Zn的腐蚀速率增大,但气体是在Pt电极上生成;D项,Zn-MnO2中自放电腐蚀主要是Zn发生氧化反应而自放电。
答案:B
能力提升
7.我们已经知道,铁在潮湿空气中易生锈,试设计一组实验(也可用图示)来证明铁的生锈既不单纯是水的作用也不单纯是空气中氧气的作用,而是水和氧气共同作用的结果。将结果填入下表。
实验过程
实验现象
各步结论
解析:这是一道实验设计题目,要求证明铁生锈是两个条件共同作用造成的,因此在设计时要单独考虑每一个条件对实验的影响,因此要设计3种情况:有O2无H2O;有H2O无O2;既有H2O又有O2。
答案:
实验过程
实验现象
各步结论
无铁锈
没有水,不能生锈
无铁锈
没有氧气,
不能生锈
有铁锈
氧气和水共同作
用,才能生锈
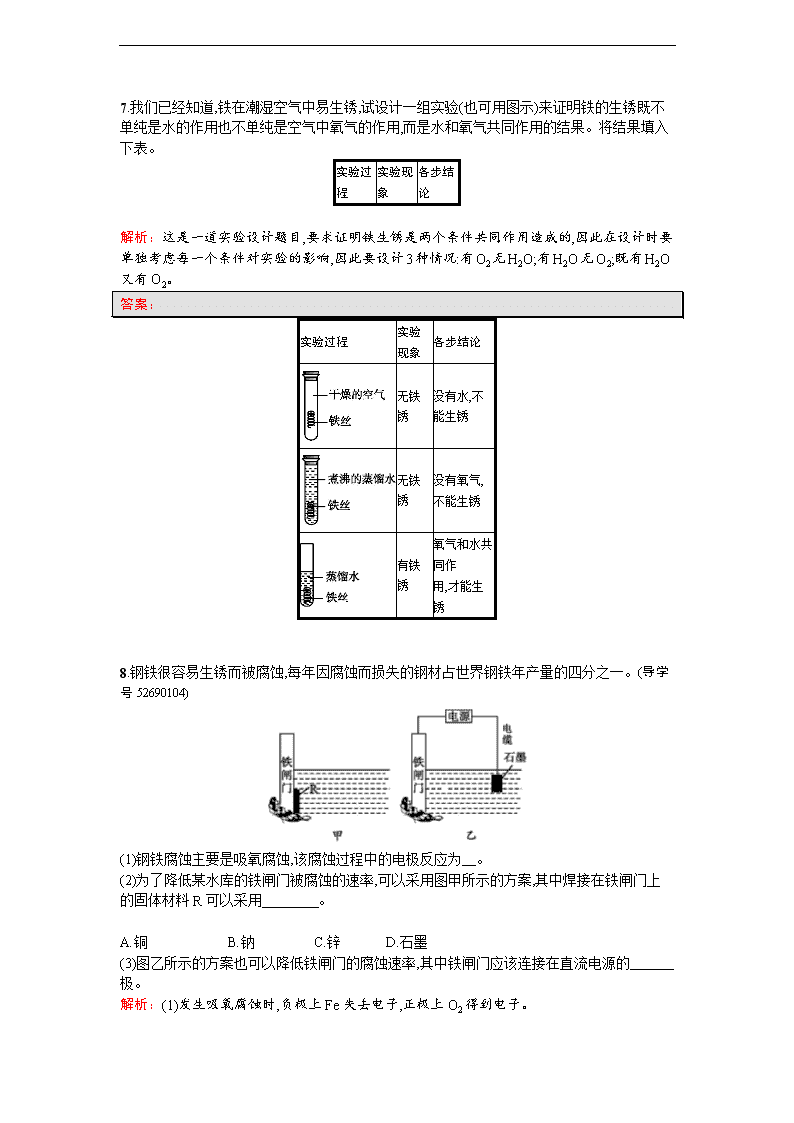
8.钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。(导学号52690104)
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应为 。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用 。
A.铜 B.钠 C.锌 D.石墨
(3)图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的 极。
解析:(1)发生吸氧腐蚀时,负极上Fe失去电子,正极上O2得到电子。
(2)铁闸门上连接一块比铁活泼的金属如锌,就可由锌失去电子,锌被溶解,而铁被保护,属于牺牲阳极的阴极保护法。
(3)属于外加电流的阴极保护法,需把被保护的铁闸门连接在电源的负极。
答案:(1)负极:2Fe-4e-2Fe2+,正极:O2+2H2O+4e-4OH-
(2)C
(3)负