- 916.99 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
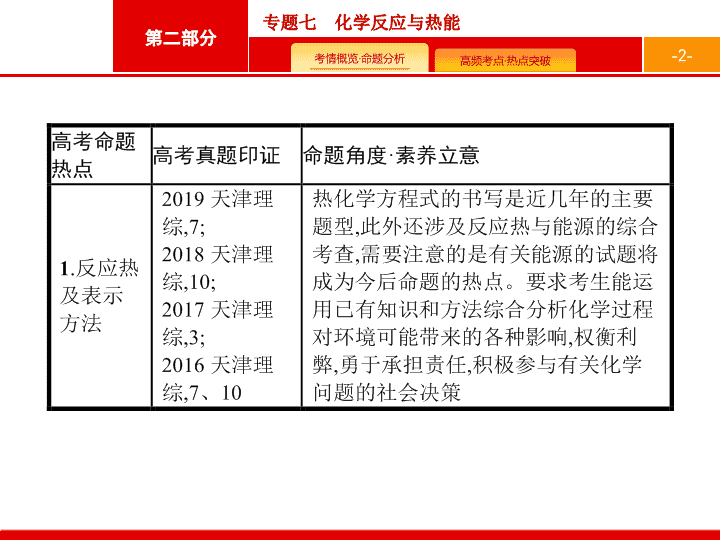
专题七 化学反应与热能
-
2
-
-
3
-
-
4
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
反应热及表示方法
1
.
化学反应中的能量变化
(1)
E
1
表示正反应的活化能
,
即从反应物至最高点的能量数值
;
(2)
E
2
表示逆反应的活化能
,
即最高点至生成物的能量数值
;
(3)Δ
H
=
E
1
-E
2
,
即反应的焓变。
-
5
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
2
.
热化学方程式正误判断的六个易错点
-
6
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
例
1
某反应过程能量变化如图所示
,
下列说法不正确的是
(
)
A.
该反应反应物的总能量大于生成物的总能量
B.
该反应为放热反应
,
热效应等于
Δ
H
C.
改变催化剂
,
可改变该反应的活化能
D.
有催化剂条件下
,
反应的活化能等于
E
1
+E
2
D
-
7
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
解析
:
催化剂使反应需要的能量降低
,
即活化能降低
,
反应速率会增大
,
所以
b
过程应该是加入了催化剂
,
但是催化剂并不能改变反应物能量和生成物的能量
,
所以反应热不改变。
活化能是使反应物分子变为活化分子吸收的能量
,
即反应物能量与最高能量之差。催化剂存在时
,
活化能为
E
1
。使用不同的催化剂
,
反应的活化能不同。
-
8
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
题后反思
(1)
分析反应热效应时
,
只需用图像的起点
(
反应物总能量
)
和终点
(
生成物总能量
)
来判断反应是放热还是吸热及反应热的大小。
(2)
加入催化剂
,
反应的活化能降低
,
图线应下降
,
但图像的起点和终点不变。
-
9
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
例
2
依据事实
,
写出下列反应的热化学方程式。
(1)
在
25
℃
、
101 kPa
下
,1 g
甲醇燃烧生成
CO
2
和液态水时放热
22.68 kJ
。则表示甲醇燃烧热的热化学方程式为
。
(2)
若适量的
N
2
与
O
2
完全反应
,
每生成
23 g NO
2
需要吸收
16.95 kJ
热量
,
相关的热化学方程式为
。
(4)
在
25
℃
、
101 kPa
下
,
已知
SiH
4
气体在氧气中完全燃烧后恢复至原状态
,
平均每转移
1 mol
电子放热
190.0 kJ,
该反应的热化学方程式是
。
-
10
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
-
11
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
-
12
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
1
.(2018
北京理综
)
我国科研人员提出了由
CO
2
和
CH
4
转化为高附加值产品
CH
3
COOH
的催化反应历程。该历程示意图如下。
下列说法不正确的是
(
)
A.
生成
CH
3
COOH
总反应的原子利用率为
100%
B.CH
4
→
CH
3
COOH
过程中
,
有
C—H
键发生断裂
C.
①
→
②
放出能量并形成了
C—C
键
D.
该催化剂可有效提高反应物的平衡转化率
D
-
13
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
2
.
已知
1 g
氢气完全燃烧生成液态水时放出热量
143 kJ,18 g
水蒸气变成液态水放出
44 kJ
的热量。其他相关数据如下表
:
则表中
x
为
(
)
A.920 B.557
C.463 D.188
C
-
14
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
3
.
下列说法正确的是
(
)
A.
在化学反应过程中
,
发生物质变化的同时不一定发生能量变化
B.
破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时
,
该反应为吸热反应
C.
生成物的总焓大于反应物的总焓时
,
反应吸热
,Δ
H
>0
D.Δ
H
的大小与热化学方程式中的化学计量数无关
C
-
15
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
4
.(1)(2015
天津理综节选
)
已知
1 mol
钠在足量
O
2
中燃烧
,
恢复至室温
,
放出
255.5 kJ
热量
,
写出该反应的热化学方程式
:
。
(2)NaBH
4
(s)
与
H
2
O(l)
反应生成
NaBO
2
(s)
和
H
2
(g)
。在
25
℃
、
101 kPa
下
,
已知每消耗
3.8 g NaBH
4
(s)
放热
21.6 kJ,
该反应的热化学方程式为
。
(3)
化合物
AX
3
与单质
X
2
在一定条件下反应可生成化合物
AX
5
。已知
AX
3
的熔点和沸点分别为
-93.6
℃
和
76
℃
,AX
5
的熔点为
167
℃
。室温时
AX
3
与气体
X
2
反应生成
1 mol AX
5
,
放出热量
123.8 kJ
。该反应的热化学方程式为
。
-
16
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
5
.(2019
江西师大附中期末
)
氨在工农业生产中应用广泛。在压强为
30 MPa
时
,
合成氨平衡混合气体中
NH
3
的体积分数如下
:
请回答下列问题
:
(1)
根据图中所示
,
合成氨的热化学方程式是
。
-
17
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
(2)
取
1 mol N
2
(g)
和
3 mol H
2
(g)
放在一密闭容器中
,
在催化剂存在时进行反应
,
测得反应放出的热量
(
填
“
大于
”“
小于
”
或
“
等于
”) 92.2
kJ,
原因是
;
若加入催化剂
,Δ
H
(
填
“
变大
”“
变小
”
或
“
不变
”)
。
(3)
已知
:
分别破坏
1 mol N
≡
N
键、
1 mol H—H
键需要吸收的能量为
946 kJ
、
436 kJ,
则破坏
1 mol N—H
键需要吸收的能量为
kJ
。
(2)
小于 该反应是可逆反应
,
反应物无法全部转化为生成物 不变
(3)391
-
18
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
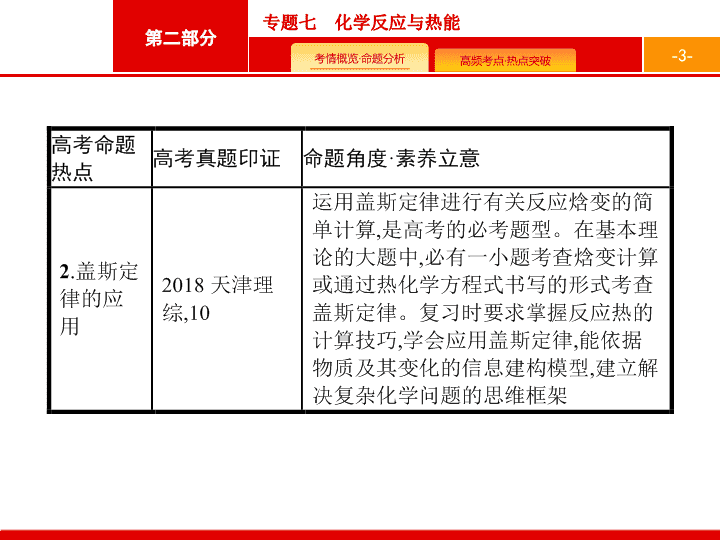
盖斯定律的应用
1
.
根据盖斯定律解题的思维路径
2
.
运用盖斯定律求反应热
参照目标热化学方程式
,
设计合理的反应途径
,
对原热化学方程式进行恰当
“
变形
”(
反写、乘除某一个数
),
然后热化学方程式之间进行
“
加减
”,
从而得出新的热化学方程式。
具体方法
:(1)
热化学方程式乘以某一个数时
,
反应热也必须乘上该数
;(2)
热化学方程式
“
加减
”
时
,
同种物质之间可相
“
加减
”,
反应热也随之
“
加减
”
。
-
19
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
3
.
运用盖斯定律时的注意事项
(1)
将一个热化学方程式颠倒时
,Δ
H
的
“+”“-”
号也随之改变
,
但绝对值不变。
(2)
注意物质中共价键的数目
:
如
1 mol H
2
、
P
4
分别含有
1 mol H—H
键、
6 mol P—P
键
,1 mol H
2
O
中含有
2 mol O—H
键
,1 mol NH
3
中含有
3 mol N—H
键
,1 mol CH
4
中含有
4 mol C—H
键。
-
20
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
例
3
发射卫星用
N
2
H
4
气体为燃料
,NO
2
气体为氧化剂
,
两者反应生成
N
2
和水蒸气
,
已知
:
写出
N
2
H
4
气体与
NO
2
气体反应生成氮气和液态水的热化学方程式
:
。
-
21
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
1
.
根据如图所给信息
,
得出的结论正确的是
(
)
B
-
22
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
C
-
23
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
答案
:
-
45.5
-
24
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
-
25
-
突破点
1
突破点
2
考点整合
•
筑基础
热点突破
•
悟方法
迁移训练
•
提能力
答案
:
(1)53.1
(2)-136.2
(3)+120 kJ·mol
-1
B