- 1.14 MB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题一 物质的组成、性质、分类
及化学用语
主干知识整合
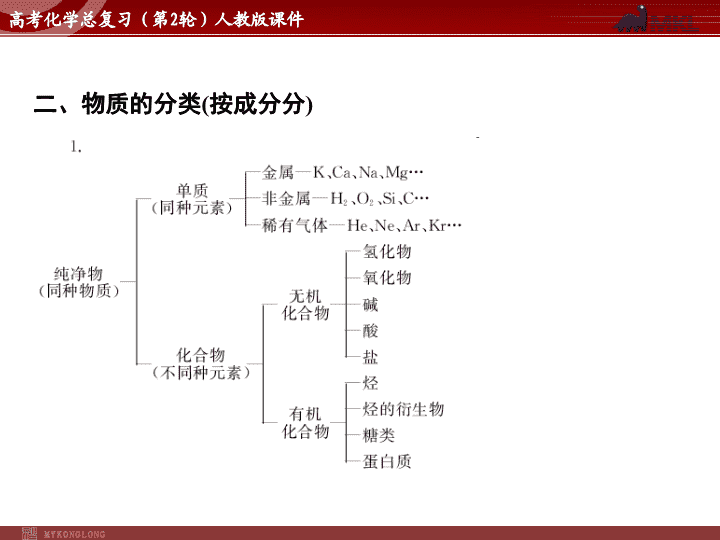
一、物质的组成
二、物质的分类
(
按成分分
)
三、化学用语
考点
1
物质的组成和分类
1.
物质的组成
从宏观的角度看
,
物质由元素组成
;
从微观的角度看
,
原子
、
分子
、
离子等是构成物质的基本粒子
。
物质组成的判断依据有
:
(1)
根据有无固定的组成或有无固定的熔
、
沸点可判断该物质是纯净物还是混合物
。
其中
:
油脂
、
高分子化合物
、
玻璃态物质及含有同种元素的不同同素异形体的物质均属于混合物
。
(2)
对于化合物可根据晶体类型判断
:
离子晶体是由阴
、
阳离子构成的
;
分子晶体是由分子构成的
;
原子晶体是由原子构成的
。
(3)
对于单质也可根据晶体类型判断
:
金属单质是由金属阳离子和自由电子构成的
;
原子晶体
、
分子晶体分别由原子
、
分子构成
。
2.
物质的分类
(1)
分类是研究物质化学性质的基本方法之一
,
物质分类的依据有多种
,
同一种物质可能分别属于不同的物质类别
。
(2)
物质的分类依据不同
,
可以有多种分类方法
,
特别是氧化物的分类是物质分类的难点
,
要掌握此类知识
,
关键是明确其分类方法
:
氧化物的分类比较复杂
,
判断氧化物所属类别时
,
应注意以下几个问题
:
①
酸性氧化物不一定是非金属氧化物
,
如
CrO
3
是酸性氧化物
;
非金属氧化物不一定是酸性氧化物
,
如
CO、NO
和
NO
2
等
。
②
碱性氧化物一定是金属氧化物
,
但金属氧化物不一定是碱性氧化物
,
如
Na
2
O
2
为过氧化物
(
又称为盐型氧化物
),Pb
3
O
4
和
Fe
3
O
4
为混合型氧化物
(
一种复杂氧化物
),Al
2
O
3
和
ZnO
为两性氧化物
,Mn
2
O
7
为酸性氧化物
。
③
酸性氧化物
、
碱性氧化物不一定都能与水反应生成相应的酸
、
碱
(
如
SiO
2
、
MgO)
考点
2
物质的性质和变化
1.
物质的性质
2.
物质的变化
考点
3
化学用语
考点
4
分散系
分散系
溶液
浊液
胶体
分散质粒
子的大小
<1 nm
>100 nm
1 nm~100 nm
分散质粒子
单个小分
子或离子
巨大数目分
子的集合体
高分子或多
分子集合体
性
质
外观
均一
,
透明
不均一
,
不透明
均一
,
透明
稳定性
稳定
不稳定
介稳定
粒子能否透
过滤纸
能
不能
能
粒子能否透
过半透膜
能
不能
不能
丁达尔效应
无
无
有
考情分析
:
物质的组成
、
性质和分类
,
化学用语是中学化学最基础的概念
,
是历年高考的必考内容
,
也是新课标所要求的重点内容
,
属于热点问题
,
但试题一般难度都不大
,
主要以生活中的化学知识或重大科技成果为背景
,
以相关的基础化学知识为考点
。
重点侧重概念的类比和辨析
,
突出对概念的准确理解和化学用语的书写规范
。
预计今后的高考中对本专题内容的考查不会有太大的变化
,
但考查的方式会因试题的变化而变化
。
题型一 物质的组成和分类
【
例
1】
物质分类的依据通常有组成和性质
,
下列物质分类中
,
只考虑组成的是
( )
A.Na
2
SO
4
是钠盐
、
硫酸盐
、
正盐
B.HNO
3
是一元酸
、
强酸
、
挥发性酸
C.Mg(OH)
2
是二元碱
、
难溶性碱
、
中强碱
D.Al
2
O
3
是两性氧化物
、
金属氧化物
、
最高价氧化物
[
答案
] A
[
解析
]
具有相同组成的物质在某些性质上具有相似性
,
具有相同的某一性质的不同物质
,
其组成不一定相同
,
从掌握组成
、
性质等方面对单质
、
酸
、
碱
、
盐
、
氧化物进行分类
,
可加深对物质性质的理解
。
这种类型是以前高考命题中没有出现过的
,
是今后高考中值得注意的一个问题
,Na
2
SO
4
中含
Na
+
,
它是钠盐
;
含
SO
4
2-
,
它是硫酸盐
;
电离出的阳离子只有
Na
+
,
阴离子只有
SO
4
2-
,
没有其他的阴
、
阳离子
,
故它属正盐
。
从组成看
,1
个
HNO
3
分子只电离出
1
个
H
+
,
故它是一元酸
;HNO
3
在溶液中完全电离成
H
+
和
NO
-
3
,
故它是强酸
;HNO
3
容易挥发
,
故它是挥发性酸
;
强酸性和挥发性反映了
HNO
3
的性质
。Mg(OH)
2
是二元碱是从组成看的
,
说明
1 mol Mg(OH)
2
能电离出
2 mol OH
-
,
而难溶性碱
、
中强碱是它的性质
。Al
2
O
3
是两性氧化物
,
说明它既能与
OH
-
反应
,
又能与
H
+
反应
,
是从性质方面来分类的
;
它是金属氧化物
、
最高价氧化物
,
是从组成方面分类的
。
[
点拨
] 1.
分类的标准及原则
必须按同一标准进行
,
分类的子项应当互不相容
,
各子项必须是全异关系
,
各子项之和必须等于母项
。
2.
物质类别的判断
判断物质的类别
,
主要看物质的组成元素和该物质中粒子的相互作用
。
(1)
根据有无固定的组成可判断是纯净物还是混合物
,
再根据是由几种元素形成的该物质
,
来判断是单质还是化合物
。
(2)
对于单质
,
根据结构和性质可判断是否是同素异形体
。
(3)
对于化合物可根据化学键来判断
:①
若含有离子键
,
则一定是离子化合物
,
如
NaCl、NH
4
Cl、Na
2
SO
4
;②
若全以共价键形成
,
则是共价化合物
,
如
CO、SiO
2
、HNO
3
。
(4)
对于化合物可根据组成元素
(
是否含碳
)
分为无机化合物和有机化合物
:
①
无机化合物根据组成又可分为氧化物
、
氢化物
、
酸
、
碱
、
盐
,
它们可由原子组成
,
也可由分子或离子组成
;
②
有机物根据官能团和性质可分为烃
、
烃的衍生物
(
卤代烃
、
醇
、
酚
、
醛
、
羧酸
、
酯
)
、
高分子化合物等
,
有机物大部分由分子组成
。
【
变式训练
1】
某学习小组讨论辨析以下说法
:①
油脂的硬化属于化学变化
;②
沼气和水煤气都是可再生能源
;③
明矾
、
石膏
、
冰醋酸都是电解质
;④
氨气
、
二氧化碳
、
蔗糖
、
乙醇都是非电解质
;⑤
盐酸
、
漂白粉
、
水玻璃
、
水银都是混合物
;⑥
同种元素组成的物质一定是纯净物
;⑦
甘油不是油
,
纯碱不是碱
,
干冰不是冰
。
上述说法正确的是
( )
A.①②③④ B.①②⑤⑥
C.②⑤⑥⑦
D.①③④⑦,m
[
解析
]
油脂硬化是加成反应
(
也是还原反应
),
属于化学变化
;
生产水煤气需要煤
,
煤是不可再生资源
,
故水煤气也属于不可再生能源
;
甘油属于醇
、
纯碱是盐
、
干冰是固态二氧化碳
,
不是冰
(
冰是固态的水
)。
[
答案
] D
题型二 物质的变化
【
例
2】
下列各组物质发生的变化中
,
均属于化学变化的一组是
( )
A.
少量酒精在空气中挥发不见了
;
少量酒精在空气中燃烧后消失
B.
块状生石灰在空气中逐渐变成粉末
;
晶体碳酸钠在空气中逐渐变成粉末
C.
木炭燃烧发光
、
发热
;
电灯发光
、
发热
D.
石灰水中通入少量
CO
2
后变浑浊
;
室温下的饱和石灰水加热后变浑浊
[
解析
] A
项
,
酒精的挥发是物理变化
,
而酒精的燃烧是化学变化
;B
项
,
前者是
CaO
与空气中的水和
CO
2
反应生成了
CaCO
3
,
是化学变化
,
后者是
Na
2
CO
3
·10H
2
O
风化失去水
,
也属于化学变化
,
正确
;C
项
,
木炭燃烧发光
、
发热属于化学变化
,
电灯发光
、
发热属于物理变化
;D
项
,
前者是
Ca(OH)
2
与
CO
2
反应生成了
CaCO
3
,
是化学变化
,
后者是因为
Ca(OH)
2
的溶解度随温度的升高而降低
,
是物理变化
。
[
答案
] B
[
点拨
] (1)
化学变化中常伴有发光
、
放热现象
,
但有发光
、
放热现象的变化不一定属于化学变化
,
如金属受热发光
。
(2)
化学变化中一定存在化学键的断裂和形成
,
但存在化学键断裂的变化不一定是化学变化
,
如
HCl
溶于水
、
熔融
NaCl
电离等
。
(3)
原子的裂变
、
聚变虽有新物质生成
,
但它不属于中学化学意义上的化学变化
。
【
变式训练
2】
下列过程中发生了化学变化的是
( )
A.
红磷加热到
416℃
升华后冷凝得白磷
B.
分馏石油产生汽油
C.
二氧化碳气体变成干冰
D.
氯化钠变成氯离子和钠离子
[
答案
] A
[
解析
]
在判断物质的变化类型时
,
要抓住变化后有无新物质生成这一关键点
。
红磷和白磷是不同的物质
,
因此同素异形体之间的转化均为化学变化
;
石油是一种复杂的混合物
,
汽油是从石油中分馏出来的
,
不是生成的新物质
;
干冰是二氧化碳在固态时的名称
,
干冰和二氧化碳只是分子聚集状态的不同
,
并无新物质生成
;
氯化钠电离为钠离子和氯离子也只是聚集状态的变化
,
因此
B、C、D
三项均为物理变化
。
题型三 化学用语
【
例
3】
下列有关化学用语使用正确的是
( )
[
解析
]
有关表示物质结构的化学基本用语
,
要从规范性和含义上去理解
。
选项
A,S
原子核外有
16
个电子
,
最外层电子数应该为
6,
题给出的为
S
2-
的结构示意图
,A
错误
;
选项
B,
忽视了
Cl
-
最外层有
8
个电子
,
且需用“
[ ]”,B
错误
;
选项
C,
该
O
原子的原子序数为
8,
质量数
=10+8=18,C
正确
。
选项
D,
表示的是邻氯甲苯的结构简式
。
[
答案
] C
[
点拨
] (1)
在分子晶体中用元素符号表示单质分子或化合物分子或化合物分子组成的式子是分子式
,
在离子晶体和原子晶体中
,
用元素符号表示其物质组成的式子称为化学式
,
化学式并不表示物质的真正组成
。
(2)
用短线表示一对共用电子对的图式
,
用来表示分子中所有原子的结合方式和排列顺序
(
不表示空间结构
),
叫做结构
式
,
如
N
≡
N
、
,
结构简式是简化碳氢键和碳碳单键突出官能团的式子
,
如
CH
3
CH
2
OH、C
6
H
5
OH、CH
3
CHO、CH
2
CH
2
,
有机物一般用结构简式表示
,
需要注意的是离子化合物不能用结构式和结构简式表示
。
题型四 胶体的性质
【
例
4】
下列关于溶液和胶体的叙述
,
正确的是
( )
A.
溶液是电中性的
,
胶体是带电的
B.
通电时
,
溶液中的溶质粒子分别向两极移动
,
胶体中的分散质粒子向某一极移动
C.
溶液中溶质粒子的运动有规律
,
胶体中分散质粒子的运动无规律
,
即布朗运动
D.
一束光线分别通过溶液和胶体时
,
后者会出现明显的光带
,
前者则没有
[
解析
] A
项
,
胶粒带电
,
而胶体是电中性的
;B
项
,
溶液中溶质若是非电解质
,
通电时不向两极移动
,
胶体中分散质粒子不带电时
,
不向某一极移动
;C
项
,
溶液中溶质粒子运动也无规律
;D
项
,
胶体有丁达尔效应而溶液没有
,
故选
D。
[
答案
] D
[
点拨
] (1)
胶体分散系比较稳定的原因
:
在胶体中
,
分散质粒子不断地进行无规则运动
;
同种胶体粒子带同种电荷
,
由于电荷的存在使胶粒之间相互排斥
,
不易聚沉从而使胶体保持相对稳定
,
这是主要原因
。
(2)
在胶体分散系中
,
胶体粒子是带电荷的
,
不能说胶体带电荷
,
因为整个胶体是呈电中性的
。
(3)
电泳现象
:
证明了胶体粒子是带电荷的
。
但有些胶体粒子
(
如淀粉胶体
)
不带电荷
,
同时还应注意电泳现象是胶粒定向移动产生的
,
并没有发生聚沉
。
(4)
胶粒呈中性的胶体如淀粉胶体
,
无电泳现象
,
遇电解质溶液不发生聚沉
,
若使之聚沉可采用加热法
。
(5)
有些胶体遇足量强酸或强碱时
,
先聚沉形成沉淀
,
后沉淀溶解形成溶液
,
如
Fe(OH)
3
胶体
、Al(OH)
3
胶体
、
硅酸胶体
。
【
变式训练
4】
关于胶体的下列说法中正确的是
______
。
①
制备
Fe(OH)
3
胶体
,
通常是将
Fe(OH)
3
固体溶于热水中
;②
当带有相反电荷的胶体粒子相混合时
,
不会发生聚沉
;③
电泳现象证明胶体带电
,
属于电解质溶液
;④
血液透析原理依据的是胶体的性质
;⑤
布朗运动是胶体微粒特有的运动方式
,
可以据此把胶体和溶液
、
浊液区别开来
;⑥
氢氧化铁胶体稳定存在的主要原因是胶粒带正电荷
。
[
答案
] ④⑥
► 探究点一 物质的组成与分类
1
.纯净物和混合物
(1)
物质是否具有固定的熔、沸点是区别纯净物和混合物的标志。如玻璃、陶瓷、水泥、石油、聚乙烯等均无固定的熔、沸点,属于混合物。
(2)
溶液、悬浊液、乳浊液、胶体、高分子材料等都是混合物。比较常见的混合物及其俗名有:
①
水煤气:
CO
、
H
2
;
②
天然气
(
沼气
)
:主要成分
CH
4
;
③
液化石油气:以
C
3
H
8
,
C
4
H
10
为主;
④
裂解气:以
C
2
H
4
为主;
⑤
水玻璃
(
泡花碱
)
:
Na
2
SiO
3
的水溶液;
⑥
王水:浓盐酸和浓硝酸按体积比
3
∶
1
混合;
⑦
波尔多液:
CuSO
4
+
Ca(OH)
2
;
⑧
肥皂:主要成分
C
17
H
35
COONa
;
⑨
碱石灰;
⑩
铝热剂;
⑪
漂白粉等。
[
特别注意
]
①
只含一种元素的物质不一定是纯净物,如石墨和金刚石;
②
油脂不属于高分子化合物;
③
能电离出
H
+的物质不一定是酸,如
NaHSO
4
;
④
HD
、
CuSO
4
·5H
2
O
、磁性氧化铁都是纯净物。
2
.氧化物的分类
(1)
碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物。如
Mn
2
O
7
为酸性氧化物、
Al
2
O
3
为两性氧化物、
Na
2
O
2
为过氧化物、
KO
2
为超氧化物等。
(2)
酸性氧化物不一定是非金属氧化物,如
Mn
2
O
7
;非金属氧化物也不一定是酸性氧化物,如
CO
、
NO
。
(3)
酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸碱,如
SiO
2
、
CuO
。
例
1
、
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
(
)
①
根据酸分子中含有
H
原子个数将酸分为一元酸、二元酸等
②
碱性氧化物一定是金属氧化物
③
蛋白质、乙酸和葡萄糖均属电解质
④
SiO
2
是酸性氧化物,能与
NaOH
溶液反应
⑤
根据反应的热效应将化学反应分为放热反应和吸热反应
A
.
②③
B
.
②④⑤
C
.
①②④
D
.
②③④⑤
B
【
解析
】
①
根据酸分子电离时能产生氢离子的个数将酸分为一元酸、二元酸等;
②
碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物;
③
蛋白质和葡萄糖均不属于电解质;
④
SiO
2
虽然能与氢氟酸反应,但为其特性,仍然属于酸性氧化物;
⑤
反应中放出热量的反应是放热反应,反之,就是吸热反应。
【
点评
】
对物质分类的判断主要从分类标准与分类结果是否正确,以及概念间的从属关系是否匹配等方面进行分析。有关物质分类的试题虽然难度很小,但往往渗透到高中化学的各个知识点进行考查,考查的内容往往都是各知识点中的基本概念问题,因此,复习概念时要善于抓住概念的本质,如两性氧化物指“既能与酸反应又能与碱反应生成盐和水的氧化物”,二氧化硅虽既能与氢氟酸反应,又能与氢氧化钠溶液反应,但不是生成盐和水,故不属于两性氧化物。
【
变式
1】
某合作学习小组讨论辨析以下说法:
①
粗盐和酸雨都是混合物;
②
沼气和水煤气都是可再生能源;
③
冰和干冰既是纯净物又是化合物;
④
钢铁和硬币都是合金;
⑤
盐酸和食醋既是化合物又是酸;
⑥
纯碱和熟石灰都是碱;
⑦
烟和豆浆都是胶体。
上述说法中正确的是
(
)
A
.
①③④⑦
B
.
①②③④
C
.
①②⑤⑥
D
.
③⑤⑥⑦
A
【
解析
】
水煤气是炽热的碳与水蒸气反应而得,而碳为非再生能源,
②
错;盐酸和食醋都是混合物,
⑤
错;纯碱不属于碱,而属于盐,
⑥
错。
【
变式
1】
下列说法正确的是
(
)
A
.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B
.蔗糖、硫酸钡和水分别属于非电解质、电解质和弱电解质
C
.
Mg
、
Al
、
Cu
可以分别用置换法、直接加热法和电解法冶炼得到
D
.天然气、沼气和水煤气分别属于化石能源、可再生能源和一次能源
B
【
解析
】
纯碱属于盐,
A
项错误;
Mg
、
Al
用电解法制取,
Cu
用热还原法制取,
C
项错误;水煤气为二次能源,
D
项错误。
例
2
下列各组物质中有一种物质的类别与其他三种物质不同。
(1)CaO
FeO
SiO
2
CuO
(2)C
S
P
Al
(3)NaOH
Na
2
SO
4
C
60
KNO
3
(4)H
2
SO
4
H
2
O
2
HNO
3
HCl
请你将每组中不同于其他三种的一种物质挑选出来,并填写原因:
(1)
物质
___________
,原因
______________________
。
(2)
物质
___________
,原因
________________________
。
(3)
物质
___________
,原因
_______________________
。
(4)
物质
____________
,原因
______________________
。
【
答案
】(1)SiO
2
SiO
2
是酸性氧化物,其余都是碱性氧化物
(2)Al
Al
是金属,其余都是非金属
(3)C
60
C
60
是单质,其余都是化合物
(4)H
2
O
2
H
2
O
2
不是强酸,其余都是强酸
(
其他合理答案也可
)
【
解析
】
在物质的分类方法运用的过程中,题目呈现的较为灵活,不仅要求学生会用分类方法,同时更重要的是要求学生对相关的一些物质具体的组成、结构或性质等方面的知识点要有一个较为全面的认识。
► 探究点二 物质组成和结构的表示方法
——
化学用语
1.
物质的表示方法
——
化学式的使用
(1)
最简式
即实验式,只表示组成物质的元素的原子个数比,不能表示物质的结构,最简式中涉及的原子个数互为质数,如乙烷的最简式为
CH
3
。
(2)
分子式
表示物质分子组成,分子式中各原子数可以不互为质数,如
H
2
O
2
。
(3)
结构简式
省略部分碳氢键和碳碳单键的有机物表示方法,但一定要突出官能团,如乙烯的结构简式不能写成
CH
2
CH
2
,而应该写成
CH
2
=
CH
2
。
(4)
结构式
表示物质内部结构中原子的排列和结合情况,要求每一条共价键都要用短线标出。
2
.常考易错的化学名词
(1)
萃取、分液、渗析、溶解、熔融、熔点;
(2)
气体逸出、溶液溢出、用玻璃棒蘸取、振荡试管;
(3)
酯化反应、焰色反应;
(4)
氨气、铵盐、乙酸乙酯、油脂、硫氰化钾;
(5)
研钵、坩埚、褪色。
3
.常考易错的电子式
(1)
混淆离子化合物与共价化合物电子式的书写。
将氯化钠、氯化铵和水的电子式:
(2)
电子式的书写不完整。
(3)
电子式的书写不规范。
[
特别注意
]
(1)
忽视羟基和氢氧根离子的区别:羟基为不带电的原子团,可表示为:
—OH
,其电子式为 ;氢氧根离子为带电的阴离子,其电子式为
。
(2)
书写官能团时忽视
“
—
”
,如将醛基
(—CHO)
错写成
CHO
。
(3)
有机物官能团的书写方向变化时,原子的书写顺序要随之变化,即要注意原子间的连接方式。如醛基可写成
—CHO
,或
OHC—
,但不能写成
HOC—
;硝基
—NO
2
不能写成
NO
2
—
,而应该写成
O
2
N—
。
例
3
、
下列关于化学用语的理解正确的是
(
)
A
.由
CH
2
=
CHCOOCH
3
合成的聚物为
B
.原子结构示意图 ,表示
6
X
或
12
C
C
.比例模型 ,表示甲烷分子或四氯化碳分子
D
.
H
+
+
OH
-
==H
2
O
,表示稀盐酸或
NaHSO
4
溶液与
NaOH
溶液反应的离子方程式
D
【
解析
】
含有一个双键的单体,其加聚产物的主链为双键碳原子,
A
项中
—COOCH
3
应为支链,该项错误;原子结构示意图 只能表示碳原子的核外电子排布,而不能反映
出该原子的质量数,
B
项错误;比例模型应能反映出组成物质分子的原子的实际大小,甲烷分子中的碳原子和氢原子半径大小之比与四氯化碳分子中碳原子和氯原子半径大小之比不相同,故
C
项中所给比例模型不能同时表示两种分子,
C
项错误。
【
变式
1】
下列有关化学用语的表达正确的是
(
)
B
【
解析
】
甲醛中碳氧之间为双键,有两对共用电子对,
A
项错误;书写乙烯的结构简式时不能省略碳碳双键,
C
项错误;氯离子的质子数为
17
,
D
项错误。
【
变式
2】
下列有关化学用语使用正确的是
(
)
D
【
解析
】
A
项中碳原子半径应比氧原子大,
A
项错误;
B
项中
F
-
最外层电子数应为
8
;
C
项没有将
H
-
的电子式表示出来,不完整,应表示为: 。
► 探究点三 一种重要的混合物
——
胶体
1
.胶体微粒一般是离子、分子或难溶物的聚集体,但有些高分子化合物,如淀粉、蛋白质,因其分子非常大,其相对分子质量通常为几万、几十万甚至上百万、千万,因此一个分子就是一个胶体微粒,它们的溶液是胶体。
2
.在胶体分散系中,胶体粒子可能带电荷,但不能说成胶体带电荷。胶体是一个体系,与溶液一样呈电中性。
3
.
Fe(OH)
3
胶体中逐滴加入强酸
(
如盐酸、硫酸
)
时,出现的现象为先沉淀后溶解。其原因为开始时出现沉淀是由于胶体中加入了电解质发生了聚沉,后来沉淀消失是发生了中和反应。
4
.分散系可根据分散质直径微粒大小分为浊液、胶体和溶液。浊液根据分散质不同可以分为悬浊液和乳浊液。
例
4
、
下列关于
FeCl
2
、
FeCl
3
溶液和
Fe(OH)
3
胶体说法不正确的是
(
)
A
.加热蒸干并灼烧,得到的产物都是氧化铁
B
.上述三种液体在一定条件下可完成如下转化关系:
FeCl
2
溶液
→
FeCl
3
溶液
→
Fe(OH)
3
胶体
C
.上述三种分散系中分散质微粒都带电荷
D
.
FeCl
2
、
FeCl
3
溶液能稳定存在,而
Fe(OH)
3
胶体不能稳定存在
D
【
解析
】
考虑
FeCl
2
和
FeCl
3
的水解、氢氧化亚铁易被氧化以及氢氧化铁受热分解等因素可知
A
项正确;
FeCl
2
溶液加入氯水可制得
FeCl
3
溶液,将
FeCl
3
的饱和溶液逐滴加入到沸水中,并继续加热至溶液呈红棕色可制得
Fe(OH)
3
胶体,
B
项正确;氢氧化铁胶粒带有正电荷,
C
项正确;胶体在一定条件下具有一定的稳定性,
D
项错误;有的分散系中的分散质不带电荷,如酒精溶液、蔗糖溶液等。
【
点评
】
高考中对胶体知识的考查往往只在选择题中的某个选项涉及,因为单独对胶体知识进行考查势必会使试题比较单薄。本题将胶体知识与氧化还原反应、水解等知识相结合进行综合考查。本题的易错点有:①忽视
FeCl
2
溶液在加热过程中的氧化反应,②忽视
FeCl
3
溶液加热蒸干过程中促进水解而得不到
FeCl
3
固体。
下列叙述正确的是
(
)
A
.明矾、小苏打、醋酸、次氯酸均为电解质
B
.碘酒、牛奶、豆浆、漂白精均为胶体
C
.根据是否具有丁达尔现象可将分散系分为溶液、胶体和浊液
D
.物质可根据在水中或熔化状态下的导电性分为电解质与非电解质
【
变式
1】
A
【
解析
】
碘酒是溶液,漂白精为次氯酸钠和氯化钠的混合物,也不属于胶体,
B
项错误;将分散系分为溶液、胶体和浊液的分类标准是分散质微粒的直径,
C
项错误;将化合物分为电解质与非电解质的分类标准是化合物在水中或熔化状态下是否导电,
D
项错误。
例
5
、
在实验中手不慎被玻璃划破,可用
FeCl
3
溶液应急止血,其主要原因可能是
(
)
A
.
FeCl
3
溶液有杀菌消毒作用
B
.
FeCl
3
溶液能使血液聚集沉降
C
.
FeCl
3
溶液能产生
Fe(OH)
3
沉淀堵住伤口
D
.
FeCl
3
能使血液发生化学反应
B
【
解析
】
血液是一种液溶胶,
FeCl
3
是电解质,用
FeCl
3
止血就是利用电解质会促使血液凝聚的原理。
【
变式
1】
将含有
0.1 mol
氯化铁的饱和溶液逐滴加入到沸水中,并继续加热至溶液呈红棕色,下列说法不正确的是
(
)
A
.所得红棕色液体为氢氧化铁胶体
B
.向该液体中逐滴加盐酸,开始时产生沉淀,盐酸足量时,沉淀消失
C
.该液体含分散质微粒
0.1 mol
D
.该液体具有丁达尔现象
C
【
解析
】
所得液体为氢氧化铁胶体,根据胶体的性质,
D
项正确;开始加入盐酸,为胶体遇电解质产生聚沉,生成氢氧化铁沉淀,盐酸足量时发生中和反应,氢氧化铁沉淀溶解,
B
项正确;氢氧化铁胶粒是小于悬浊液中固体颗粒,而远远大于分子的微小颗粒,这些颗粒体的直径范围在
1 nm
~
100 nm
之间,故
C
项中胶体微粒个数远远小于
0.1 mol
。
1
.下列各项表达中正确的是
(
)
A
.
Na
2
O
2
的电子式为
B
.
106 g
的乙醇和丙醇混合液完全燃烧生成的
CO
2
为
112 L(
标准状况
)
C
.在氮原子中,质子数为
7
而中子数不一定为
7
D
.
Cl
-
的结构示意图为
【
解析
】 C
过氧化钠为离子化合物,电子式应为 ,
A
项错误;乙醇和丙醇的含碳量不相同,等质量的二者的混合物,若二者的含量不同,完全燃烧生成的二氧化碳的物质的量不同,
B
项错误;氮元素含有同位素,
C
项正确;
Cl
-
的电子层结构中,最外层电子数应为
8
电子稳定结构,
D
项错误。
2
.
2011
年
3
月
11
日,日本宫城发生
9.0
级大地震并引起海啸和核泄漏,当地环境受到严重污染。下列有关说法正确的是
(
)
A
.海啸水退后可用漂白粉、
84
消毒液、
ClO
2
的稀溶液进行消毒
B
.海啸使水源发生污染,可用明矾进行消毒和净化
C
.核反应属于化学反应
D
.生物质能的缺点是严重污染环境
【
解析
】 A
明矾只有净水作用而没有杀菌和消毒的作用,
B
项错误。
1.
由两种原子组成的纯净物 ( )
A.
一定是化合物
B.
可能是化合物或单质
C.
一定是单质
D.
一定是同素异形体
解析
本题主要考查物质的组成与分类中的有关概
念,如元素与同位素、同素异形体、混合物与纯
净物、单质与化合物等。由元素与同位素的概念
可知,题目所给两种原子可为同一元素(如:
H
与
D
),也可为不同元素(如:
H
与
Cl
)。所以由两
种原子组成的纯净物可能是单质(如:
HD
),也
可能是化合物(如:
HCl
)
。
B
2.
下列化学用语正确的是 ( )
A.Na
2
O
2
中氧元素的化合价为
-2
B.
乙醇的分子式:
CH
3
CH
2
OH
C.S
的结构示意图:
D.
甲烷的结构式:
C
H
H
H
H
D
解析
Na
2
O
2
中氧元素显
-1
价;乙醇的分子式为
C
2
H
6
O
,结构简式为
CH
3
CH
2
OH
;
S
的原子结构示意图为 ,因此
A
、
B
、
C
错误,
D
正确。
3.
下列说法正确的是 ( )
A.
直径介于
1~100 nm
之间的微粒称为胶体
B.
电泳现象可以证明胶体属于电解质
C.
将饱和
FeCl
3
溶液滴入沸水中可以制得胶体
D.
胶体粒子很小,可以透过半透膜
解析
胶体是一种分散系,其中分散质粒子的直径介于
1
~
100 nm
之间,这是胶体的本质特征;胶体粒子很小,其表面积很大,能吸附溶液中的离子而带上电荷,因而具有
“
电泳
”
这一性质,由此可知它不属于电解质溶液;
Fe(OH)
3
胶体的制备是
FeCl
3
在沸水中发生水解而得;胶粒很小,能透过滤纸,但不能透过半透膜。
C
4.
我国科学家在世界上第一次为一种名为“钴酞菁”的
分子(直径为
1.3×10
-9
m
)恢复了磁性。“钴酞菁”
分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是 ( )
A.
在水中所形成的分散系属悬浊液
B.“
钴酞菁”分子既能透过滤纸,也能透过半透膜
C.
分子直径比
Na
+
小
D.
在水中形成的分散系能产生丁达尔效应
解析
1 nm=1×10
-9
m
。分散质直径在
1
~
100 nm
之间的分散系是胶体,胶体能产生丁达尔效应。
D
5.
物质发生化学变化时:①电子总数 ②原子总数
③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物
质的总能量 ⑦原子种类,反应前后肯定不发生变
化的是 ( )
A.①②③⑤ B.①②⑤⑦
C.②⑤⑥ D.①④⑤⑥
解析
化学变化的本质是原子之间的重新组合过
程,遵循质量守恒定律,电子总数、原子总数和
原子种类均不会发生变化。
B
6.
化学概念在逻辑上存在下图所示关系:对下列概念的说法正确的是 ( )
A.
纯净物(
B
)与混合物(
A
)属于包含关系
B.
化合物(
B
)与氧化物(
A
)属于包含关系
C.
单质与化合物属于交叉关系
D.
氧化反应与化合反应属于并列关系
解析
据图示内容,物质分类的三个关系可判断:纯净物与混合物属并列关系,化合物与氧化物属包含关系,单质与化合物属并列关系,氧化反应与化合反应属交叉关系。
B
7.
下列一定是纯净物的是 ( )
①石墨和金刚石混合 ②一瓶组成为
C
4
H
10
的气体
③含
Fe
元素的质量分数为
70%
的铁红 ④不含杂质
的盐酸 ⑤纯净的淀粉
A.①④⑤ B.②⑤ C.③ D.④⑤
解析
:
①中石墨和金刚石都是由碳原子构成,但是为两种物质;②中分子式为
C
4
H
10
的烃有多种同分异构体;③可以计算出
Fe
与
O
的原子个数比恰好为
2∶3
,故为纯净的
Fe
2
O
3
;④中盐酸是
HCl
气体的水溶液,故一定为混合物;⑤高分子化合物,如蛋白质、合成橡胶、纤维素、淀粉等都是混合物。
C
8.
下列叙述正确的是 ( )
A.
酸酐不一定是酸性氧化物
B.
某种口服液含有丰富的氮、磷、锌等微量元素
C.
硬脂酸钠属于高分子化合物
D.
二氧化碳由一个碳原子和两个氧原子组成
解析
A
项中乙酸酐就不是酸性氧化物;
B
项中的氮
不是人体内的微量元素;
C
项中硬脂酸钠的相对分
子质量较小,不属于高分子化合物;
D
项中
CO
2
是由
CO
2
分子构成。
A
9.
下列现象不是因发生化学变化而产生的是 ( )
A.
皮肤不慎沾有浓硝酸呈黄色
B.
浓硝酸“发烟”
C.
盛在无色试剂瓶中的浓硝酸呈黄色
D.FeSO
4
溶液久置于空气中
,
溶液呈黄色
解析
浓硝酸与皮肤中的蛋白质发生颜色变化;浓
硝酸不稳定,分解出
NO
2
而呈黄色;
FeSO
4
与
O
2
发生
氧化还原反应,生成
Fe
3+
呈黄色;浓硝酸挥发出
HNO
3
气体遇水蒸气成雾状。
B
10.
下列说法正确的是 ( )
A.
可用丁达尔现象区分溶液与胶体
B.
生石灰与水混合的过程只发生物理变化
C.O
3
是由
3
个氧原子构成的化合物
D.CuSO
4
·5H
2
O
是一种混合物
解析
生石灰与水混合的过程发生了
CaO+H
2
O
Ca(OH)
2
的化学反应,
B
错;
O
3
为单质,
C
错;
CuSO
4
·
5H
2
O
是一种化合物。
A
11.
下列家庭小实验中不涉及化学变化的是 ( )
A.
用熟苹果催熟青香蕉
B.
用少量食醋除去水壶中的水垢
C.
用糯米、酒曲和水制成甜酒酿
D.
用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐
解析
A
项熟苹果释放
CH
2
CH
2
,
CH
2
CH
2
对青香
蕉的催熟是化学变化
;B
项食醋中
CH
3
COOH
与水垢
发生化学反应;
C
项糯米制酒是化学变化;
D
项鸡
蛋壳膜属于半透膜,除去食盐是物理变化渗析。
·
·
·
D
12.
某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。上述说法正确的是 ( )
A.①②③④ B.①②⑤⑥
C.③⑤⑥⑦ D.①③④⑦
解析
:
水煤气是不可再生能源
;
盐酸是
HCl
的水溶液,食醋是醋酸的水溶液,因此二者都是混合物;纯碱是
Na
2
CO
3
,是一种盐而不是碱。因此②⑤⑥错。
D
13.
对于数以千万计的化学物质和为数更多的化学反 应,分类法的作用几乎是无可替代的。
(
1
)现有下列六种物质:
SO
2
、
SiO
2
、
CaO
、
MgO
、
Fe
2
O
3
、
Na
2
O
2
,
按照不同的分类标准,它们中有一种物质与其他五种有明显的不同,请找出这种物质,并写出分类的依据(至少要写出两 种分类方法)。
①
;
②
。
(
2
)从反应中有无离子参加,可以将化学反应分为离子反应和非离子反应。
Na
2
O
2
与水反应的离子 方程式是
。
从反应中
,可以将化学反应分为氧化还原反应和非氧化还原反应,从上述物质中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式:
、
。
(
3
)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示二者之间的关系。
答案
(
1
)①
SO
2
,
常温常压下是气体,其余为固体
②
Na
2
O
2
,
是过氧化物,其余为酸性氧化物或碱性氧化物
(
2
)
2Na
2
O
2
+2H
2
O 4Na
+
+4OH
-
+O
2
↑
有无电
子转移
CaO+SiO
2
CaSiO
3
(
或
MgO+SO
2
MgSO
3
等其他合理答案
) Na
2
O
2
+SO
2
Na
2
SO
4
(
3
) (意思正确、能表示二者的交叉关系即可)
高温
△
14.
对牙膏的探究要用到许多化学知识。
(
1
)下表列出了三种牙膏中的摩擦剂,请在表中
填写三种摩擦剂所属的物质类别。
牙膏
两面针
儿童牙膏
珍珠王
防臭牙膏
中华透
明牙膏
摩擦剂
氢氧化铝
碳酸钙
二氧化硅
摩擦剂的物质类别(指酸、碱、盐、氧化物)
(
2
)根据你的推测,牙膏摩擦剂的溶解性是
(填
“易溶”或“难溶”)。
(
3
)牙膏中的摩擦剂碳酸钙可以用石灰石来制备。
某学生设计了一种实验室制备碳酸钙的实验方案,
其流程图为:
请写出上述方案中有关反应的化学方程式,并注明反应类型:
①
;
石灰石
生石灰
石灰水
碳酸钙
①
高温
②
加水
③
加
Na
2
CO
3
溶液
②
; ③
。
(
4
)请你仍用石灰石作原料(其他试剂自选),设
计实验室制备碳酸钙的另一种实验方案,依照
(
3
) 所示,将你的实验方案用流程图表示出来:
你设计的方案的优点为:
。
(
5
)检验牙膏中是否含有碳酸钙的实验方法是:
。
解析
本题结合日常生活实际,从物质的类别出发来研究各类物质的相互关系。
石灰石
(
1
)中氢氧化铝属于碱(严格讲氢氧化铝为两性氢氧化物),碳酸钙属于盐,二氧化硅属于氧化物;
(
2
)摩擦剂的作用是去除牙齿上残留的食物,联系日常生活中用砂纸来摩擦金属以除去金属表面的锈迹可知摩擦剂应为坚硬难溶的物质;
(
3
)中所发生的反应依次为:①
CaCO
3
CaO+CO
2
↑
,分解反应;②
CaO+H
2
O=Ca(OH)
2
,化合反应;③
Ca(OH)
2
+Na
2
CO
3
=CaCO
3
↓+2NaOH
,复分解反应;
(
4
)题是从碳酸钙的其他性质去认识物质的转化关系,如
高温
石灰石
氯化钙
加盐酸
加
Na
2
CO
3
溶液
碳酸钙
答案
(
1
)碱 盐 氧化物
(
2
)难溶
(
3
)①
CaCO
3
CaO+CO
2
↑
分解反应
②
CaO+H
2
O Ca
(
OH
)
2
化合反应
③
Ca
(
OH
)
2
+Na
2
CO
3
CaCO
3
↓+2NaOH
复分解反应
这种制法的优点是反应条件简单、易于操作(实验室中)、所得碳酸钙的纯度高等;
(
5
)检验碳酸钙的存在,可利用碳酸钙与酸反应产生气体这一现象来进行。
高温
(
4
)
反应条件简单、易于操作(实验室中)、所得碳酸钙的纯度高等
(
5
)取少量样品,加入稀
HCl
,观察有无使澄清石灰水变浑浊的气体产生,若有,则含
CaCO
3
,若无,则不含
石灰石
氯化钙
加盐酸
加
Na
2
CO
3
溶液
碳酸钙
15.
固体物质
A
的化学式为
NH
5
,它的所有原子的最外层都符合相应的稀有气体原子的最外层结构。 该物质稍微加热就分解成两种气体。
(
1
)
A
物质中的氢元素的化合价有:
、
。
(
2
)
A
是
(填“离子” 或“共价”)化合物。
(
3
)
A
分解得到的两种气体的电子式是
、
。
(
4
)
A
溶于水后呈
(填“酸性”、“碱性” 或“中性”)。
(
5
)
A
加热分解
(填“是”或“不是”)氧化还
原反应。若是,书写反应的化学方程式
。
解析
抓住化学式
NH
5
分析,若氢元素全显
+1
价,则氮元素应显
-5
价,由于氮的最低价态为
-3
价,不能成立。根据氮的最低价态
-3
价,则其中一个氢呈
-1
价,其余四个氢呈
+1
价,可满足题意。
A
的化学式可写为
NH
4
H
,该物质加热分解可分解为
NH
3
和
H
2
;溶于水可生成氨水并放出
H
2
。
答案
(
1
)
+1 -1
(
2
)离子
(
3
)
N H H H
(
4
)碱性
(
5
)是
NH
4
H NH
3
↑+H
2
↑
△
·
·
H
H
·
·
·
·
· ·
· ·
16.
比较法是化学中研究物质性质的基本方法之一, 请运用比较法解答下题。
Na
2
O
2
几乎可与所有的常见气态非金属氧化物反 应。如
2Na
2
O
2
+2CO
2
=
2Na
2
CO
3
+O
2
,Na
2
O
2
+CO
=
Na
2
CO
3
。
(
1
)试分别写出
Na
2
O
2
与
SO
2
、
SO
3
反应的化学方
程式:
。
(
2
)通过比较可知,当非金属元素处于
价
时,其氧化物与
Na
2
O
2
反应有
O
2
生成。
(
3
)依上述规律,写出
Na
2
O
2
分别与
N
2
O
5
、
Mn
2
O
7
反应的化学方程式
,
。
解析
结合
Na
2
O
2
与
CO
、
CO
2
反应产物的分析,运用比较的方法,将题中信息(与高价态氧化物反应有氧气产生,与低价态氧化物反应没有氧气产生,只生成该非金属的高价态钠盐)整合迁移应用即可。
答案
(
1
)
SO
2
+Na
2
O
2
Na
2
SO
4
,
2Na
2
O
2
+2SO
3
2Na
2
SO
4
+O
2
(
2
)最高
(
3
)
2Na
2
O
2
+2N
2
O
5
4NaNO
3
+O
2
↑
2Mn
2
O
7
+2Na
2
O
2
4NaMnO
4
+O
2
↑