- 452.00 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2016-2017 学年黑龙江大庆铁人中学高二(上)开学化学试卷
一、选择题(本题共 15 小题.每小题 3 分,共 45 分.)
1.已知“凡气体分子总数增多的反应一定是熵增大的反应”.根据所学知识判断,
下列反应中,在所有温度下都不自发进行的( )
A.2O3(g)═3O2(g)△H<0 B.2CO(g)═2C(s)+O2(g)△H>0
C.N2(g)+3H2(g)═2NH3(g)△H<0 D.CaCO3(s)═CaO(s)+CO2(g)△
H>0
2.已知:①H2O(g)═H2O(l)△H1=﹣Q1 kJ•mol﹣1
②CH3OH(g)═CH3OH(l)△H2=﹣Q2 kJ•mol﹣1
③2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H3=﹣Q3 kJ•mol﹣1(Q1、Q2、
Q3 均大于 0)
若要使 32g 液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
A.Q1+Q2+Q3 B.0.5Q3﹣Q2+2Q1 C.0.5Q3+Q2﹣2Q1 D.0.5(Q1+Q2+Q3)
3.下列用水就能鉴别的一组物质是( )
A.苯、己烷、四氯化碳 B.苯、乙醇、四氯化碳
C.硝基苯、乙醇、四氯化碳 D.硝基苯、乙醇、乙酸
4.体积不变的密闭容器中充入 H2 和 I2,发生反应 H2(g)+I2(g) 2HI(g);
(正反应为吸热反应),当达到平衡后,t0 时升高温度,下列说法正确的是( )
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2 转化率增大,HI 平衡浓度变小
D.
改变条件前后,速率图象为(如图)
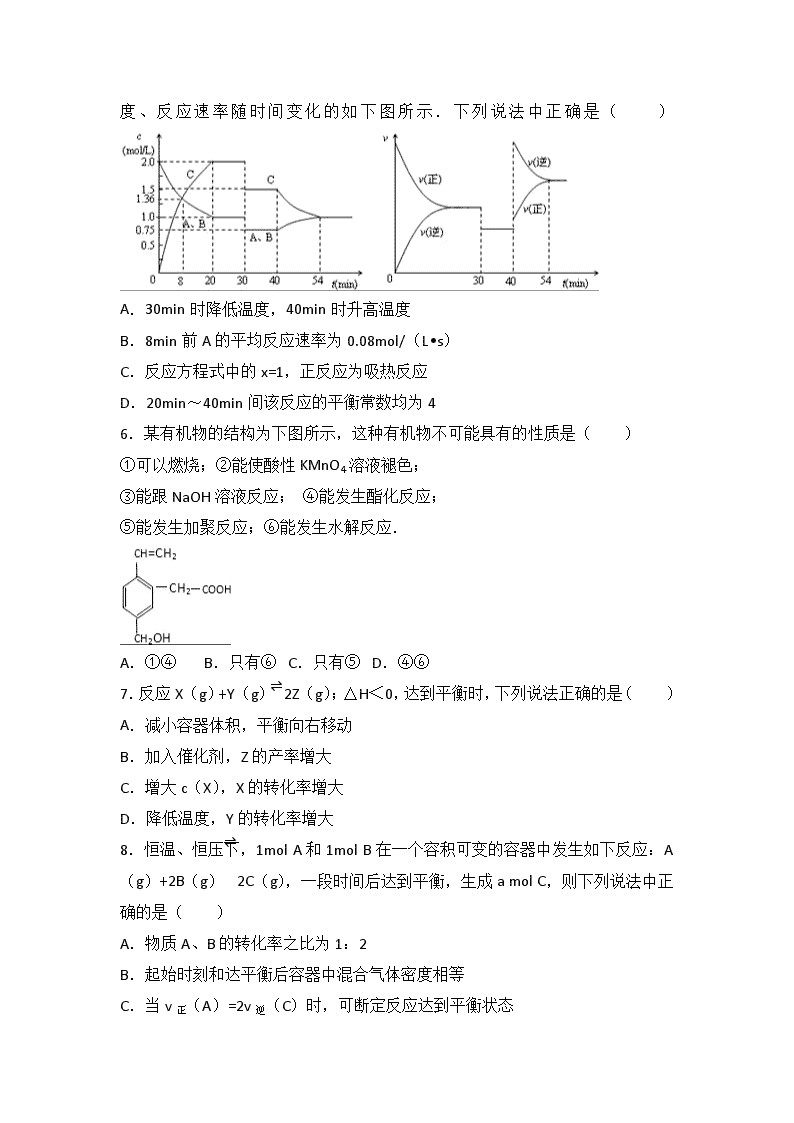
5.某密闭容器中充入等物质的量的气体 A 和 B,一定温度下发生反应 A(g)+xB
(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓
度 、 反 应 速 率 随 时 间 变 化 的 如 下 图 所 示 . 下 列 说 法 中 正 确 是 ( )
A.30min 时降低温度,40min 时升高温度
B.8min 前 A 的平均反应速率为 0.08mol/(L•s)
C.反应方程式中的 x=1,正反应为吸热反应
D.20min~40min 间该反应的平衡常数均为 4
6.某有机物的结构为下图所示,这种有机物不可能具有的性质是( )
①可以燃烧;②能使酸性 KMnO4 溶液褪色;
③能跟 NaOH 溶液反应; ④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应.
A.①④ B.只有⑥ C.只有⑤ D.④⑥
7.反应 X(g)+Y(g)⇌2Z(g);△H<0,达到平衡时,下列说法正确的是( )
A.减小容器体积,平衡向右移动
B.加入催化剂,Z 的产率增大
C.增大 c(X),X 的转化率增大
D.降低温度,Y 的转化率增大
8.恒温、恒压下,1mol A 和 1mol B 在一个容积可变的容器中发生如下反应:A
(g)+2B(g)⇌2C(g),一段时间后达到平衡,生成 a mol C,则下列说法中正
确的是( )
A.物质 A、B 的转化率之比为 1:2
B.起始时刻和达平衡后容器中混合气体密度相等
C.当 v 正(A)=2v 逆(C)时,可断定反应达到平衡状态
D.若起始时放入 3 mol A 和 3 mol B,则达平衡时生成 3a mol C
9.向某密闭容器中加入 0.3mol A、0.1mol C 和一定量的 B 三种气体.一定条件
下发生反应,各物质浓度随时间变化如甲图所示[t0~t1 阶段 c(B)未画出].附
图乙为 t2 时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段
都各改变一种不同的条件并且所用条件均不同.已知,t3~t4 阶段为使用催化
剂.下列说法正确的是( )
A.若 t1=15s,生成物 C 在 t0~t1 时间段的平均反应速率为 0.004mol•L﹣1•min﹣1
B.t4~t5 阶段改变的条件为降低反应温度
C.B 的起始物质的量为 0.02mol
D.t5~t6 阶段容器内 A 的物质的量减少 0.03mol,而此过程中容器与外界的热交
换总量为 akJ,该反应的热化学方程式为 3A(g) B(g)+2C(g);△
H=+100akJ•mol﹣1
10.T℃时,某一气态平衡体系中含有 X(g)、Y(g)、Z(g)、W(g)四种物质,
此温度下发生反应的平衡常数表达式为:K= ,有关该平衡体系的
说法正确的是( )
A.升高温度,平衡常数 K 增大
B.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应
C.增大压强,W(g)体积分数增加
D.增大 X(g)浓度,平衡向正反应方向移动
11.现有下列四个图象:
下列反应中全部符合上述图象的反应是( )
A.N2(g)+3H2(g)⇌2NH3(g)△H1<0
B.2SO3(g)⇌2SO2(g)+O2(g)△H2>0
C.4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H3<0
D.H2(g)+CO(g)⇌C(s)+H2O(g)△H4>0
12.下列说法中有明显错误的是( )
A.对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分
子数增加,因而反应速率增大
B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C.活化分子之间发生的碰撞一定为有效碰撞
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增
大化学反应的速率
13.已知 NO2 和 N2O4 可以相互转化:2NO2(g)⇌N2O4(g)△H<0.现将一定
量 NO2 和 N2O4 的混合气体通入体积为 1L 的恒温密闭容器中,反应物浓度随时间
变化关系如图.下列说法错误的是( )
A.图中共有两条曲线 X 和 Y,其中曲线 X 表示 NO2 浓度随时间的变化
B.a、b、c、d 四个点中,表示化学反应处于平衡状态的点是 b 和 d
C.反应进行至 25min 时,曲线发生变化的原因是加入 0.4mol N2O4
D.若要达到与 d 相同的状态,在 25min 时还可以采取的措施是适当缩小容器体
积
14.某温度下,体积一定的密闭容器中进行如下可逆反应 X(g)+Y(g)⇌Z(g)
+W(s)△H>0.下列叙述中,正确的是( )
A.加入少量 W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.改变条件,又达新平衡,此时上述反应的平衡常数 K 值一定增大
15.在温度、容积相同的 3 个密闭容器中,按不同方式投入反应物,保持恒温、
恒容,测得反应达到平衡时的有关数据如下:(已知 N2(g)+3H2(g)⇌2NH3
(g)△H=﹣92.4kJ•mol﹣1)
容器 甲 乙 丙
反应物的投入量 1molN2、3molH2 2molNH3 4molNH3
NH3 的浓度(mol•L﹣1) c1 c2 c3
反应的能量变化 放出 akJ 吸收 bkJ 吸收 ckJ
体系的压强(Pa) p1 p2 p3
反应物的转化率 a1 a2 a3
下列说法正确的是( )
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.α1+α3=1
二、非选择题(本题包括 5 小题,共 55 分.)
16.高炉炼铁过程中发生的主要反应为 Fe2O3(s)+CO(g)= Fe(s)+CO2
(g)已知该反应在不同温度下的平衡常数如下:
温度/℃ 1000 1150 1300
平衡常数 4.0 3.7 3.5
请回答下列问题:
(1)该反应的平衡常数表达式 K= ,△H 0(填“>”、“<”或“=”);
(2)在一个容积为 10L 的密闭容器中,1000℃时加入 Fe、Fe2O3、CO、CO2 各
1.0mol,反应经过 10min 后达到平衡.求该时间范围内反应的平均反应速率 v
(C02)= 、CO 的平衡转化率= :
(3)欲提高(2)中 CO 的平衡转化率,可采取的措施是 .
A.减少 Fe 的量 B.增加 Fe203 的量 C.移出部分 C02
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂.
17.有四种化合物 W、X、Y、Z,它们都是由短周期元素 A、B、C、D、E 中的两
种元素组成的.已知:
(a)A、B、C、D、E 五种元素的原子序数依次增大,且 A、D 同主族,C、E 同
主族,B、C 同周期.
(b)W 由 B、C 组成,分子中原子个数比为 B:C=1:2,固体易升华.
(c)X 由 A、C 组成,分子中原子个数比为 A:C=1:1.
(d)Y 由 C、D 形成的离子化合物,且 Y 中相应元素的微粒之比为:C:D=1:
1.
(e)Z 是由 D、E 形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、
阳离子数之比为 1:2.
试回答下列各小题:
(1)各元素符号:A B C D E
(2)W 的电子式: .
(3)X 的结构式: .
(4)Y 的电子式: .
(5)Z 的化学式: .
(6)写出 Y 与水反应的化学方程式: .
18.在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)⇌CO2
(g)+H2(g),其化学平衡常数 K 和温度 t 的关系如表:
t℃ 700 800 830 1000 1200
K 1.7 1.1 1.0 0.6 0.4
回答下列问题:
(1)该反应的化学平衡常数表达式为 K= ,该反应为 反应(填吸热或放
热).
若改变条件使平衡向正反应方向移动,则平衡常数 (填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是 .
(a)容器中压强不变 (b)混合气体中 c(CO)不变
(c)v 逆(H2)=v 正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的 CO (g) 和 H2O (g) 分别通入到体积为 2L 的恒容密闭容
器中,进行反应 CO (g)+H2O (g)⇌CO2(g)+H2(g),得到如下三组数据:
起始量/mol 平衡量/mol实验组 温度/℃
H2O CO CO2 CO
达到平衡所需时间
/min
A 650 2 4 1.6 2.4 5
B 900 1 2 0.4 1.6 3
C 900 a b c d t
①实验 A 中以 υ(H2) 表示的反应速率为 .
②通过计算可知,CO 的转化率实验 A 实验 B(填“大于”、“等于”或“小于”),
该反应的正反应为 (填“吸”或“放”)热反应.
③若实验 C 要达到与实验 B 相同的平衡状态,则 a、b 应满足的关系是 (用
含 a、b 的数学式表示).
19.甲醇被称为 2l 世纪的新型燃料,工业上通过下列反应①和②,用 CH4 和 H2O
为原料来制备甲醇.
①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1
②CO(g)+2H2(g)⇌CH3OH(g)△H2
将 0.20mol CH4(g)和 0.30mol H2O(g)通入容积为 10L 的密闭容器中,在一定
条件下发生反应①,达到平衡时,CH4 的转化率与温度、压强的关系如图.
(1)温度不变,缩小体积,增大压强,①的反应速率 (填“增大”、“减小”
或“不变”),平衡向 方向移动.
(2)温度升高,反应①的△H1 0(填“<”、“=”或“>”),其平衡常数表达式
为 K= ,100℃时的平衡常数值是 .
(3)在压强为 0.1MPa 条件下,将 a mol CO 与 3a mol H2 的混合气体在催化剂作
用下进行反应②生成甲醇.为了寻找合成甲醇的温度和压强的适宜条件,某同学
设计了三组实验,部分实验条件已经填在下面实验设计表中.请在下表空格中填
入剩余的实验条件数据.
实验编号 T(℃) n (CO)/n(H2) P(MPa)
I 150 1/3 0.1
II 5
III 350 5
20.在某个容积为 2L 的密闭容器内,在 T℃时按图 1 所示发生反应:
mA(g)+nB(g)⇌pD(g)+qE(s)H<0(m、n、p、q 为最简比例的整
数).
(1)根据图 1 所示,反应开始至达到平衡时,用 D 表示该反应速率为 mol/
(L•min);
方程式中 m:n:p:q=
(2)该反应的化学平衡常数 K 为 (保留至一位小数);
(3)下列措施能增大 B 的转化率的是
A.升高温度 B.保持体积不变通入 1molB
C.保持体积不变移出部分物质 D(g) D.将容器的容积增大为原来的 2
倍
E.保持体积不变通入 1mol A
(4)能判断该反应已经达到化学平衡状态的是
A.恒容恒温时容器中气体压强保持不变 B.混合气体中 D 浓度不变
C.v(A)正=v(A)逆 D.恒容时容器中气体密度
不变
(5)反应达到平衡后,第 7min 时,改变条件,在第 9min 达到新的平衡,在图
2 上作出第 7min 至第 15min
下列情况下,D 浓度变化图象
①若降低温度且平衡时 D 物质的量变化了 0.4mol (用虚线)
②若将容器的容积压缩为原来一半(用实线)
2016-2017 学年黑龙江大庆铁人中学高二(上)开学化学
试卷
参考答案与试题解析
一、选择题(本题共 15 小题.每小题 3 分,共 45 分.)
1.已知“凡气体分子总数增多的反应一定是熵增大的反应”.根据所学知识判断,
下列反应中,在所有温度下都不自发进行的( )
A.2O3(g)═3O2(g)△H<0 B.2CO(g)═2C(s)+O2(g)△H>0
C.N2(g)+3H2(g)═2NH3(g)△H<0 D.CaCO3(s)═CaO(s)+CO2(g)△
H>0
【考点】反应热和焓变.
【分析】反应能否自发进行取决于△G=△H﹣T•△S,当△G=△H﹣T•△S<0 时,
反应可自发进行,否则不能.
【解答】解:A.△H<0,△S>0,根据△G=△H﹣T•△S 可知,一般温度下都
能满足△H﹣T•△S<0,反应可自发进行,故 A 不选;
B.△H>0,△S<0,一般情况下都满足△G=△H﹣T•△S>0,反应不能自发进
行,故 B 选;
C.△H<0,△S<0,在较高温度下,可满足△H﹣T•△S<0,反应可自发进行,
故 C 不选;
D.△H>0,△S>0,在较高温度下,可满足△H﹣T•△S<0,反应可自发进行,
故 D 不选.
故选:B.
2.已知:①H2O(g)═H2O(l)△H1=﹣Q1 kJ•mol﹣1
②CH3OH(g)═CH3OH(l)△H2=﹣Q2 kJ•mol﹣1
③2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H3=﹣Q3 kJ•mol﹣1(Q1、Q2、
Q3 均大于 0)
若要使 32g 液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
A.Q1+Q2+Q3 B.0.5Q3﹣Q2+2Q1 C.0.5Q3+Q2﹣2Q1 D.0.5(Q1+Q2+Q3)
【考点】有关反应热的计算.
【分析】根据盖斯定律,由已知热化学方程式乘以适当系数后进行加减构造目标
热化学方程式,反应热也乘以相应的系数作相应的加减,据此计算判断.
【解答】解:已知:①H2O(g)═H2O(l)△H=﹣Q1 kJ/mol
②CH3OH(g)═CH3OH(l)△H2=﹣Q2 kJ/mol
③2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H3=﹣Q3 kJ/mol
由盖斯定律可知,③﹣②×2+①×4 得:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O
(l)△H=△H3﹣2△H2﹣4△H3=﹣(Q3﹣2Q2+4Q1)kJ/mol
32g 液态甲醇物质的量为 =1mol,完全燃烧放出热量为
×(Q3﹣2Q2+4Q1)kJ/mol=(0.5Q3﹣Q2+2Q1)kJ.
故选 B.
3.下列用水就能鉴别的一组物质是( )
A.苯、己烷、四氯化碳 B.苯、乙醇、四氯化碳
C.硝基苯、乙醇、四氯化碳 D.硝基苯、乙醇、乙酸
【考点】有机物的鉴别.
【分析】水就能鉴别的一组物质,与水的溶解性不同、与水的密度不同,产生不
同现象则可以鉴别,以此来解答.
【解答】解:A.苯、己烷、四氯化碳都不溶于水,但苯和己烷的密度都小于水,
无法鉴别,故 A 错误;
B.苯和四氯化碳都不溶于水,但苯的密度比水小,四氯化碳的密度比水大,乙
醇与水混溶,可鉴别,故 B 正确;
C.硝基苯、四氯化碳都不溶于水,且密度比水大,不能鉴别,故 C 错误;
D.乙醇、乙酸都溶于水,不能鉴别,故 D 错误.
故选 B.
4.体积不变的密闭容器中充入 H2 和 I2,发生反应 H2(g)+I2(g) 2HI(g);
(正反应为吸热反应),当达到平衡后,t0 时升高温度,下列说法正确的是( )
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2 转化率增大,HI 平衡浓度变小
D.
改变条件前后,速率图象为(如图)
【考点】化学平衡的影响因素.
【分析】向一体积不变的密闭容器中充入H2 和 I2,发生反应 H2(g)+I2(g)⇌2HI
(g)△H<0,当达到平衡后,t0 时刻升高温度,升高温度正、逆反应速率均增
大,但是逆反应速率大于正反应速率,反应逆向移动,以此来解答.
【解答】解:向一体积不变的密闭容器中充入H2 和 I2,发生反应 H2(g)+I2(g)⇌
2HI(g)△H<0,当达到平衡后,t1 时刻改变的条件为升高温度,升高温度正、
逆反应速率均增大,但是逆反应速率大于正反应速率,反应逆向移动,
A.平衡向逆反应移动,I2 的浓度增大,容器内气体的颜色变深,混合气体的总
质量不变,物质的量不变,故混合气体的平均相对分子质量不变,故 A 错误;
B.升高温度正、逆反应速率均增大,但是逆反应速率大于正反应速率,平衡向
逆反应移动,质量、体积不不变,则密度不变,故 B 错误;
C.平衡向逆反应移动,H2(g)的转化率降低,HI 的平衡浓度减小,故 C 错误;
D.升高温度正、逆反应速率均增大,逆反应速率大于正反应速率,反应逆向移
动,而图象中符合,故 D 正确;
故选 D.
5.某密闭容器中充入等物质的量的气体 A 和 B,一定温度下发生反应 A(g)+xB
(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质
的浓度、反应速率随时间变化的如下图所示.下列说法中正确是( )
A.30min 时降低温度,40min 时升高温度
B.8min 前 A 的平均反应速率为 0.08mol/(L•s)
C.反应方程式中的 x=1,正反应为吸热反应
D.20min~40min 间该反应的平衡常数均为 4
【考点】反应速率的定量表示方法;化学平衡常数的含义;化学平衡的影响因
素.
【分析】A、由图象可知,30min 时只有反应速率降低了,反应物与生成物的浓
度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强;
B、反应从开始到 8min 内 A 浓度减少了 0.64mol/L,故 A 的反应速率为 0.08 mol/
(L•min);
C、由开始到达到平衡,A、B 的浓度减少的量相同,由此可知 X=1.则增大压强
平衡不移动,40min 时,正逆反应速率都增大,且逆反应速率大于正反应速率,
平衡向逆向进行,应是升高温度,则正反应为放热反应.
D、20min~40min 间正逆反应速率相等,各物质的物质的量都不变,反应处于平
衡状态,30min~40min,速率降低,为降低压强,平衡常数不变,20min~40min
平衡常数相同,根据 20min 时计算平衡常数.
【解答】解:A.由图象可知,30min 时只有反应速率降低了,反应物与生成物
的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,
40min 时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进
行,应是升高温度,则正反应为放热反应,故 A 错误;
B.反应从开始到 8min 内 A 浓度减少了 0.64mol/L,故 A 的反应速率为 0.08 mol/
(L•min),故 B 错误;
C.由开始到达到平衡,A、B 的浓度减少的量相同,由此可知 X=1,则增大压强
平衡不移动,40min 时,正逆反应速率都增大,且逆反应速率大于正反应速率,
平衡向逆向进行,应是升高温度,则正反应为放热反应,故 C 错误;
D.20min~40min 间正逆反应速率相等,各物质的物质的量都不变,反应处于平
衡状态,30min~40min,速率降低,为降低压强,平衡常数不变,20min~40min
平衡常数相同,由图可知 20min 时 c(A)=c(B)=1mol/L,c(C)=2mol/L,所
以平衡常数 k= =4,故 D 正确.
故选:D.
6.某有机物的结构为下图所示,这种有机物不可能具有的性质是( )
①可以燃烧;②能使酸性 KMnO4 溶液褪色;
③能跟 NaOH 溶液反应; ④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应.
A.①④ B.只有⑥ C.只有⑤ D.④⑥
【考点】有机物分子中的官能团及其结构.
【分析】①有机物大多易燃烧;②含有碳碳双键的物质能被酸性 KMnO4 溶液氧
化;③羧酸可以和氢氧化钠反应;④羧酸可以和醇之间发生酯化反应;⑤含有碳
碳双键的物质可以发生加聚反应;⑥酯基可以水解.
【解答】解:①根据有机物大多易燃烧的性质推断该有机物可以燃烧,故①正确;
②该有机物含有碳碳双键,能被酸性 KMnO4 溶液氧化,使酸性 KMnO4 溶液褪色,
故②正确;
③该有机物含有羧基,可以和氢氧化钠反应,故③正确;
④该有机物含有羧基,具有羧酸的性质,可以和醇之间发生酯化反应,故④正确;
⑤该有机物含有碳碳双键,可以发生加聚反应,故⑤正确;
⑥该有机物没有可以水解的官能团,不能水解,故⑥错误.
故选 B.
7.反应 X(g)+Y(g)⇌2Z(g);△H<0,达到平衡时,下列说法正确的是( )
A.减小容器体积,平衡向右移动
B.加入催化剂,Z 的产率增大
C.增大 c(X),X 的转化率增大
D.降低温度,Y 的转化率增大
【考点】化学平衡的影响因素.
【分析】A、反应前后气体体积不变,减小容器体积压强增大,平衡不变;
B、催化剂改变反应速率,不改变化学平衡;
C、两种反应物,增加一种物质的量增大另一种物质转化率,本身转化率减小;
D、反应是放热反应,降温平衡正向进行;
【解答】解:A、反应前后气体体积不变,减小容器体积压强增大,平衡不变,
故 A 错误;
B、催化剂改变反应速率,不改变化学平衡,Z 的产率不变,故 B 错误;
C、两种反应物,增加一种物质的量增大另一种物质转化率,本身转化率减小,
增大 c(X),X 的转化率减小,故 C 错误;
D、反应是放热反应,降温平衡正向进行,Y 的转化率增大,故 D 正确;
故选 D.
8.恒温、恒压下,1mol A 和 1mol B 在一个容积可变的容器中发生如下反应:A
(g)+2B(g)⇌2C(g),一段时间后达到平衡,生成 a mol C,则下列说法中正
确的是( )
A.物质 A、B 的转化率之比为 1:2
B.起始时刻和达平衡后容器中混合气体密度相等
C.当 v 正(A)=2v 逆(C)时,可断定反应达到平衡状态
D.若起始时放入 3 mol A 和 3 mol B,则达平衡时生成 3a mol C
【考点】化学平衡的计算.
【分析】A.A、B 的起始量都是 1mol,所以 A、B 的转化率之比等于参加反应的
物质的物质的量之比;
B.起始时刻和达平衡后容器体积不等,则密度不等;
C.反应达平衡时,正逆反应速率相等,根据速率之比等于化学计量数之比判断;
D.在恒压下,放入 3molA 和 3nmolB,与起始时 1molA 和 nmolB 配比数相等,
为等效平衡.
【解答】解:A.A、B 的起始量都是 1mol,所以 A、B 的转化率之比等于参加反
应的物质的物质的量之比,根据反应方程式可知,物质 A、B 的转化率之比一定
是 1:2,故 A 正确;
B.在恒压下,随着反应的进行,气体的物质的量逐渐减小,则容器的体积逐渐
减小,起始时刻和达平衡后容器体积不等,则密度不等,故 B 错误;
C.当 2v 正(A)=v 逆(C)时,正逆反应速率相等,反应达到平衡状态,故 C 错
误;
D.在恒压下,放入 3molA 和 3nmolB,与起始时 1molA 和 nmolB 配比数相等,
为等效平衡,则达平衡时生成 3amolC,故 D 正确.
故选 AD.
9.向某密闭容器中加入 0.3mol A、0.1mol C 和一定量的 B 三种气体.一定条件
下发生反应,各物质浓度随时间变化如甲图所示[t0~t1 阶段 c(B)未画出].附
图乙为 t2 时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段
都各改变一种不同的条件并且所用条件均不同.已知,t3~t4 阶段为使用催化
剂.下列说法正确的是( )
A.若 t1=15s,生成物 C 在 t0~t1 时间段的平均反应速率为 0.004mol•L﹣1•min﹣1
B.t4~t5 阶段改变的条件为降低反应温度
C.B 的起始物质的量为 0.02mol
D.t5~t6 阶段容器内 A 的物质的量减少 0.03mol,而此过程中容器与外界的热交
换总量为 akJ,该反应的热化学方程式为 3A(g) B(g)+2C(g);△
H=+100akJ•mol﹣1
【考点】物质的量或浓度随时间的变化曲线;化学反应速率与化学平衡图象的综
合应用.
【分析】A、根据 v= 计算反应速率;
B、t4~t5 阶段正逆反应速率减小且相等,如是降低温度,平衡移动发生移动,则
正逆反应速率不相等;
C、根据 C、A 浓度的变化判断二者计量数关系,根据 t4~t5 阶段判断化学方程式,
根据化学方程式计算;
D、计算 3molA 反应的热量,结合方程式书写热化学方程式.
【解答】解:A、若 t1=15s,生成物 C 在 t0~t1 时间段的平均反应速率为:v=
= =0.004mol•L﹣1•s﹣1,故 A 错
误;
B、如 t4~t5 阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应
速率不相等,应为降低压强,故 B 错误;
C、反应中 A 的浓度变化为 0.15mol/L﹣0.06mol/L=0.09mol/L,C 的浓度变化为
0.11mol/L﹣0.05mol/L=0.06mol/L,反应中 A 与 C 的计量数之比为 0.09:0.06=3:
2,t3~t4 阶段与 t4~t5 阶段正逆反应速率都相等,而 t3~t4 阶段为使用催化剂,
则 t4~t5 阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有:
3A(g) B(g)+2C(g),根据方程式可知消耗 0.09mol/L 的 A,则生成
0.03mol/L 的 B,容器的体积为 2L,生成 B 的物质的量为 0.06mol,平衡时 B 的物
质的量为 0.1mol,所以起始时 B 的物质的量为 0.1mol﹣0.06mol=0.04mol,故 C
错误;
D、反应的方程式为 3A(g) B(g)+2C(g),A 的物质的量减少 0.03mol,
而此过程中容器与外界的热交换总量为 akJ,则 A 的物质的量减少 3mol,与外界
的热交换总量为 100akJ,根据图象可知 t5~t6 阶段应为升高温度,A 的物质的量
减少,说明反应向正反应方向移动,则正反应吸热,
故该反应的热化学方程式为 3A(g) B(g)+2C(g);△H=+100akJ•mol﹣1,
故 D 正确.
故选 D.
10.T℃时,某一气态平衡体系中含有 X(g)、Y(g)、Z(g)、W(g)四种物质,
此温度下发生反应的平衡常数表达式为:K= ,有关
该平衡体系的说法正确的是( )
A.升高温度,平衡常数 K 增大
B.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应
C.增大压强,W(g)体积分数增加
D.增大 X(g)浓度,平衡向正反应方向移动
【考点】化学平衡的影响因素;化学平衡常数的含义.
【分析】根据平衡常数表达式可知反应方程式为 2Z(g)+2W(g)⇌X(g)+2y
(g),结合影响化学平衡移动的因素解答该题.
【解答】解:根据平衡常数表达式可知反应方程式为 2Z(g)+2W(g)⇌X(g)
+2y(g),则
A.由于反应的吸放热未知,则温度变化,平衡常数的变化不能判断,故 A 错误;
B.升高温度,若混合气体的平均相对分子质量变小,说明气体的物质的量增多,
平衡向逆反应方向移动,则说明正反应为放热反应,故 B 正确;
C.增大压强,平衡向正反应方向移动,W(g)体积分数减小,故 C 错误;
D.增大 X(g)浓度,平衡向逆反应方向移动,故 D 错误.
故选 B.
11.现有下列四个图象:
下列反应中全部符合上述图象的反应是( )
A.N2(g)+3H2(g)⇌2NH3(g)△H1<0
B.2SO3(g)⇌2SO2(g)+O2(g)△H2>0
C.4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H3<0
D.H2(g)+CO(g)⇌C(s)+H2O(g)△H4>0
【考点】化学平衡建立的过程;化学平衡的影响因素.
【分析】由前两个图象可知,温度越高生成物的浓度越高,则正反应为吸热反应,
由后两个图象可知,压强越大,平均相对分子质量越大,且平衡后加压逆反应速
率大于正反应速率,则加压化学平衡逆向移动,则反应物的气体的计量数之和小
于生成物气体的化学计量数之和,然后依据此两点来分析反应.
【解答】解:由第一个和第二个图象可知升高温度生成物的浓度增大,说明平衡
向正反应方向移动,说明正反应吸热,可排除 A、C 选项,
由第一个、第三个和第四个图象可知压强增大生成物的浓度减小,说明压强增大
平衡向逆反应方向移动,则反应物的气体的计量数之和小于生成物气体的化学计
量数之和,可排除 D 选项,
故选 B.
12.下列说法中有明显错误的是( )
A.对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分
子数增加,因而反应速率增大
B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C.活化分子之间发生的碰撞一定为有效碰撞
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增
大化学反应的速率
【考点】化学反应速率的影响因素.
【分析】A、根据压强对反应速率的影响进行判断;
B、利用温度对反应速率的影响分析;
C、活化分子之间发生的碰撞分为有效碰撞和无效碰撞;
D、催化剂对化学反应速率的影响进行判断.
【解答】解:A、增大压强体系体积减小,对于有气体参加的反应,可使单位体
积内活化分子数增加,反应速率增大,故 A 说法正确;
B、升高温度,反应体系中物质的能量升高,一般可使活化分子的百分数增大,
因而反应速率增大,故 B 说法正确;
C、由于活化分子之间的碰撞分为有效碰撞和无效碰撞,故 C 说法错误;
D、催化剂可使反应需要的能量减小,使活化分子的百分数大大增加,从而成千
上万倍地增大化学反应的速率,故 D 说法正确;
故选 C.
13.已知 NO2 和 N2O4 可以相互转化:2NO2(g)⇌N2O4(g)△H<0.现将一定
量 NO2 和 N2O4 的混合气体通入体积为 1L 的恒温密闭容器中,反应物浓度随时间
变化关系如图.下列说法错误的是( )
A.图中共有两条曲线 X 和 Y,其中曲线 X 表示 NO2 浓度随时间的变化
B.a、b、c、d 四个点中,表示化学反应处于平衡状态的点是 b 和 d
C.反应进行至 25min 时,曲线发生变化的原因是加入 0.4mol N2O4
D.若要达到与 d 相同的状态,在 25min 时还可以采取的措施是适当缩小容器体
积
【考点】物质的量或浓度随时间的变化曲线.
【分析】由图象曲线变化可知,在 10min 时,X 浓度变化量为 0.4mol/L,Y 浓度
变化量为 0.2mol/L,则 X 为 NO2 的变化曲线,Y 为 N2O4 的变化曲线,25min 时,
NO2 的浓度增大,应为加入一定量的 NO2,达到平衡的时间段为 10min~25min
以及 30min 以后,以此解答该题.
【解答】解:A.由图象曲线变化可知,在 10min 时,X 浓度变化量为 0.4mol/L,
Y 浓度变化量为 0.2mol/L,则 X 为 NO2 的变化曲线,Y 为 N2O4 的变化曲线,故 A
正确;
B.达到平衡的时间段为 10min~25min 以及 30min 以后,表示化学反应处于平
衡状态的点是 b 和 d,故 B 正确;
C.25min 时,NO2 的浓度增大 0.4mol,所以应为加入 0.4mol 的 NO2,故 C 错误;
D.d 状态为平衡状态,NO2 与 N2O4 的浓度与原来的平衡状态相比较均增大,适
当缩小容器体积,NO2 与 N2O4 的浓度都增大,可达到与 d 相同的状态,故 D 正
确.
故选 C.
14.某温度下,体积一定的密闭容器中进行如下可逆反应 X(g)+Y(g)⇌Z(g)
+W(s)△H>0.下列叙述中,正确的是( )
A.加入少量 W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.改变条件,又达新平衡,此时上述反应的平衡常数 K 值一定增大
【考点】化学平衡的影响因素.
【分析】A.W 为固体,增大 W 的用量,不影响平衡的移动;
B.该反应正反应是气体体积减小的反应,随反应进行,压强降低,当压强不再
变化,说明到达平衡状态;
C.升高温度平衡向吸热反应移动;
D.若改变压强或浓度,平衡常数不变,若降低温度,平衡常数减小.
【解答】解:A.W 在反应中是固体,固体量的增减不会引起化学反应速率的改
变和化学平衡的移动,故 A 错误;
B.随反应进行,气体的物质的量减小,压强减小,压强不变说明到达平衡,说
明该反应到达平衡状态,故 B 正确;
C.该反应正反应为吸热反应,升高温度平衡向吸热反应移动,即向正反应移动,
故 C 错误;
D.平衡常数只与温度有关,若减小温度,平衡侧重逆向移动,平衡常数会减小;
若改变的是浓度或压强,平衡常数不变,故 D 错误;
故选 B.
15.在温度、容积相同的 3 个密闭容器中,按不同方式投入反应物,保持恒温、
恒容,测得反应达到平衡时的有关数据如下:(已知 N2(g)+3H2(g)⇌2NH3
(g)△H=﹣92.4kJ•mol﹣1)
容器 甲 乙 丙
反应物的投入量 1molN2、3molH2 2molNH3 4molNH3
NH3 的浓度(mol•L﹣1) c1 c2 c3
反应的能量变化 放出 akJ 吸收 bkJ 吸收 ckJ
体系的压强(Pa) p1 p2 p3
反应物的转化率 a1 a2 a3
下列说法正确的是( )
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.α1+α3=1
【考点】等效平衡;化学平衡的影响因素.
【分析】甲容器反应物投入 1molN2、3molH2,乙容器反应物投入量 2molNH3,
恒温且乙容器容积和甲容器相同,则甲容器与乙容器是等效平衡;
甲容器反应物投入 1molN2、3molH2,丙容器反应物投入量 4molNH3,采用极限
转化法转化为反应物为 2molN2、6molH2,是甲中的二倍,如果恒温且丙容器容
积是甲容器 2 倍,则甲容器与丙容器也是等效平衡;所以丙所到达的平衡,可以
看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体
积相等所到达的平衡,据此分析平衡移动.
【解答】解:甲投入 1molN2、3molH2,乙容器投入量 2molNH3,恒温恒容条件
下,甲容器与乙容器是等效平衡,各组分的物质的量、含量、转化率等完全相等;
而甲容器投入 1molN2、3molH2,丙容器加入 4molNH3,采用极限转化法丙相当
于加入 2molN2、6molH2,丙中加入量是甲中的二倍,如果恒温且丙容器容积是
甲容器 2 倍,则甲容器与丙容器为等效平衡,所以丙所到达的平衡,可以看作在
恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等
所到达的平衡,由于该反应是体积减小的反应,缩小容器体积,增大了压强,平
衡向着正向移动,所以丙中氮气、氢气转化率大于甲和乙的,
A、丙容器反应物投入量 4molNH3,采用极限转化法转化为反应物为 2molN2、
6molH2,是甲中的二倍,若平衡不移动,c3=2c1;丙相当于增大压强,平衡向着
正向移动,所以丙中氨气的浓度大于乙中氨气浓度的二倍,即 c3>2c1,故 A 错
误;
B、甲投入 1molN2、3molH2,乙中投入 2molNH3,则甲与乙是完全等效的,根据
盖斯定律可知,甲与乙的反应的能量变化之和为 92.4kJ,故 a+b=92.4,故 B 正确;
C、丙容器反应物投入量 4molNH3,是乙的二倍,若平衡不移动,丙中压强为乙
的二倍;由于丙中相当于增大压强,平衡向着向着正向移动,所以丙中压强减小,
小于乙的 2 倍,即 2p2>p3,故 C 错误;
D、丙容器反应物投入量 4molNH3 ,是乙的二倍,若平衡不移动,转化率
α1+α3=1;由于丙中相当于增大压强,平衡向着向着正向移动,氨气的转化率减
小,所以转化率 α1+α3<1,故 D 错误;
故选 B.
二、非选择题(本题包括 5 小题,共 55 分.)
16.高炉炼铁过程中发生的主要反应为 Fe2O3(s)+CO(g)= Fe(s)+CO2
(g)已知该反应在不同温度下的平衡常数如下:
温度/℃ 1000 1150 1300
平衡常数 4.0 3.7 3.5
请回答下列问题:
(1)该反应的平衡常数表达式 K= ,△H < 0(填“>”、
“<”或“=”);
(2)在一个容积为 10L 的密闭容器中,1000℃时加入 Fe、Fe2O3、CO、CO2 各
1.0mol,反应经过 10min 后达到平衡.求该时间范围内反应的平均反应速率 v
(C02)= 0.006mol/(L•min) 、CO 的平衡转化率= 60% :
(3)欲提高(2)中 CO 的平衡转化率,可采取的措施是 C .
A.减少 Fe 的量 B.增加 Fe203 的量 C.移出部分 C02
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂.
【考点】化学平衡的计算;反应速率的定量表示方法;用化学平衡常数进行计算;
化学平衡的影响因素.
【分析】(1)根据化学平衡常数的概念来书写表达式,并利用温度与化学平衡常
数的关系来分析反应热;
(2)根据各物质的物质的量、化学平衡常数及三段法计算来平衡时的量,再计
算反应速率及物质的转化率;
(3)根据影响化学平衡移动的因素可知,提高(2)中 CO 的平衡转化率则是分
析能使平衡正向移动的措施来解答.
【解答】解:(1)由平衡常数是指在一定温度下,当一个可逆反应达到化学平
衡时,生成物浓度幂之积与反应物浓度幂之积的比值,
但需要注意但是固体和纯液体的浓度视为常数,不能出现在表达式中,则 K=
,又从表中数据可知随着温度的升高平衡常数逐渐减小,
则说明温度升高平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为: ;<;
(2)设 CO 转化的物质的量为 x,则
Fe2O3(s)+CO(g)═ Fe(s)+CO2(g)
起始量(mol) 1.0 1.0
转化的量(mol) x x
平衡时的量(mol) 1.0﹣x 1.0+x
又在 1000℃时 K=4.0,则有 =4.0,解得 x=0.6,
C02 的浓度变化量为:c(C02)= =0.06mol/L,
则用二氧化碳表示的反应速率为 =0.006mol/(L.min),CO
的转化率为 ×100%=60%,
故答案为:0.006mol/(L.min);60%;
(3)若提高 CO 的平衡转化率,则化学平衡向正反应方向移动,
因 Fe、Fe2O3 都是固体,改变质量平衡不移动,故 AB 不选;
移出二氧化碳气体,减小生成物中气体的浓度,则平衡正向移动,故 C 选;
因反应为放热反应,则升高温度,平衡向逆反应方向移动,故 D 不选;
因该反应前后气体的体积不变,则减小容器的容积,平衡不移动,故 E 不选;
因催化剂对平衡移动无影响,则加入合适的催化剂不能使平衡移动,故 F 不选;
故答案为:C.
17.有四种化合物 W、X、Y、Z,它们都是由短周期元素 A、B、C、D、E 中的两
种元素组成的.已知:
(a)A、B、C、D、E 五种元素的原子序数依次增大,且 A、D 同主族,C、E 同
主族,B、C 同周期.
(b)W 由 B、C 组成,分子中原子个数比为 B:C=1:2,固体易升华.
(c)X 由 A、C 组成,分子中原子个数比为 A:C=1:1.
(d)Y 由 C、D 形成的离子化合物,且 Y 中相应元素的微粒之比为:C:D=1:
1.
(e)Z 是由 D、E 形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、
阳离子数之比为 1:2.
试回答下列各小题:
(1)各元素符号:A H B C C O D Na E S
(2)W 的电子式: .
(3)X 的结构式: H﹣O﹣O﹣H .
(4)Y 的电子式: .
(5)Z 的化学式: Na2S .
(6)写出 Y 与水反应的化学方程式: 2Na2O2+2H2O═4NaOH+O2↑ .
【考点】位置结构性质的相互关系应用.
【分析】四种化合物W、X、Y、Z.它们都是由短周期元素 A、B、C、D、E 中两
种元素组成,A、B、C、D、E 五种元素的原子序数依次增大,且 A、D 同主族,
C、E 同主族,只能是 A 处于第一周期,C 处于第二周期、D、E 处于第三周期,
则 A 为 H 元素,D 为 Na;Z 是由 D、E 形成的离子化合物,E 形成阴离子,其中
阳离子比阴离子少一个电子层,阴、阳离子数之比为 1﹕2,则 E 形成的阴离子
带 2 个单位负电荷,所以 E 是 S 元素,则 Z 是 Na2S;C 和 E 同主族,所以 C 是 O
元素;X 由 A、C 组成,分子中原子个数比 A﹕C=1﹕1,则 X 是 H2O2;Y 是由 C、
D 形成的离子化合物,且 Y 中相应元素的微粒之比为 C:D=1:1,则 Y 是 Na2O2;
B、C 同周期,W 由 B、C 组成,分子中原子个数比为 B:C=1:2,固体易升华,
则 B 为碳元素,W 为 CO2,据此解答.
【解答】解:四种化合物W、X、Y、Z.它们都是由短周期元素 A、B、C、D、E
中两种元素组成,A、B、C、D、E 五种元素的原子序数依次增大,且 A、D 同主
族,C、E 同主族,只能是 A 处于第一周期,C 处于第二周期、D、E 处于第三周
期,则 A 为 H 元素,D 为 Na;Z 是由 D、E 形成的离子化合物,E 形成阴离子,
其中阳离子比阴离子少一个电子层,阴、阳离子数之比为 1﹕2,则 E 形成的阴
离子带 2 个单位负电荷,所以 E 是 S 元素,则 Z 是 Na2S;C 和 E 同主族,所以 C
是 O 元素;X 由 A、C 组成,分子中原子个数比 A﹕C=1﹕1,则 X 是 H2O2;Y 是
由 C、D 形成的离子化合物,且 Y 中相应元素的微粒之比为 C:D=1:1,则 Y 是
Na2O2;B、C 同周期,W 由 B、C 组成,分子中原子个数比为 B:C=1:2,固体
易升华,则 B 为碳元素,W 为 CO2.
(1)通过以上分析知,A、B、C、D、E 分别是:H、C、O、Na、S 元素,
故答案为:H;C;O;Na;S;
(2)W 为 CO2,电子式为: ,故答案为: ;
(3)X 是 H2O2,结构式为:H﹣O﹣O﹣H,故答案为:H﹣O﹣O﹣H;
(4)Y 为 Na2O2,电子式是: ,故答案
为: ;
(5)Z 的化学式:Na2S,故答案为:Na2S;
(6)Y 与水反应的化学方程式:2Na2O2+2H2O═4NaOH+O2↑,故答案为:
2Na2O2+2H2O═4NaOH+O2↑.
18.在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)⇌CO2
(g)+H2(g),其化学平衡常数 K 和温度 t 的关系如表:
t℃ 700 800 830 1000 1200
K 1.7 1.1 1.0 0.6 0.4
回答下列问题:
(1)该反应的化学平衡常数表达式为 K= ,该
反应为 放热 反应(填吸热或放热).
若改变条件使平衡向正反应方向移动,则平衡常数 ③ (填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是 bc .
(a)容器中压强不变 (b)混合气体中 c(CO)不变
(c)v 逆(H2)=v 正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的 CO (g) 和 H2O (g) 分别通入到体积为 2L 的恒容密闭容
器中,进行反应 CO (g)+H2O (g)⇌CO2(g)+H2(g),得到如下三组数据:
起始量/mol 平衡量/mol实验组 温度/℃
H2O CO CO2 CO
达到平衡所需时间
/min
A 650 2 4 1.6 2.4 5
B 900 1 2 0.4 1.6 3
C 900 a b c d t
①实验 A 中以 υ(H2) 表示的反应速率为 0.16mol•L﹣1•min﹣1 .
②通过计算可知,CO 的转化率实验 A 大于 实验 B(填“大于”、“等于”或“小
于”),该反应的正反应为 放 (填“吸”或“放”)热反应.
③若实验 C 要达到与实验 B 相同的平衡状态,则 a、b 应满足的关系是 b=2a
(用含 a、b 的数学式表示).
【考点】化学平衡的计算;化学平衡的影响因素.
【分析】(1)K 为生成物浓度幂之积与反应物浓度幂之积的比,由表格数据可知,
温度越高 K 越小,则升高温度平衡逆向移动;K 只与温度有关;
(2)结合平衡的特征“等、定”及衍生的物理量判定平衡状态;
(3)①速率之比等于化学计量之比,υ(H2)=υ(CO);
②A 中 CO (g)+H2O (g)⇌CO2(g)+H2(g),
开始 4 2 0 0
转化 1.6 1.6 1.6 1.6
平衡 2.4 0.4 1.6 1.6
B 中 CO (g)+H2O (g)⇌CO2(g)+H2(g),
开始 2 1 0 0
转化 0.4 0.4 0.4 0.4
平衡 1.6 0.6 0.4 0.4
转化率分别为 ×100%=40%、 ×100%=20%,K 分别为
=2.67、 =0.16;
③实验 C 要达到与实验 B 相同的平衡状态,温度相同,则起始量相同.
【解答】解:(1)CO(g)+H2O(g)⇌CO2(g)+H2(g),其化学平衡常数 K=
; 由表格数据可知,温度越高 K 越小,则升高温
度平衡逆向移动,则正反应放热反应,改变条件使平衡向正反应方向移动,若降
低温度,K 可增大,其它因素时 K 不变,
故答案为: ;放热; ③;
(2)(a)该反应为气体体积不变的反应,容器中始终压强不变,不能判定平衡,
故不选;
(b)混合气体中 c(CO)不变,浓度不变,为平衡状态,故选;
(c)v 逆(H2)=v 正(H2O),可知正逆反应速率相等,为平衡状态,故选;
(d)c(CO)=c(CO2)与起始浓度、转化率有关,不能判定平衡,故不选;
故答案为:b c;
(3)①速率之比等于化学计量之比,υ(H2)=υ(CO)= =0.16
mol•L﹣1•min﹣1,故答案为:0.16 mol•L﹣1•min﹣1;
②A 中 CO (g)+H2O (g)⇌CO2(g)+H2(g),
开始 4 2 0 0
转化 1.6 1.6 1.6 1.6
平衡 2.4 0.4 1.6 1.6
B 中 CO (g)+H2O (g)⇌CO2(g)+H2(g),
开始 2 1 0 0
转化 0.4 0.4 0.4 0.4
平衡 1.6 0.6 0.4 0.4
转化率分别为 ×100%=40%、 ×100%=20%,K 分别为
=2.67、 =0.16,
可知 A 中转化率大于 B 中转化率,且温度高时 K 小,则正反应为放热反应,
故答案为:大于; 放;
③实验 C 要达到与实验 B 相同的平衡状态,温度相同,则起始量相同,可知
b=2a,故答案为:b=2a.
19.甲醇被称为 2l 世纪的新型燃料,工业上通过下列反应①和②,用 CH4 和 H2O
为原料来制备甲醇.
①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1
②CO(g)+2H2(g)⇌CH3OH(g)△H2
将 0.20mol CH4(g)和 0.30mol H2O(g)通入容积为 10L 的密闭容器中,在一定
条件下发生反应①,达到平衡时,CH4 的转化率与温度、压强的关系如图.
(1)温度不变,缩小体积,增大压强,①的反应速率 增大 (填“增大”、“减
小”或“不变”),平衡向 逆反应方向或左 方向移动.
(2)温度升高,反应①的△H1 > 0(填“<”、“=”或“>”),其平衡常数表达
式为 K= ,100℃时的平衡常数值是 1.35×
10﹣3 .
(3)在压强为 0.1MPa 条件下,将 a mol CO 与 3a mol H2 的混合气体在催化剂作
用下进行反应②生成甲醇.为了寻找合成甲醇的温度和压强的适宜条件,某同学
设计了三组实验,部分实验条件已经填在下面实验设计表中.请在下表空格中填
入剩余的实验条件数据.
实验编号 T(℃) n (CO)/n(H2) P(MPa)
I 150 1/3 0.1
II 5
III 350 5
【考点】化学平衡的计算.
【分析】(1)CH4(g)+H2O(g)⇌CO(g)+3H2(g)为气体体积增大的反应,
增大压强,反应速率增大,平衡逆向移动;
(2)由图可知,升高温度,甲烷的转化率增大,K 为生成物浓度幂之积与反应
物浓度幂之积的比,100℃时的甲烷转化率为 0.5,则
CH4(g)+H2O(g)⇌CO(g)+3H2(g)
开始 0.02 0.03 0 0
转化 0.01 0.01 0.01 0.03
平衡 0.01 0.02 0.01 0.03
结合平衡浓度计算 K;
(3)寻找合成甲醇的温度和压强的适宜条件,则实验 I 和 II 只有压强不同,II
和 III 只有温度不同,以此来解答.
【解答】解:(1)CH4(g)+H2O(g)⇌CO(g)+3H2(g)为气体体积增大的反
应,增大压强,反应速率增大,平衡逆反应方向或左移动,
故答案为:增大; 逆反应方向或左;
(2)由图可知,升高温度,甲烷的转化率增大,即升高温度平衡正向移动,可
知△H1>0;K= ,100℃时的甲烷转化率为 0.5,
则
CH4(g)+H2O(g)⇌CO(g)+3H2(g)
开始 0.02 0.03 0 0
转化 0.01 0.01 0.01 0.03
平衡 0.01 0.02 0.01 0.03
K= =1.35×10﹣3,
故答案为:>; ;1.35×10﹣3;
(3)寻找合成甲醇的温度和压强的适宜条件,则实验 I 和 II 只有压强不同,II
和 III 只有温度不同,则 II 中数据分别为 150、1/3,III 中数据为 1/3,故答案为:
实验编
号
T(℃) n (CO)/n
(H2)
P(MPa)
I
II 150 1/3
III 1/3
20.在某个容积为 2L 的密闭容器内,在 T℃时按图 1 所示发生反应:
mA(g)+nB(g)⇌pD(g)+qE(s)H<0(m、n、p、q 为最简比例的整
数).
(1)根据图 1 所示,反应开始至达到平衡时,用 D 表示该反应速率为 0.1
mol/(L•min);
方程式中 m:n:p:q= 2:1:3:1
(2)该反应的化学平衡常数 K 为 1.7 (保留至一位小数);
(3)下列措施能增大 B 的转化率的是 C、E
A.升高温度 B.保持体积不变通入 1molB
C.保持体积不变移出部分物质 D(g) D.将容器的容积增大为原来的 2
倍
E.保持体积不变通入 1mol A
(4)能判断该反应已经达到化学平衡状态的是 B、C、D
A.恒容恒温时容器中气体压强保持不变 B.混合气体中 D 浓度不变
C.v(A)正=v(A)逆 D.恒容时容器中气体密度
不变
(5)反应达到平衡后,第 7min 时,改变条件,在第 9min 达到新的平衡,在图
2 上作出第 7min 至第 15min
下列情况下,D 浓度变化图象
①若降低温度且平衡时 D 物质的量变化了 0.4mol (用虚线)
②若将容器的容积压缩为原来一半(用实线)
【考点】化学平衡的计算;化学平衡的影响因素;化学平衡状态的判断;化学反
应速率和化学计量数的关系.
【分析】(1)v= ,速率之比等于化学计量数之比;
(2)A、B 减少,C、D 增加,则 A、B 为反应物、C、D 为生成物,物质的量变
化量之比为 2:1:3:1,则
2A(g)+B(g)⇌3D(g)+E(s)
开始 0.4 0.5 0
转化 0.2 0.1 0.3
平衡 0.2 0.4 0.3
K= ;
(3)能增大 B 的转化率,平衡正向移动,但不能加入 B;
(4)结合平衡的特征“等、定”判定平衡状态;
(5)在第 9min 达到新的平衡,在图 2 上作出第 7min 至第 15min
①若降低温度且平衡时 D 物质的量变化了 0.4mol,平衡正向移动,生成 D,且反
应速率加快(用虚线);
②若将容器的容积压缩为原来一半,平衡不移动(用实线).
【解答】解:(1)根据图 1 所示,反应开始至达到平衡时,用 D 表示该反应速
率为 =0.1 mol/(L•min);物质的量变化量之比等于化学计量数
之比,则方程式中 m:n:p:q=2:1:3:1,
故答案为:0.1 mol/(L•min);2:1:3:1;
(2)A、B 减少,C、D 增加,则 A、B 为反应物、C、D 为生成物,物质的量变
化量之比为 2:1:3:1,则
2A(g)+B(g)⇌3D(g)+E(s)
开始 0.4 0.5 0
转化 0.2 0.1 0.3
平衡 0.2 0.4 0.3
K= =1.7,
故答案为:1.7;
(3)A.升高温度,平衡逆向移动,转化率减小,故 A 不选;
B.保持体积不变通入 1molB,B 的转化率减小,故 B 不选;
C.保持体积不变移出部分物质 D(g),平衡正向移动,B 的转化率增大,故 C
选;
D.该反应为体积不变的反应,将容器的容积增大为原来的 2 倍,平衡不移动,
故 D 不选;
E.保持体积不变通入 1mol A,平衡正向移动,B 的转化率增大,故 E 选;
故答案为:C、E;
(4)A.恒容恒温时容器中气体压强始终保持不变,不能判定平衡,故 A 不选;
B.混合气体中 D 浓度不变,为平衡特征“定”,可判定,故 B 选;
C.v(A)正=v(A)逆,为平衡特征“等”可判定,故 C 选;
D.气体的质量为变量,则恒容时容器中气体密度不变,达到平衡状态,故 D 选;
故答案为:B、C、D;
(5)①若降低温度且平衡时 D 物质的量变化了 0.4mol,平衡正向移动,生成 D,
且反应速率加快(用虚线);
②若将容器的容积压缩为原来一半,平衡不移动(用实线),起点在第 7 分钟,
拐 点 在 第 9 分 钟 , 且 降 低 温 度 的 图 象 不 能 超 越 0.6mol/L , 图 象 为
, 故 答 案 为 :
.
2017 年 1 月 21 日