- 847.00 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
卓越联盟2016-2017学年第一学期第三次月考
高二化学试题
试卷说明:1、本试卷共24题,考试时间90分钟,分值100分。
2、可能用到相对原子质量为:H:1 C:12 O:16 Cu:64 Ag:108
第Ⅰ卷 选择题(共60分)
一、选择题(本题包括20小题,每题3分,共60分。每小题只有一个正确选项)
1.反应A(g)+B(g) C(g) +D(g) 发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是( )
A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B.反应体系中加入催化剂,反应速率增大,△H不变
C.△H < 0,反应达到平衡时,升高温度,A的转化率增大
D.△H > 0,反应达到平衡时,升高温度,A的转化率减少
2.下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
3.常温下,下列有关叙述正确的是( )
A.0.1 mol·L-1醋酸溶液加水稀释后,各离子浓度均减小
B.pH=7的NH4Cl和氨水混合溶液中,c(NH4+)=c(Cl-)
C.加热滴有酚酞的CH3COONa溶液,溶液颜色变浅
D.0.1 mol·L-1 Na2CO3溶液中,c(HCO3-)>c(OH-)
4.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是:( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++eˉ=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同。
A.①② B.②③ C.②④ D.③④
5.A、B、C、D 四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;将A、D分别投入等浓度盐酸中,D比A反应剧烈;将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C盐溶液里,有金属C析出。据此判断它们的活动性由强到弱顺序是:( )
A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C
6.下列物质一定属于同系物的是 ( )
A.①和② B.④和⑥ C.⑤和⑦ D.⑥和⑧
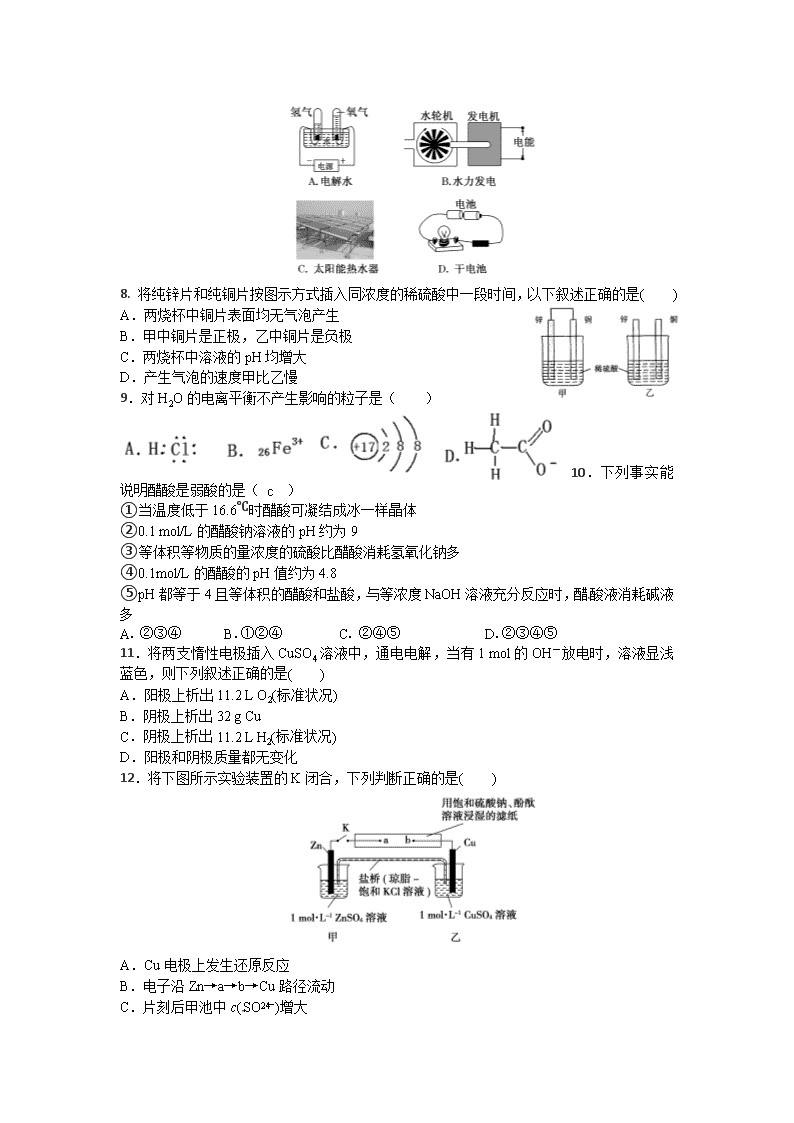
7.下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是( )
8. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
9.对H2O的电离平衡不产生影响的粒子是( )
10.下列事实能说明醋酸是弱酸的是( c )
①当温度低于16.6℃时醋酸可凝结成冰一样晶体
②0.1 mol/L的醋酸钠溶液的pH约为9
③等体积等物质的量浓度的硫酸比醋酸消耗氢氧化钠多
④0.1mol/L的醋酸的pH值约为4.8
⑤pH都等于4且等体积的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多
A. ②③④ B.①②④ C. ②④⑤ D.②③④⑤
11.将两支惰性电极插入CuSO4溶液中,通电电解,当有1 mol的OH-放电时,溶液显浅蓝色,则下列叙述正确的是( )
A.阳极上析出11.2 L O2(标准状况)
B.阴极上析出32 g Cu
C.阴极上析出11.2 L H2(标准状况)
D.阳极和阴极质量都无变化
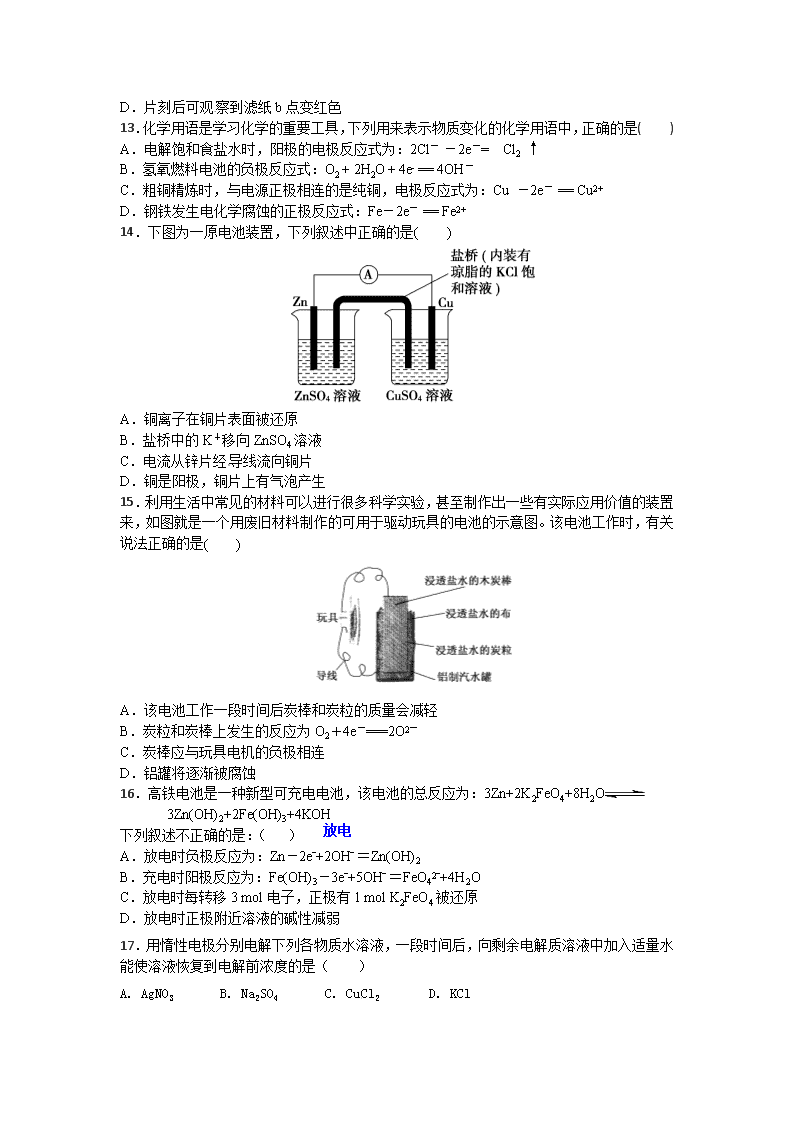
12.将下图所示实验装置的K闭合,下列判断正确的是( )
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO)增大
D.片刻后可观察到滤纸b点变红色
13.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e- == Fe2+
14.下图为一原电池装置,下列叙述中正确的是( )
A.铜离子在铜片表面被还原
B.盐桥中的K+移向ZnSO4溶液
C.电流从锌片经导线流向铜片
D.铜是阳极,铜片上有气泡产生
15.利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。该电池工作时,有关说法正确的是( )
A.该电池工作一段时间后炭棒和炭粒的质量会减轻
B.炭粒和炭棒上发生的反应为O2+4e-===2O2-
C.炭棒应与玩具电机的负极相连
D.铝罐将逐渐被腐蚀
放电
充电
16.高铁电池是一种新型可充电电池,该电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是:( )
A.放电时负极反应为:Zn-2eˉ+2OHˉ=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3eˉ+5OHˉ=FeO42ˉ+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D.放电时正极附近溶液的碱性减弱
17.用惰性电极分别电解下列各物质水溶液,一段时间后,向剩余电解质溶液中加入适量水能使溶液恢复到电解前浓度的是( )
A. AgNO3 B. Na2SO4 C. CuCl2 D. KCl
18.被称为“软电池“的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内为离子“流过”水和氯化锌组成的电解液。电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列有关说法中正确的是:( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化作用
C.当0.1 mol Zn完全反应时,流经电解液的电子个数为1.204×1023
D.电池的正极反应式为2MnO2+2H2O+2eˉ=2MnO(OH)+2OHˉ
19. 北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开。S诱抗素的分子结构如图,下列关于该分子说法正确的是( )。
A.含有碳碳双键、羟基、羰基、羧基
B.含有苯环、羟基、羰基、羧基
C.含有羟基、羰基、羧基、酯基
D.含有碳碳双键、苯环、羟基、羰基
20.维生素A对人体,特别是对人的视力有重大作用,其结构简式如图所示:
下列关于该化合物的说法正确的是 ( )
A.维生素A的分子式为C16H25O
B.维生素A含有苯环结构
C.维生素A的一个分子中有3个双键
D.维生素A的分子中含有两种官能团 (维生素A的结构简式)
2,4,6
第Ⅱ卷(非选择题,共40分)
二、填空题
21.(6分)具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论。
如: 具有的官能团名称为: 、 、 ,
所以这个化合物可看作 类, 类和 类。
22.(16分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
② Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是 ,电极反应式是 。
② Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
23.(10分)化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):
(1)对于氢氧燃料电池,下列表达不正确的是________(填代号)。
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-===4OH-
C.电池总反应式为:2H2+O22H2O
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100 mL 0.1 mol·L-1AgNO3溶液,当氢氧燃料电池中消耗氢气112 mL(标准状况下)时,此时图中装置中溶液的pH=________(溶液体积变化忽略不计)。
Ⅱ.已知甲醇的燃烧热ΔH为-726.5 kJ·mol-1在直接以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为____________________________________,
正极的反应式为________________________________________________。
理想状态下,该燃料电池消耗1 mol 甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为______(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
24.( 8分)某学生利用右面实验装置探究盐桥式原电池的工作原理。按照实验步骤依次回答下列问题:
(1)导线中电子流向为______________(用a、b表示)。
(2)写出装置中锌电极上的电极反应式_______________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________;(不允许用“NA”表示)
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
卓越联盟2016-2017学年第一学期第三次月考
高二化学试题参考答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
B
A
B
C
B
C
D
C
C
C
B
A
A
A
D
16
17
18
19
20
D
B
D
A
D
第Ⅱ卷 非选择题(共40分)
21.(共6分,每空1分)
羧基 羟基 醛基 羧酸 酚 醛
22.(共16分,每空2分)
(1) ① 2H+ +2e- =H2↑或2H2O + 2e- = 2OH-+H2↑(2分);
放出气体,溶液变红。(2分)
② 2Cl – -2e- =Cl2 ↑(2分);把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。(2分)
(2)① 纯铜(2分) Cu2+ +2e- =Cu (2分)
② 粗铜(2分) Cu -2e- =Cu2+(2分)
23.(共10分,每空2分)
Ⅰ.(1)C、D (2)1
Ⅱ.CH3OH+H2O-6e-===CO2↑+6H+
O2+4H++4e-===2H2O 96.6%
24.(共8分,每空2分)
(1)由a到b(或a→b) (2)Zn-2e-===Zn2+
(3)1.204×1022 (4)B