- 453.00 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学与技术
一、选择题
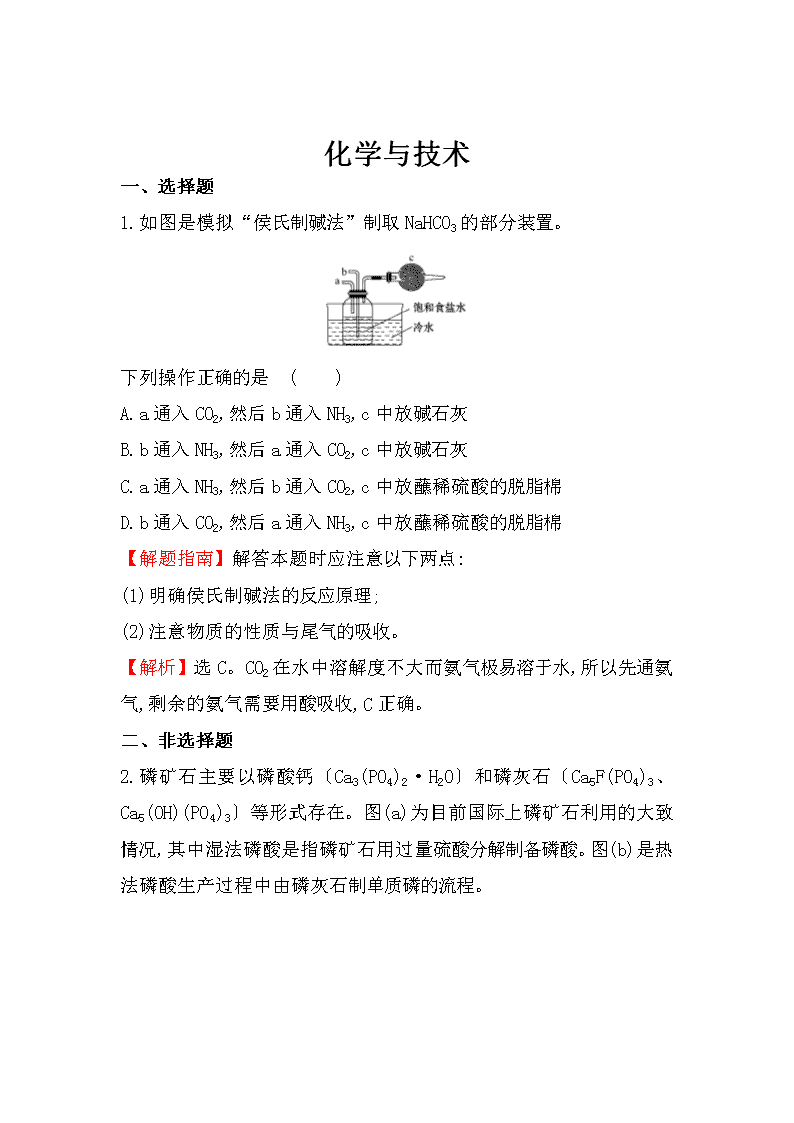
1.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。
下列操作正确的是 ( )
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
【解题指南】解答本题时应注意以下两点:
(1)明确侯氏制碱法的反应原理;
(2)注意物质的性质与尾气的吸收。
【解析】选C。CO2在水中溶解度不大而氨气极易溶于水,所以先通氨气,剩余的氨气需要用酸吸收,C正确。
二、非选择题
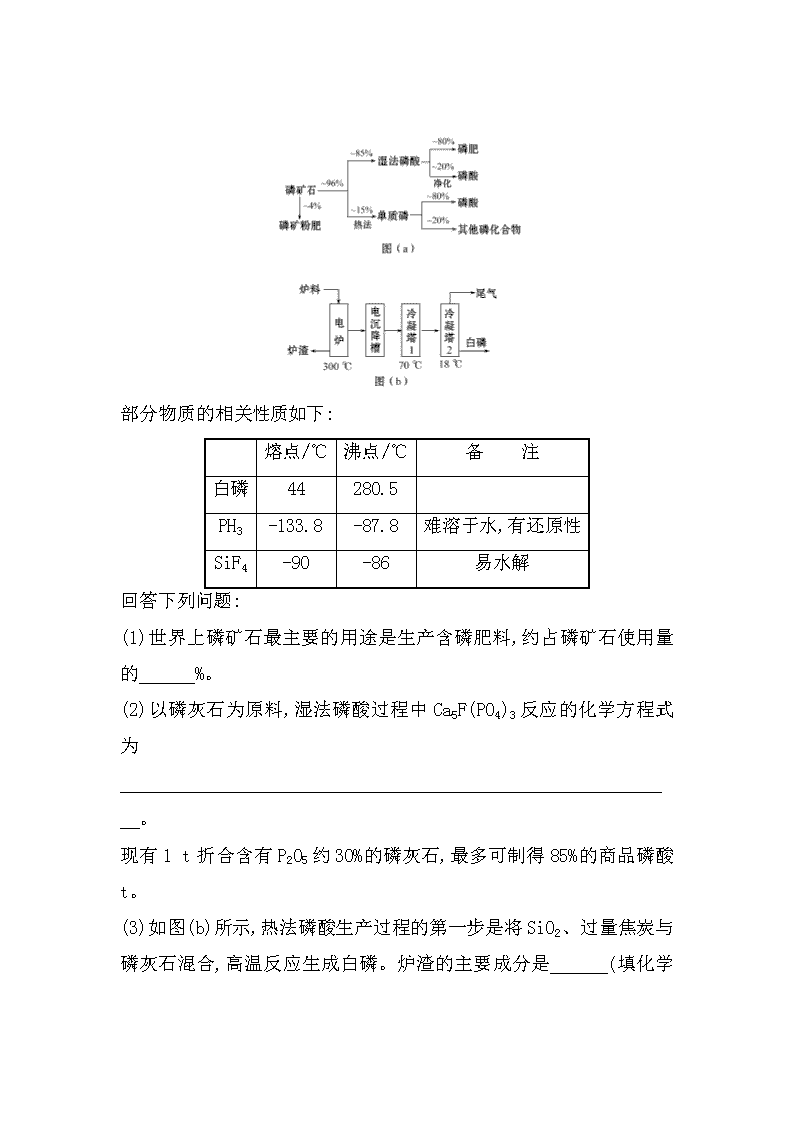
2.磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔Ca5F(PO4)3、Ca5(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程。
部分物质的相关性质如下:
熔点/℃
沸点/℃
备 注
白磷
44
280.5
PH3
-133.8
-87.8
难溶于水,有还原性
SiF4
-90
-86
易水解
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 %。
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为 。
现有1 t折合含有P2O5约30%的磷灰石,最多可制得85%的商品磷酸 t。
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是
(填化学式),冷凝塔1的主要沉积物是 ,冷凝塔2的主要沉积物是 。
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等。将尾气先通入纯碱溶液,可除去 ,再通入次氯酸钠溶液,可除去 。(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是 。
【解题指南】解答本题要注意以下两点:
(1)注意流程图中磷矿石生产含磷肥料不是一步;
(2)书写化学反应方程式时注意配平。
【解析】(1)根据流程图可知生产含磷肥料,约占磷矿石使用量的比例是0.04+0.96×0.85×0.80=0.69=69%。
(2)由题意,过量的硫酸溶解Ca5F(PO4)3生成磷酸、硫酸钙和氟化氢,根据原子守恒配平即可;根据磷元素守恒可得到关系式:P2O5~2H3PO4,142 t五氧化二磷可制得196 t磷酸,由题意可知1 t磷灰石含有0.3 t五氧化二磷,可制取85%的商品磷酸的质量为196×0.3÷142÷0.85=0.49 t。
(3)二氧化硅、过量焦炭与磷灰石混合,在高温下反应得到的难溶固体物质是硅酸钙;根据冷凝塔1的冷凝温度70℃,可知在白磷的熔点和沸点之间,所以冷凝塔1的主要沉积物为液态白磷,同理可知冷凝塔2的主要沉积物为固态白磷。
(4)由题意可知,尾气中主要含有四氟化硅和一氧化碳,碳酸钠溶液呈碱性,可以除去SiF4、H2S和HF,次氯酸钠有强氧化性,可以除去还原性气体PH3。
(5)由流程图可知,热法磷酸工艺的产品纯度大、杂质少。
答案:(1)69
(2)Ca5F(PO4)3+5H2SO43H3PO4+5CaSO4+HF↑
0.49 (3)CaSiO3 液态白磷 固态白磷
(4)SiF4、CO SiF4、HF、H2S PH3
(5)产品纯度高(浓度大)
3.木糖醇(C5H12O5)可用作甜味剂、营养剂,在化工、食品、医药等工业中有广泛应用。利用玉米芯中的多糖可以生产木糖醇,其工艺流程如下:
1-浸泡罐;2、3-反应罐;4-板式过滤机;5、10-浓缩罐;
6-脱色柱;12-离心机(固液分离装置)
已知:木糖与木糖醇的转化关系如下:
请回答下列问题:
(1)装置2中硫酸的主要作用是 。
(2)装置3中加入碳酸钙的目的是 。
(3)为除去木糖浆中的杂质离子7、8装置中的填充物依次是 。
(4)装置9的作用是 。
A.冷却木糖浆 B.水解木糖 C.氧化木糖 D.还原木糖
(5)装置11的作用是 。
【解题指南】解答本题时应注意以下两点:
(1)分析木糖和木糖醇的结构,理解工艺原理。
(2)根据物质的性质选择合理的分离、提纯的方法。
【解析】(1)装置2中发生玉米芯的水解反应,硫酸作催化剂。
(2)碳酸钙能够与硫酸反应生成微溶的硫酸钙,在除去过量的硫酸的同时生成了微溶物,易于分离。
(3)若先用阴离子交换树脂进行交换,则OH-与原来的阳离子Ca2+等会产生沉淀堵塞树脂,所以先用阳离子交换树脂,然后再用阴离子交换树脂。
(4)通过装置9后产生木糖醇浆,分析木糖与木糖醇的结构可知,木糖与氢气加成后生成木糖醇,加氢反应属于还原反应。
(5)木糖醇浆进入装置11后再通过离心机分离,则装置11应是从木糖醇浆中得到晶体,是使木糖醇结晶的操作。
答案:(1)催化 (2)中和剩余的硫酸,生成产物CaSO4有利于分离
(3)阳离子交换树脂、阴离子交换树脂
(4)D (5)结晶
4.Ⅰ.下列有关叙述正确的是
( )
A.碱性锌锰电池中,MnO2是催化剂
B.银锌纽扣电池工作时,Ag2O被还原为Ag
C.放电时,铅酸蓄电池中硫酸浓度不断增大
D.电镀时,待镀的金属制品表面发生还原反应
Ⅱ.锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为 。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的 操作。
(3)浸出液“净化”过程中加入的主要物质为 ,其作用是 。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是 。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生主要反应的离子方程式为 。
(6)我国古代曾采用“火法”工艺冶炼锌,明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为
。
(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
【解析】Ⅰ.碱性锌锰干电池中,锌为负极,正极为二氧化锰,A错误;银锌纽扣电池中锌为负极,氧化银为正极,工作时,正极氧化银得电子变为银,发生还原反应,B正确;放电时,铅酸蓄电池中硫酸浓度减小,消耗硫酸且生成水,C错误;电镀时镀件作阴极,镀层金属作阳极,镀层金属阳离子在阴极得电子析出金属镀层附着在镀件上,D正确。
Ⅱ.(1)硫化锌在焙烧过程中发生氧化还原反应,生成氧化锌和二氧化硫,所以得到的焙砂主要成分为氧化锌;
(2)含尘烟气主要是二氧化硫,可以用来制备硫酸,而在焙砂中需要浸出锌离子,所以氧化锌变为锌离子最好用硫酸溶解氧化锌(同时氧化铁也被溶解);
(3)后续需要净化浸出液,就是把铁离子除去而不引入新的杂质,用单质锌来除去铁;
(4)电解硫酸锌,阳极氢氧根离子失电子生成氧气;
(5)焙烧过程中产生了污染大气的二氧化硫气体,而采用“氧压酸浸”法就可以避免生成二氧化硫气体而变为非金属单质即单质硫,所以化学方程式为2ZnS+4H++O22Zn2++2H2O+2S;
(6)“火法”冶炼锌主要是碳酸锌和煤炭饼(主要成分是碳)在高温下发生反应生成一氧化碳和单质锌,反应方程式为ZnCO3+2CZn+3CO↑。
答案:Ⅰ.B、D
Ⅱ.(1)ZnO (2)浸出 (3)锌粉 置换出Fe等 (4)O2
(5)2ZnS+4H++O22Zn2++2S+2H2O
(6)ZnCO3+2CZn+3CO↑
5.在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
完成下列填空:
(1)写出上述制备小苏打的化学方程式: 。
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤
②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是 。(选填编号)
a.①析出的氯化铵纯度更高
b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用
d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、S,将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是 。
滤渣的主要成分是 、 。
(4)称取1.840 g小苏打样品(含少量NaCl),配制成250 mL溶液,取出25.00 mL用0.100 0 mol·L-1盐酸滴定,消耗盐酸21.50 mL。
实验中所需的定量仪器除滴定管外,还有 。
选甲基橙而不选酚酞作为指示剂的原因是 。
样品中NaHCO3质量分数为 。(保留3位小数)
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果 。(选填“偏高”“偏低”或“不受影响”)
【解题指南】解答本题时应注意以下3点:
(1)明确侯氏制碱法的反应原理;
(2)注意物质的性质与物质提纯、分离方法的对应关系;
(3)酸碱中和滴定操作原理、滴定终点与指示剂的关系。
【解析】(1)利用NaHCO3在溶液中溶解度较小,碳酸氢铵与氯化钠反应生成NaHCO3和NH4Cl。
(2)通入氨后增大c(N),①析出的氯化铵纯度更高;不通氨后的溶液是饱和食盐水,②的滤液可直接循环使用。
(3)H2O2将Fe2+氧化为Fe3+,加热促进Fe3+的水解,使其生成Fe(OH)3沉淀而除去;S与Ba2+生成BaSO4沉淀,则滤渣中含有Fe(OH)3和BaSO4。
(4)称取1.840 g小苏打样品需要电子天平,配制250 mL溶液需要250 mL容量瓶。小苏打与盐酸反应生成氯化钠,溶液显中性,而酚酞在pH大于8时才显红色,不能确定滴定终点。n(HCl)=0.100 0 mol·L-1×21.50 mL×10-3L·mL-1=2.150×10-3mol,n(NaHCO3)=2.150×10-3mol,250 mL溶液中含有n(NaHCO3)= 2.150×10-2mol,质量是1.806 g,样品中NaHCO3质量分数为1.806 g/1.840 g=0.982。
(5)碳酸氢钠与盐酸反应生成氯化钠、水和CO2,最终得到的固体是氯化钠,根据差量法可以计算出碳酸氢钠的质量,即
2NaHCO3Na2CO3+H2O+CO2↑ 固体质量减少量
168 g 62 g
m Δm
若蒸发过程中有少量液体溅出,则最终生成的氯化钠质量偏少,因此根据差量法可知固体减少的质量偏大,即Δm偏大,则碳酸氢钠的质量偏大,因此测定结果偏高。
答案:(1)NH4HCO3+NaClNaHCO3↓+NH4Cl
(2)a、d (3)使Fe3+完全水解为Fe(OH)3 Fe(OH)3 BaSO4
(4)电子天平、250 mL容量瓶 选用酚酞作为指示剂,不能确定滴定终点 0.982
(5)偏高
6.工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7)。工艺流程及相关物质溶解度曲线如图:
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为 。
通过冷却结晶析出大量K2Cr2O7的原因是
。
(2)向Na2Cr2O7母液中加碱液调pH的目的是 。
(3)固体A主要为 (填化学式),固体B主要为 (填化学式)。
(4)用热水洗涤固体A,回收的洗涤液转移到母液 (填“Ⅰ”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗最低。
【解题指南】解答本题时应注意以下两点:
(1)仔细看图,了解溶解度曲线的意义;
(2)掌握化学流程分析的步骤与方法。
【解析】(1)Na2Cr2O7与KCl发生复分解反应,化学方程式为Na2Cr2O7+2KClK2Cr2O7+2NaCl,根据图像可知,低温下K2Cr2O7溶解度远小于其他组分,随温度的降低,K2Cr2O7的溶解度明显减小。
(2)加碱可以使Fe3+转化为沉淀而除去。
(3)根据溶解度的大小,高温浓缩时,NaCl析出,所以固体A主要为NaCl;冷却结晶时,K2Cr2O7析出,所以固体B主要为K2Cr2O7。
(4)用热水洗涤固体NaCl,洗涤液中含有NaCl,所以洗涤液转移到母液Ⅱ中,既能提高产率又能使能耗最低。
答案:(1)Na2Cr2O7+2KClK2Cr2O7+2NaCl 低温下K2Cr2O7溶解度远小于其他组分,随温度的降低,K2Cr2O7的溶解度明显减小(合理即可)
(2)除去Fe3+
(3)NaCl K2Cr2O7
(4)Ⅱ
7.将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1) 下列改进和优化海水综合利用工艺的设想和做法可行的是
(2) (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2ONaBr+NaBrO3+NaHCO3,吸收1 mol Br2时,转移的电子数为
mol。
(3)海水提镁的一段工艺流程如下图:
浓海水的主要成分如下:
离子
Na+
Mg2+
Cl-
S
浓度/(g·L-1)
63.7
28.8
144.6
46.4
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1 L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为
;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
【解题指南】解答本题要注意以下两点:
(1)利用化合价升降相等或者得失电子守恒对氧化还原反应进行配平;
(2)镁与冷水不反应,但与热水反应。
【解析】(1)用混凝法只能除去海水中的悬浮物,不能获取淡水,故设想和做法可行的是②③④;
(2)利用化合价升降法配平反应方程式得3Br2+6Na2CO3+3H2O5NaBr+NaBrO3+
6NaHCO3,根据比例关系每反应1 mol溴单质转移电子的物质的量为mol;
(3)海水中硫元素主要以硫酸根的形式存在,根据流程图,脱硫阶段所发生的反应为Ca2++SCaSO4↓,产品2为氢氧化镁,根据镁元素守恒可知28.8 g的镁离子最终得到氢氧化镁的质量为69.6 g;
(4)若阳极材料是石墨,阴极材料是不锈钢,电解熔融的氯化镁,所发生的反应为MgCl2Mg+Cl2↑,电解时若有水存在,则在高温时镁与水发生反应会导致镁的消耗。
答案:(1)②③④ (2) (3)Ca2++SCaSO4↓ Mg(OH)2 69.6
(4)MgCl2Mg + Cl2↑ Mg + 2H2OMg(OH)2+ H2↑