- 92.00 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017/2018学年上学期昌吉州四中高二理科期中考试
(高二化学)
一. 选择题( 每小题只有1个正确选项,每小题4分,共60分)
1. 下列设备工作时,将化学能转化为电能的是( )
A. A B. B C. C D. D
2.下列化学反应属于吸热反应的是( )
A.盐酸与烧碱溶液的反应 B.Al与稀盐酸的反应
C.C+CO22CO D.葡萄糖在人体内氧化分解
3.甲烷是一种高效清洁的新能源,0.25 mol甲烷完全燃烧生成液态水时放出222.5 kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g)===2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1
C.2CH4(g)+4O2(g)===2CO2(g)+4H2O(l) ΔH=-890 kJ·mol-1
D.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
4.在2L密闭容器中加入4molA和6molB,发生以下反应:4A(g)+6B(g) 4C(g) +5D(g)。若经5s后,剩下的A是2.5mol,则B的反应速率是( )
A.0.45 mol / (L·s) B.0.15 mol / (L·s)
C.0.225 mol / (L·s) D.0.9 mol / (L·s)
5.把下列4种X的溶液分别加入到4个盛有10 mL 2 mol·L-1盐酸的烧杯中,并加水稀释到50 mL,此时X与盐酸缓慢地进行反应,其中反应速率最大的是( )
A.20 mL 3 mol·L-1 B.20 mL 2 mol·L-1
C.10 mL 4 mol·L-1 D.10 mL 2 mol·L-1
6.一般都能使反应速率加快的方法是( )。
① 升温;②改变生成物浓度;③增加反应物浓度;④加压
(A)①②③ (B)①③ (C)②③ (D)①②③④
7.对于反应C(s)+H2O(g) CO(g)+H2(g) ΔH>0,下列有关说法正确的是( )
A.平衡常数表达式为K= B.增大体系压强,平衡常数K不发生变化
C.升高体系温度,平衡常数K减小 D.增加C(s)的量,平衡正向移动
8.在一定温度下,在恒容的密闭容器中进行的可逆反应A(g)+3B(g)2C(g)达到平衡的标志是( )
A.C生成的速率和C分解的速率相等 B.单位时间内生成n mol A,同时生成3n mol B
C.B的消耗速率与C的消耗速率之比为1:1 D.混合气体密度保持不变
9. 反应2X(g)+Y(g)2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
A. T1<T2,P1<P2 B. T1<T2,P1>P2
C. T1>T2,P1>P2 D. T1>T2,P1<P2
10.已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则HCN在水溶液中电离的ΔH等于 ( )
A.-67.7 kJ·mol-1 B.-43.5 kJ·mol-1
C.+43.5 kJ·mol-1 D.+67.7 kJ·mol-1
11.(2011·东北师大附中期中)反应2A(g)2B(g)+E(g) ΔH>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压 B.减压 C.减少E的浓度 D.降温
12.能用焓判据判断下列过程的方向的是( )
A.水总是自发地由高处往低处流
B.放热反应容易自发进行,吸热反应不能自发进行
C.有序排列的火柴散落时成为无序排列
D.多次洗牌以后,扑克牌的毫无规律的混乱排列的概率大
13.在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表所示:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应表示为X+3Y2Z,此温度下的平衡常数为1 600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
14.下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是( )
A.2NO2(g)N2O4(g) (正反应为放热反应)
B.3O2 (g)2O3(g) (正反应为吸热反应)
C.H2(g)+I2(g) 2 H I(g)(正反应为放热反应)
D.NH4HCO3(s) NH3(g)+H2O(g)+CO2(g) (正反应为吸热反应)
15.一般都能使反应速率加快的方法是( )。
② 升温;②改变生成物浓度;③增加反应物浓度;④加压
(A)①②③ (B)①③ (C)②③ (D)①②③④
二.填空题(共40分)
15. (8分)100 mL 0.50 mol/L盐酸与110 mL 0.55 mol/L NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________________。
(2)烧杯间填满碎纸条的作用是__________________________________。
(3)按如图装置进行实验,测得的中和热数值______(填“偏大”“偏小”“无影响”),原因是________________________________。
(4)实验中改用80 mL 0.50 mol/L盐酸跟80 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_______________________(填“相等”“不相等”)。
(5)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容
c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号
起始温度t1/℃
终止温度t2/℃
盐酸
氢氧化钠溶液
混合溶液
1
20.0
20.2
23.2
2
20.2
20.4
23.4
3
20.3
20.5
25.6
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________(结果保留一位小数)。
(6)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是________________________________。
16.(每空2分,共8分) (1)由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:_____________________________________________________________________。
已知18 g液态水转化成水蒸气需吸热44 kJ,则反应2H2(g)+O2(g)===2H2O(l)的ΔH=________kJ·mol-1,氢气的标准燃烧热ΔH=__________kJ·mol-1。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=________kJ·mol-1。
17.(12分) 在一定体积的密闭容器中,进行如下化学反应:
CO2(g) +H2(g)CO (g) +H2O (g)
其化学平衡常数K和温度t的关系如下表:
t℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为________反应(填“吸热”“放热”)。
(3)能说明该反应达到化学平衡状态的是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: 3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为 ℃。
(5) 830℃时,在1L密闭容器中分别投入lmolH2和lmolCO2反应达到化学平衡时,CO2的转化率为 ;保持温度不变,在平衡体系中再充入1molH2和lmolCO2重新达到化学平衡时,CO2的平衡转化率 (填“增大”、“减小”或“不变”)•
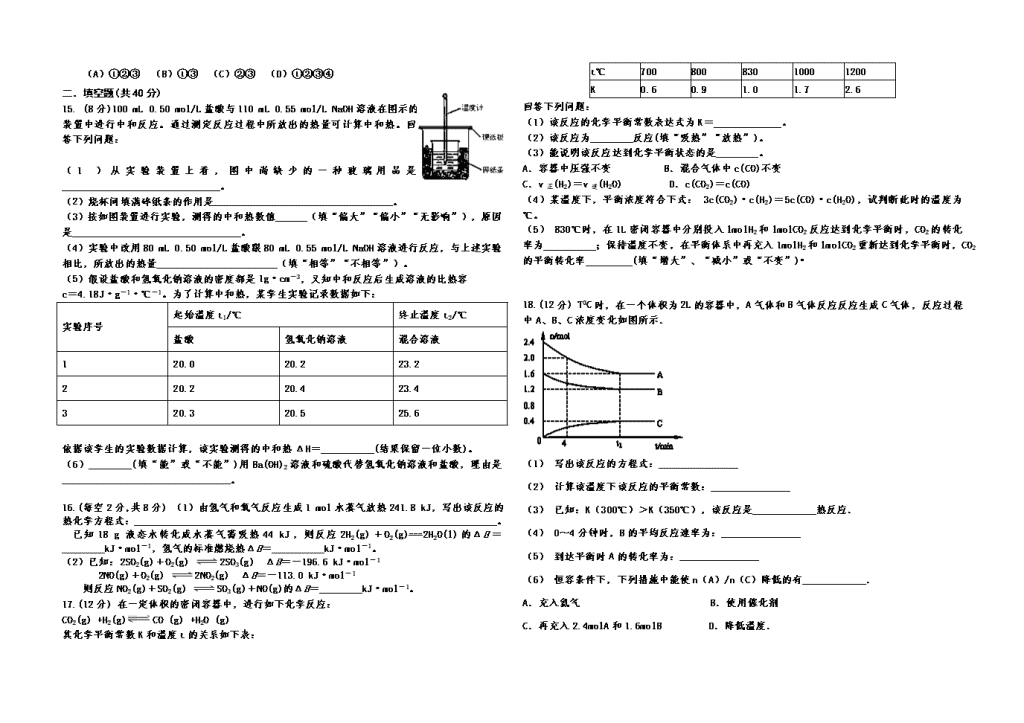
18.(12分) T0C时,在一个体积为2L的容器中,A气体和B气体反应反应生成C气体,反应过程中A、B、C浓度变化如图所示.
(1) 写出该反应的方程式:_______________
(2) 计算该温度下该反应的平衡常数:_______________
(3) 已知:K(300℃)>K(350℃),该反应是____________热反应.
(4) 0~4分钟时,B的平均反应速率为:_______________
(5) 到达平衡时A的转化率为:_______________
(6) 恒容条件下,下列措施中能使n(A)/n(C)降低的有____________.
A.充入氦气 B.使用催化剂
C.再充入2.4molA和1.6molB D.降低温度.