- 288.00 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
邻水二中2018年秋高2017级10月月考
化 学 试 题
一、单选题(本题包括21个小题,每小题2分,共42分。)
1.化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是( )
A.天然气、石油、流水、风力、氢气为一级能源
B.无论是风力发电还是火力发电,都是将化学能转化为电能
C.PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
D.发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统
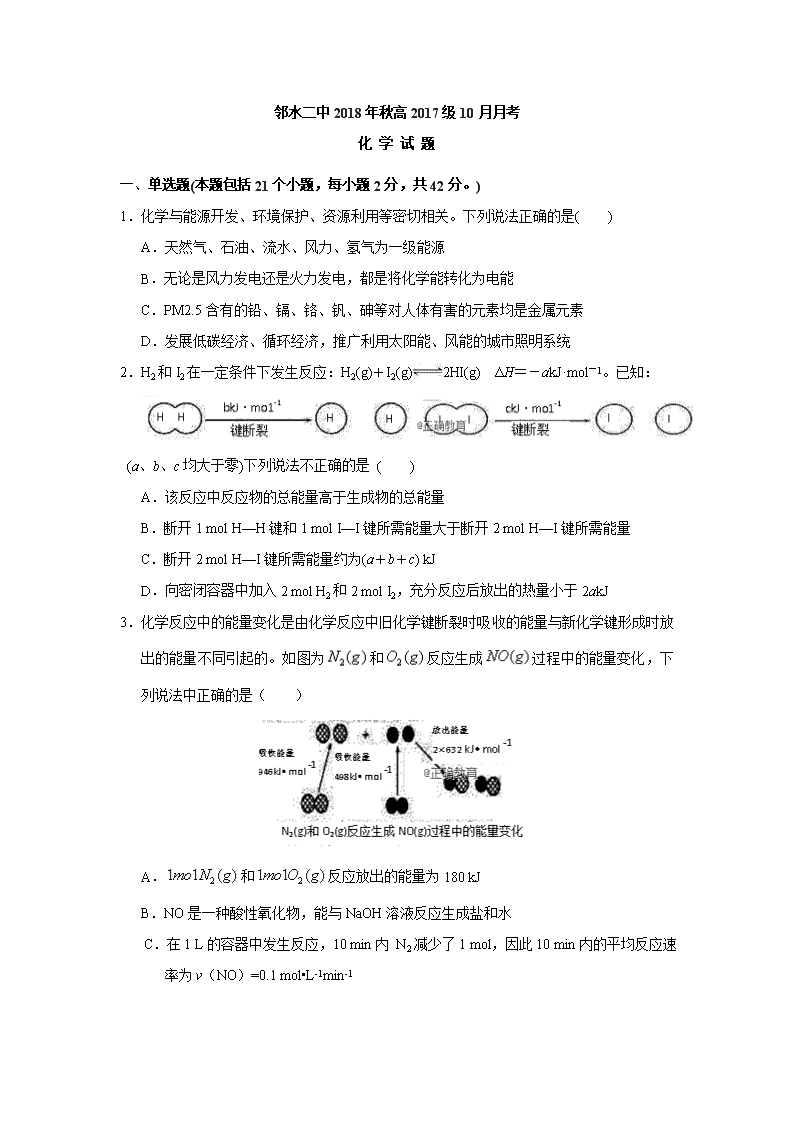
2.H2和I2在一定条件下发生反应:H2(g)+I2(g)2HI(g) ΔH=-akJ·mol-1。已知:
(a、b、c均大于零)下列说法不正确的是 ( )
A.该反应中反应物的总能量高于生成物的总能量
B.断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
C.断开2 mol H—I键所需能量约为(a+b+c) kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2akJ
3.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为和反应生成过程中的能量变化,下列说法中正确的是( )
A.和反应放出的能量为180 kJ
B.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
C.在1 L的容器中发生反应,10 min内 N2减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol•L-1min-1
D.和具有的总能量小于2 mol NO(g)具有的总能量
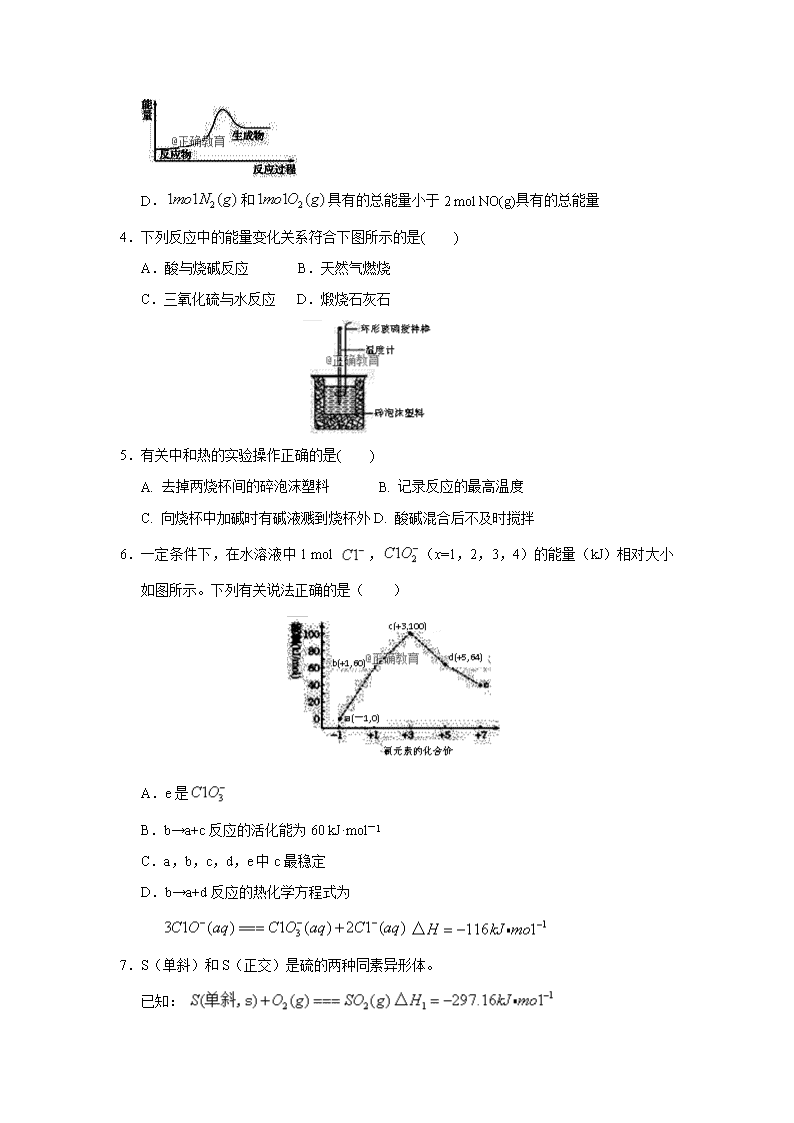
4.下列反应中的能量变化关系符合下图所示的是( )
A.酸与烧碱反应 B.天然气燃烧
C.三氧化硫与水反应 D.煅烧石灰石
5.有关中和热的实验操作正确的是( )
A. 去掉两烧杯间的碎泡沫塑料 B. 记录反应的最高温度
C. 向烧杯中加碱时有碱液溅到烧杯外D. 酸碱混合后不及时搅拌
6.一定条件下,在水溶液中1 mol ,(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )
A.e是
B.b→a+c反应的活化能为60 kJ·mol-1
C.a,b,c,d,e中c最稳定
D.b→a+d反应的热化学方程式为
7.S(单斜)和S(正交)是硫的两种同素异形体。
已知:
②
③
下列说法正确的是( )
A.ΔH3=+0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s)===S(正交,s) ΔH3<0,正交硫比单斜硫稳定
D.S(单斜,s)===S(正交,s) ΔH3>0,单斜硫比正交硫稳定
8.氯原子对O3分解有催化作用:①O3+Cl===ClO+O2 ΔH1,②ClO+O===Cl+O2 ΔH2。大气臭氧层的分解反应是③O3+O===2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中,正确的是( )
A.反应O3+O===2O2的ΔH=E1-E3
B.反应O3+O===2O2的ΔH=E2-E3
C.O3+O===2O2是吸热反应
D.ΔH=ΔH1+ΔH2
9.标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和
O===O键的键焓分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1,下列热化学方程式正确的是( )
A.
B.
C.
D.
10.据报道,科学家开发出了利用太阳能分解水的新型催化剂,下列有关水分解过程的能量变化示意图正确的是( )
A.答案A B.答案B C.答案C D.答案D
11.下列说法正确的是( )
A.硫完全燃烧生成二氧化硫时,放出的热量为硫的燃烧热
B.在25℃、101kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
C.由2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,
可知CO的燃烧热为283 kJ·mol-1
D.乙炔的燃烧热为1 299.6 kJ·mol-1,则2C2H2(g)+5O2(g)===4CO2(g)+2H2O(g)反应的ΔH=-2 599.2 kJ·mol-1
12.热化学方程式C(s)+H2O(g)=== CO(g)+H2(g) ΔH=+131.3 kJ·mol-1表示( )
A.碳和水反应吸收131.3 kJ能量
B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气并吸收131.3 kJ热量
C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气,吸收热量131.3 kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.3 kJ
13.已知723 K时,2SO2(g)+O2(g)2SO3(g)ΔH=-Q kJ·mol-1,在相同条件下,向一密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2kJ.则Q1、Q2、Q满足的关系是( )
A. B. C. D.
14.在一定温度、一定体积条件下,能说明下列反应达到平衡状态的是( )
A.反应2SO2(g)+O2(g)2SO3(g)容器内的密度不随时间变化
B.反应A2(g)+B2(g)2AB(g)容器内A2的消耗速率与AB消耗速率相等
C.反应N2+3H22NH3容器内气体平均相对分子质量不随时间变化
D.反应4A(s)+3B(g)2C(g)+D(g)容器内气体总压强不随时间变化
15.可逆反应aA(g)+bB(g)cC(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系式中能说明反应已达到平衡状态的是( )
A. av(A)正=bv(B)正 B. bv(A)正=av(B)逆 C. cv(C)正=av(A)逆 D. av(A)正=bv(B)逆
16.利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)。已知:①C7H8(l)(NBD)+9O2(g)===7CO2(g)+4H2O(l) ΔH1②C7H8(l)(Q)+9O2(g)===7CO2(g)+4H2O(l) ΔH2
③ ΔH=-88.62 kJ·mol-1。下列叙述正确的是( )
A.ΔH1>ΔH2 B.NBD的能量比Q的能量高
C.NBD比Q稳定 D.NBD转化为Q是吸热反应
17.四个试管中都装有5 mL 0.1 mol•L-1Na2S2O3溶液,分别在不同温度下加入
0.1 mol•L-1硫酸和一定量的水,最先出现浑浊的是( )
A.20℃,5 mL硫酸,2 mL水 B.20℃,4 mL硫酸,3 mL水
C.30℃,4 mL硫酸,3 mL水 D.30℃,5 mL硫酸,2 mL水
18.下图中曲线a表示放热反应X(g)+Y(g)Z(g)+N(s)进行
过程中X的转化率随时间变化的关系,若只改变一个起始
条件,使反应过程按b曲线进行,可采取的措施是( )
A.升高温度 B.加大X的投入量
C.使用催化剂 D.缩小体积
19.现有反应:Na2S2O3+H2SO4Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的 ( )
实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mo1·L-1)
V/mL
c/(mo1·L-1)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
A.答案A B.答案B C.答案C D.答案D
20.冰醋酸CH3COOH沸点较高(117.9 ℃),且能形成二聚物(CH3COOH)2,其反应式为2CH3COOH(g)(CH3COOH)2(g) (正反应为放热反应),若采用测气体密度的方法测醋酸相对分子质量,为尽量接近真实性,在测定时应采用( )
A.高温低压 B.低温低压 C.加催化剂 D.低温高压
21.放热反应2NO(g)+O2(g)2NO2(g)达平衡后,若分别采取下列措施:①增大压强 ②减小NO2的浓度 ③增大O2浓度 ④升高温度 ⑤加入催化剂,能使平衡向正反应方向移动的是( )
A.①②③ B.②③④ C.③④⑤ D.①②⑤
二、填空题 (本题有2小题,共15分)
22.将1 mol化合物A的蒸气充入0.5 L容器中加热使其分解:2A(g)B(g)+nC(g),反应到3 min时,容器内A的浓度为0.8 mol·L-1,测得这段时间内,平均速率
v(C)=0.6 mol·L-1·min-1,则反应方程式中的n值为________,v(B)=________。
23.热值是指一定条件下单位质量的物质完全燃烧所放出的热量。已知H2(g)、CO(g)和CH3OH(l)的热值分别为143 kJ· g-1、10 kJ·g-1和23 kJ·g-1。请回答下列问题:
(1)写出CO燃烧反应的热化学方程式为____________________________________。
(2)表示甲醇燃烧热的热化学方程式为_____________________________________。
(3)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为__________________。
三、实验题(本题有2小题,共36分)
24.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号
反应物
催化剂
①
10 mL 2% H2O2溶液
无
②
10 mL 5% H2O2溶液
无
③
10 mL 5% H2O2溶液
1 mL 0.1 mo1·L-1FeC13溶液
④
10 mL 5% H2O2溶液+少量HC1溶液
1 mL 0.1 mo1·L-1FeC13溶液
⑤
10 mL 5% H2O2溶液+少量NaOH溶液
1 mL 0.1 mo1·L-1FeC13溶液
(1)实验①和②的目的是__________________________。
(2)写出实验③的化学反应方程式__________________。
(3)实验③、④、⑤中,测得生成氧气的体积随时间变
化的关系如图。分析如图能够得出的实验结论是
。
25.某学习小组拟用如图所示装置来间接测定醋酸的电离热(即1 mol CH3COOH完全电离所吸收的热量),其原理如下:
[CH3COOH(l)+OH-(aq)===H2O(l)+CH3COO-(aq) ΔH′中和]-[H+(aq)+OH-(aq)===
H2O(l) ΔH中和]=[CH3COOH(l)===H+(aq)+CH3COO-(aq) ΔH电离=ΔH′中和-ΔH中和)]
其主要过程如下:
Ⅰ.测定强酸强碱的中和热
(1)该组同学共设计出以下3种测定方案,通过测定反应过程中释放的热量来计算反应热(ΔH中和)
温度计
环形玻璃搅拌棒
A. 测定50 mL 0.50 mol·L-1的HCl溶液与
50 mL 0.55 mol·L-1的NaOH溶液反应所放出的热量
B. 测定50 mL 0.55 mol·L-1的HCl溶液与
50 mL 0.50 mol·L-1的NaOH溶液反应所放出的热量
C. 测定50 mL 0.55 mol·L-1的HCl溶液与
50 mL 0.55 mol·L-1的NaOH溶液反应所放出的热量
请选出合理的方案________;不合理方案的原因为_______________________________。
(2)取50 mL 0.55 mol·L-1的NaOH溶液和50 mL 0.50 mol·L-1的HCl溶液进行实验,实验数据如下表:
实验
序号
起始温度t1/℃
终止温度t2/℃
盐酸
NaOH溶液
混合溶液
1
20.0
20.1
23.2
2
20.2
20.4
23.4
3
20.5
20.6
23.6
近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。
Ⅱ.测定醋酸与NaOH溶液的反应热
该组同学设计出以下两种测定方案,通过测定反应过程中释放的热量来计算反应热(ΔH′中和)。
A. 测定30 g冰醋酸与100 mL 0.55 mol·L-1的NaOH溶液反应放出的热量
B. 测定0.5 moL·L-1醋酸50 mL与0.55 mol·L-1的NaOH溶液50 mL反应放出的热量
(1)合理的一组为________,理由是__________________________________________。
(2)有同学认为,用该装置测得的ΔH中和和ΔH′中和的数值在理论上均偏小,你同意不同意该观点________,原因是_________________________________________________。
(3)该同学坚持将环形玻璃搅拌棒去掉而用温度计代替,你认为可行不可行__________。
(4)该实验中NaOH必须过量,你认为原因是___________________________________。
四、计算题(本题有1小题,共7分)
26.将2 mol SO2和1 mol O2气体在1 L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2(g)2SO3(g)。若经过2 s后测得SO3的浓度为0.6 mol·L-1。试计算:
(1)求SO3的化学反应速率v(SO3)为多少?
(2)求2 s时O2的浓度?
高二化学答案
1—5 DBDDB 6—10 DCDDB 11—15 CCCCB
16—21 BDCDAA
22、3,0.2mo1/L·min
25、I(1)A、B 若酸(或醋碱)不过量,则难以保证OH(或H+)充分反应生成水。
(2)51.8kJ/mo1
II(1)A 因为测定的是1mol醋酸完全电离的电离热,若用醋酸溶液,则有一部分冰醋酸已经电离,难以求算。
(2)同意 热量的计算是通过溶液中的温度变化来确定的,而容器、温度计、环形玻璃搅拌棒等吸收的热量都未计入。
(3)不可行
(4)充分消耗H+,从而使醋酸的电离平衡向电离方向移动。