- 2.61 MB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第7讲 电化学基础
考点一
原电池原理与新型化学电源
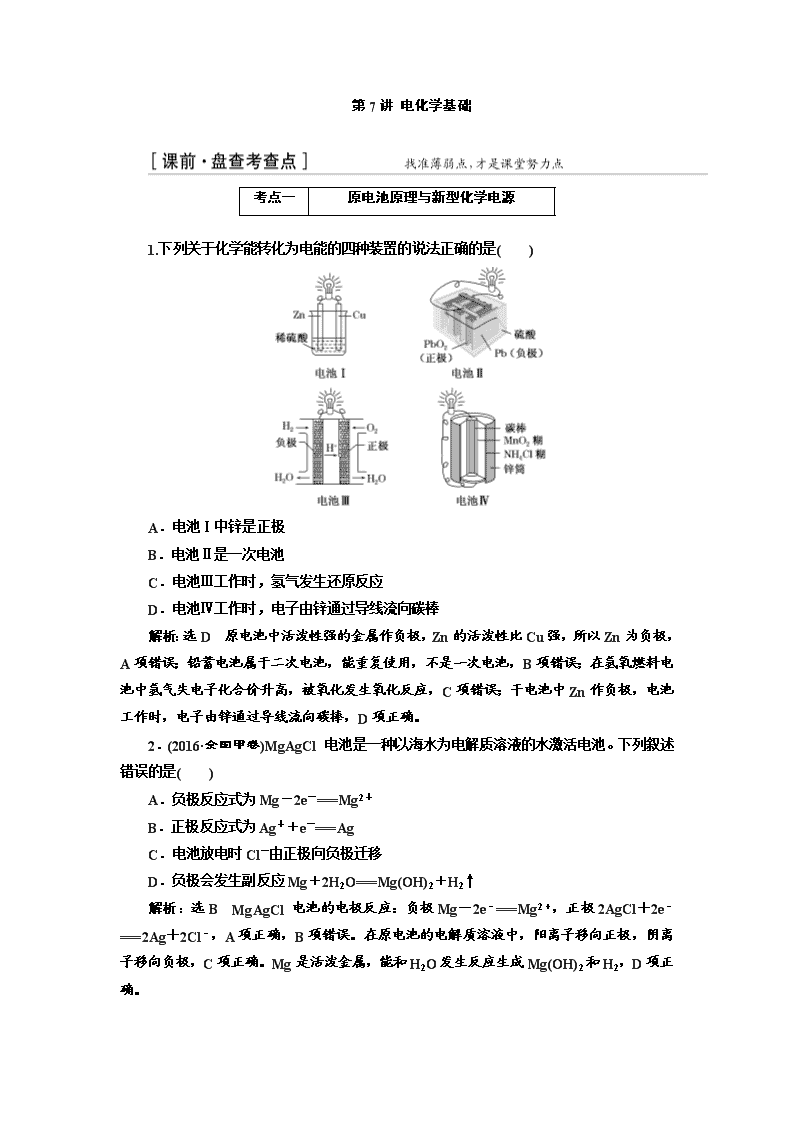
1.下列关于化学能转化为电能的四种装置的说法正确的是( )
A.电池Ⅰ中锌是正极
B.电池Ⅱ是一次电池
C.电池Ⅲ工作时,氢气发生还原反应
D.电池Ⅳ工作时,电子由锌通过导线流向碳棒
解析:选D 原电池中活泼性强的金属作负极,Zn的活泼性比Cu强,所以Zn为负极,A项错误;铅蓄电池属于二次电池,能重复使用,不是一次电池,B项错误;在氢氧燃料电池中氢气失电子化合价升高,被氧化发生氧化反应,C项错误;干电池中Zn作负极,电池工作时,电子由锌通过导线流向碳棒,D项正确。
2.(2016·全国甲卷)MgAgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( )
A.负极反应式为Mg-2e-===Mg2+
B.正极反应式为Ag++e-===Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑
解析:选B MgAgCl电池的电极反应:负极Mg-2e-===Mg2+,正极2AgCl+2e-===2Ag+2Cl-,A项正确,B项错误。在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极,C项正确。Mg是活泼金属,能和H2O发生反应生成Mg(OH)2和H2,D项正确。
3.(2016·石家庄调研)某锂离子二次电池装置如图所示,其放电时的总反应为Li1-xCoO2+LixC6===6C+LiCoO2。下列说法正确的是( )
A.石墨为正极
B.充电时,阳极质量不变
C.充电时,阴极反应为xLi-xe-===xLi+
D.放电时,正极反应为xLi++Li1-xCoO2+xe-===LiCoO2
解析:选D 根据装置示意图和电池放电时的总反应可知,锂离子二次电池中石墨作负极,含锂化合物作正极,A项错误;充电时,阳极发生氧化反应:LiCoO2-xe-===Li1-xCoO2+xLi+,阳极质量减小,B项错误;充电时,阴极发生还原反应:6C+xLi++xe-===LixC6,C项错误;放电时,正极反应为Li1-xCoO2+xLi++xe-===LiCoO2,D项正确。
4.(2016·绵阳模拟)通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是( )
A.b为电池的负极,甲醛被氧化
B.a极的电极反应为O2+4e-+4H+===2H2O
C.传感器工作过程中,电解质溶液中硫酸的浓度不变
D.当电路中转移1×10-4 mol 电子时,传感器内参加反应的HCHO为0.75 mg
解析:选C 氧气反应得电子,a为正极,故b为电池的负极,甲醛被氧化,A项正确;a极是正极,在酸性溶液中电极反应为O2+4e-+4H+===2H2O,B项正确;传感器工作过程中,电解质溶液中硫酸的浓度变小,C项错误;负极:HCHO-4e-+H2O===CO2+4H+,当电路中转移1×10-4 mol电子时,n(HCHO)=×10-4 mol,m(HCHO)=0.75 mg,D项正确。
考点二
电解原理及应用
5.某溶液中含有Cu2+、Fe2+、Al3+、Cl-、NO,且浓度均为0.1 mol·L-1,用石墨作电极进行电解时,肯定得不到的产物是( )
A.Cl2 B.Al
C.Cu D.H2
解析:选B 阴极上Al3+、Fe2+的放电能力弱于H+,而Cu2+的放电能力比水电离出的H+的放电能力强,阳极上Cl-放电能力强于OH-。
6.某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在下图中,下列有关分析完全正确的是( )
选项
A
B
C
D
a电极
阳极
阴极
阳极
阴极
d电极
正极
正极
负极
负极
Q离子
阳离子
阳离子
阴离子
阴离子
解析:选B 电子由电源的负极流出,故a是阴极、d是正极,溶液中阳离子移向阴极。
7.利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是( )
A.a为直流电源的负极
B.阴极的电极反应式为2HSO+2H++e-===S2O+2H2O
C.阳极的电极反应式为SO2+2H2O-2e-===SO+4H+
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
解析:选C 由装置图知,左侧电极硫元素化合价从+4(SO2)升高到+6(H2SO4),故左侧电极是阳极,a为直流电源的正极, A错误、C正确;阴极的电极反应式为2HSO+2H++2e-===S2O+2H2O,B错误;由于H+在阴极上反应,故电解时,H+由阳极室通过阳离子交换膜到阴极室,D错误。
考点三
金属的腐蚀与防护
8.下列操作与钢铁制品的保护无关的是( )
A.炼钢时添加适量铬、镍等元素得到不锈钢
B.保持钢铁制品表面干燥清洁
C.利用电解法可在铁表面镀上一层均匀光滑的银
D.在钢铁制品表面贴几块锡片
解析:
选D 添加铬、镍后可改变金属的内部结构,提高其抗腐蚀能力,A正确;钢铁制品表面干燥时无法发生电化学腐蚀,B正确;银耐腐蚀,镀在铁表面后使其具有耐腐蚀性,C正确;锡、铁若是构成原电池,则铁是负极,会加速其腐蚀,D错误。
9.利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )
A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
解析:选C 根据装置图判断,左边铁丝发生吸氧腐蚀,右边铁丝发生析氢腐蚀,其电极反应为
左边 负极:Fe-2e-===Fe2+
正极:O2+4e-+2H2O===4OH-
右边 负极:Fe-2e-===Fe2+
正极:2H++2e-===H2↑
a、b处的pH均增大,C错误。
10.下列与金属腐蚀有关的说法正确的是( )
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,CuZn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,ZnMnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
解析:选B 图a中,铁棒发生电化学腐蚀,靠近底端的部分与氧气接触少,腐蚀程度较轻,
选项A错误;图b中开关置于M时,CuZn合金作负极,由M改置于N时,CuZn合金作正极,腐蚀速率减小,选项B正确;图c中接通开关时Zn作负极,腐蚀速率增大,但氢气在Pt极上放出,选项C错误;图d中ZnMnO2干电池自放电腐蚀主要是由Zn发生氧化反应引起的,选项D错误。
考点四
串联装置中的电化学问题
11.(2016·四川成都七中月考)假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是( )
A.当K闭合时,A装置发生吸氧腐蚀,在电路中作电源
B.当K断开时,B装置锌片溶解,有氢气产生
C.当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②
D.当K闭合后,A、B装置中溶液的pH均变大
解析:选A 当K闭合时,装置B能自发进行氧化还原反应,所以装置B为原电池,则装置A、C、D都是电解池,装置B中Zn失去电子作负极、Cu作正极。所以装置A中C(石墨)、装置C中Cu、装置D中粗Cu都作阳极。装置A中Fe、装置C中Ag、装置D中纯Cu都作阴极;当K断开时,装置B不能形成闭合回路,所以不能构成原电池,则锌和稀硫酸发生化学腐蚀。当K闭合时,装置B能自发进行氧化还原反应,为原电池,在电路中作电源,装置A为电解池,A项符合题意;当K断开时,装置B不能构成原电池,锌片和稀硫酸发生化学腐蚀而溶解,有氢气产生,B项不符合题意;当K闭合后,装置B为原电池,装置A、C、D为电解池,电子从负极流向阴极,再从阴极流向阳极,所以整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②,电子不进入电解质溶液,C项不符合题意;当K闭合后,装置A中阴极上H+放电,阳极上Cl-放电,导致溶液中OH-浓度增大,溶液的pH增大;B中正极上H+放电导致H+浓度减小,溶液的pH增大,D项不符合题意。
12.(2016·张掖模拟)电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是( )
A.石墨电极上发生氧化反应
B.为增强污水的导电能力,可向污水中加入适量乙醇
C.根据图示,物质A为CO2
D.甲烷燃料电池中CO向空气一极移动
解析:选C 石墨作阴极,发生还原反应,A错误;乙醇是非电解质,不能增强污水的导电能力,B错误;图中电池的电解质为熔融碳酸盐,通甲烷的一极为负极,电极反应为CH4+4CO-8e-===5CO2+2H2O,反应生成CO2,正极反应为O2+2CO2+4e-===2CO,反应消耗CO2,所以物质A为CO2,C正确;原电池中阴离子向负极移动,所以CO向甲烷一极移动,D错误。
考点五
带交换膜的电化学装置
13.(2015·福建高考)某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1 mol O2,有44 g CO2被还原
D.a电极的反应为3CO2+18H+-18e-===C3H8O+5H2O
解析:选B 结合装置图可知该装置为电解装置,模拟“人工树叶”,故为电能转化为化学能,A项错误;b极连接电源的正极,为阳极,在电解池中H+向a极(阴极)区移动,B项正确;右侧H2O→O2发生的是氧化反应,每生成1 mol O2,转移4 mol电子,C3H8O中碳元素的化合价是-2,3CO2―→C3H8O,转移18 mol电子,故生成1 mol O2消耗 mol CO2,C项错误;a电极发生的是还原反应:3CO2+18H++18e-===C3H8O+5H2
O,D项错误。
14.(2016·日照联合检测)纳米级Cu2O由于具有优良的催化性能而受到关注。采用离子交换膜控制电解液中OH-的浓度制备纳米级Cu2O的装置如图所示,发生的反应为2Cu+H2OCu2O+H2↑
下列说法正确的是( )
A.钛电极发生氧化反应
B.阳极附近溶液的pH逐渐增大
C.离子交换膜应采用阳离子交换膜
D.阳极反应为2Cu+2OH--2e-===Cu2O+H2O
解析:选D 钛电极为阴极,发生还原反应,A项错误;铜作阳极,阳极上铜发生失电子的氧化反应,阳极反应为2Cu+2OH--2e-===Cu2O+H2O,OH-由阴极区迁移到阳极区参与反应,离子交换膜应为阴离子交换膜,C项错误、D项正确;由阴极区迁移过来的OH-在阳极全部参与反应,阳极附近溶液的pH不变,B项错误。
⊙考查综合迁移应用能力
15.用电解法可制备Cu2O。原理如图所示。
(1)电极反应式分别为:阳极__________________,阴极__________________。电解过程中石墨电极附近溶液的pH________(填“增大”“不变”“减小”或“无法确定”)。
(2)假设将电解质溶液换成硫酸,仍能制得Cu2O,则阳极上的电极反应式为____________________,电解一段时间后,整个电解质溶液的pH________(填“增大”“不变”“减小”或“无法确定”)。
(3)在上述两种情况下,若制得等量的Cu2O,则电路中通过的电子数之比为________。
解析:(1)观察装置图知,铜电极失去电子变成Cu2O:2Cu-2e-―→Cu2O,再依据电荷守恒、质量守恒及介质为强碱性溶液可配平得2Cu-2e-+2OH-===Cu2O+H2O;阴极上是H2O电离出的H+放电生成氢气,导致石墨电极附近溶液的pH增大。(2)酸性条件下,阳极铜的电极反应式为2Cu-2e-+H2O===Cu2O+2H+,阴极反应式为2H++2e-===H2↑,由此可得电池总反应式为2Cu+H2OCu2O+H2↑。因水不断地被消耗,导致酸的浓度增大,pH减小。(3)依得失电子守恒原理知,在两种情况下制得等量的Cu2O,电路中通过的电子数相等。
答案:(1)2Cu-2e-+2OH-===Cu2O+H2O
2H2O+2e-===H2↑+2OH- 增大
(2)2Cu-2e-+H2O===Cu2O+2H+ 减小
(3)1∶1
16.某蓄电池的反应为NiO2+Fe+2H2OFe(OH)2+Ni(OH)2
(1)该蓄电池充电时,发生还原反应的物质是________(填选项字母)。放电时生成Fe(OH)2的质量为18 g,则外电路中转移的电子数是________________。
A.NiO2 B.Fe
C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的________(填“正”或“负”)极相连。
(3)以该蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是______________________(用相关的电极反应式和离子方程式表示)。
(4)精炼铜时,粗铜应与直流电源的________(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
已知:
沉淀物
Fe(OH)3
Fe(OH)2
Cu(OH)2
Zn(OH)2
开始沉淀时的pH
2.3
7.5
5.6
6.2
完全沉淀时的pH
3.9
9.7
6.4
8.0
则加入H2O2的目的是______________________________________________________。
乙同学认为应将方案中的pH调节到8,你认为此观点________(填“正确”或“不正确”),理由是___________________________________________________________。
解析:(1)该蓄电池充电时反应逆向进行,发生还原反应的电极为阴极,电极反应式为Fe(OH)2+2e-===Fe+2OH-。放电时Fe→Fe(OH)2,电极反应式为Fe-2e-+2OH-===Fe(OH)2,每生成1 mol Fe(OH)2,转移2 mol电子,18 g Fe(OH)2的物质的量为0.2 mol,故转移0.4 mol电子。
(2)外接电源的阴极保护法中,船体应与蓄电池的负极相连。
(3)铝制品发生钝化时,在铝表面形成致密的氧化膜,也会有Al3+进入溶液中与HCO发生反应Al3++3HCO===Al(OH)3↓+3CO2↑,使溶液变浑浊。
(4)精炼铜时,粗铜应与电源的正极相连。处理电解质溶液时加入H2O2将Fe2+转化为Fe3+,然后调节溶液的pH为4,可以使Fe3+以Fe(OH)3
的形式除去。若将溶液的pH调节到8,Cu2+也沉淀完全。
答案:(1)C 0.4NA或2.408×1023 (2)负
(3)Al-3e-===Al3+,Al3++3HCO===Al(OH)3↓+3CO2↑ (4)正 将Fe2+氧化为Fe3+ 不正确 同时会使Cu2+生成沉淀而除去
考点一 原电池原理与新型化学电源
查看《课前自测诊断卷》考点一,有哪些题目做错,为课堂找到努力方向!
考点定位
重要保分考点
错因定位
1.不熟悉原电池的工作原理导致判断错误,不会判断电子、溶液中离子移动的方向,两极发生的反应,如[诊断卷T2(C)]。
2.忽视电解质溶液中的离子(如H+或OH-)对电极反应的影响,导致电极反应式书写错误,如[诊断卷T2(B)、T4(B)]。
3.对充、放电电池的原理模糊不清,放电时为原电池原理、充电时为电解池原理,如[诊断卷T3]。
1.判一判:识别原电池中的易错点
(1)当两电池转移相同数目电子时,生成和消耗Ni的物质的量相同(√)
(2)两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动(√)
(3)由此可判断能够发生反应2Cr3++3Ni===3Ni2++2Cr和Ni2++Sn===Sn2++Ni(×)
(4)由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为Cr>Ni>Sn(√)
(5)去掉盐桥,电流表指针仍会发生偏转(×)
2.填一填:感悟电极方程式的书写规则
写出下列燃料电池装置的总反应方程式和电极反应式
①电池总反应为____________________________________________________________。
负极为_________________________________________________________________;
正极为________________________________________________________________。
②电池总反应为___________________________________________________________。
负极为______________________________________________________________;
正极为_______________________________________________________________。
③电池总反应为________________________________________________________。
负极为__________________________________________________________________;
正极为__________________________________________________________________。
④电池总反应为___________________________________________________________。
负极为______________________________________________________________;
正极为_______________________________________________________________。
答案:①CH4+2O2===CO2+2H2O
CH4+2H2O-8e-===CO2+8H+
2O2+8e-+8H+===4H2O
②CH4+2O2+2OH-===CO+3H2O
CH4+10OH--8e-===CO+7H2O
2O2+4H2O+8e-===8OH-
③2CO+O2===2CO2
2CO+2CO-4e-===4CO2
O2+4e-+2CO2===2CO
④2H2+O2===2H2O
2H2-4e-+2O2-===2H2O
O2+4e-===2O2-
3.记一记:背牢原电池中的基本知识
(1)原电池的结构及工作原理(以CuZn原电池为例)
(2)一般电极反应式的书写
①书写步骤
②常见介质
常见介质
注意事项
中性溶液
反应物若是H+得电子或OH-失电子,则H+或OH-均来自于水的电离
酸性溶液
反应物或生成物中均没有OH-
碱性溶液
反应物或生成物中均没有H+
水溶液
不能出现O2-
考向一 原电池工作原理
1.(2015·天津高考)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
解析:选C A项,Cu作正极,电极上发生还原反应,错误;B项,电池工作过程中,SO不参加电极反应,故甲池的c(SO)基本不变,错误;C项,电池工作时,甲池反应为Zn-2e-===Zn2+,乙池反应为Cu2++2e-===Cu,甲池中Zn2+会通过阳离子交换膜进入乙池,以维持溶液中电荷平衡,由电极反应式可知,乙池中每有64 g Cu析出,则进入乙池的Zn2+为65 g,溶液总质量略有增加,正确;D项,由题干信息可知,阴离子不能通过阳离子交换膜。
2.(2016·上海高考)图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
A.铜棒的质量 B.c(Zn2+)
C.c(H+) D.c(SO)
解析:选C 该装置构成原电池,Zn是负极,Cu是正极。A项,在正极Cu上溶液中的H+获得电子变为氢气,Cu棒的质量不变,错误;B项,由于Zn是负极,不断发生反应Zn-2e-===Zn2+,所以溶液中c(Zn2+)增大,错误;C项,由于反应不断消耗H+,所以溶液的c(H+)逐渐降低,正确;D项,SO不参加反应,其浓度不变,错误。
考向二 应用广泛的新型电池
3.(2015·江苏高考)一种熔融碳酸盐燃料电池原理示意图如下。下列有关该电池的说法正确的是( )
A.反应CH4+H2O3H2+CO,每消耗1 mol CH4转移12 mol电子
B.电极A上H2参与的电极反应为H2+2OH--2e-===2H2O
C.电池工作时,CO向电极B移动
D.电极B上发生的电极反应为O2+2CO2+4e-===2CO
解析:选D A选项,甲烷中的C为-4价,一氧化碳中的C为+2价,每个碳原子失去6个电子,因此每消耗1 mol甲烷失去6 mol电子,错误;B选项,熔融盐中没有氢氧根离子,因此氢氧根离子不能参与电极反应,电极反应式应为H2+CO+2CO-4e-===3CO2+H2O,错误;C选项,碳酸根离子应向负极移动,即向电极A移动,错误;D选项,电极B上氧气和二氧化碳得电子生成碳酸根离子,正确。
4.(2016·武汉模拟)气体自动化检测的探头应用了原电池原理:气体扩散进入敏感电极,发生原电池反应产生电信号,传感器通过对电信号进行分析、判断从而得到结论。下表列出了部分待测气体及敏感电极上部分产物,下列有关说法正确的是( )
待测气体
部分电极反应产物
NO
N2
H2
H2O
CO
CO2
SO2
SO3
A.检测NO时,敏感电极的电极反应式为2NO-4e-===N2+2O2-
B.检测汽车尾气中的CO时,传感器中通过的电流越大,尾气中CO的含量越高
C.检测SO2时,对电极充入空气,对电极上电极反应为O2+4H++4e-===2H2O
D.检测上述气体时,电流均从对电极流向敏感电极
解析:选B 检测NO时,NO生成N2,氮元素化合价由+2价变为0价而发生还原反应,则其所在电极为正极,故A错误;检测汽车尾气中的CO时,尾气中CO的含量越高,转移的电子越多,传感器中通过的电流越大,故B正确;检测二氧化硫时,二氧化硫生成三氧化硫,硫元素化合价由+4价变为+6价而发生氧化反应,则其所在电极为负极,正极上氧气得电子生成氧离子,故C错误;根据待测气体和反应产物可知,部分气体中元素化合价上升,部分气体中元素的化合价下降,所以敏感电极不一定都做电池负极,电流不一定均从对电极流向敏感电极,故D错误。
备考锦囊 原电池中氧气得电子的思维模型
根据燃料电池的特点,一般在正极上发生还原反应的物质都是O2,电解质溶液(酸碱盐)的不同,其电极反应有所不同,抓住氧元素的化合价变化规律,得到电子后化合价降低,首先变成O2-,O2-能否存在要看电解质环境。
下面总结了四种不同电解质环境中,氧气得电子后为O2-的存在形式:
电解质环境
从电极反应式判O2-的存在形式
酸性电解质溶液环境下
O2+4H++4e-===2H2O
碱性电解质溶液环境下
O2+2H2O+4e-===4OH-
固体电解质(高温下能传导O2-)环境下
O2+4e-===2O2-
熔融碳酸盐(如:熔融K2CO3)环境下
O2+2CO2+4e-===2CO
考向三 “久考不衰”的可充电电池
5.(2016·全国丙卷)锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O===2Zn(OH)。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为Zn+4OH--2e-===Zn(OH)
D.放电时,电路中通过2 mol电子,消耗氧气22.4 L(标准状况)
解析:选C A项,充电时装置为电解池,溶液中的阳离子向阴极移动。B项,充电时的总反应为放电时的逆反应:2Zn(OH)===2Zn+O2+4OH-+2H2O,c(OH-)逐渐增大。C项,放电时负极失电子发生氧化反应,由放电时的总反应可知,负极反应式为Zn+4OH--2e-===Zn(OH)。D项,由放电时的总反应可知,电路中通过2 mol电子时,消耗0.5 mol O2,其体积为11.2 L(标准状况)。
6.(2016·四川高考)某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为Li1-xCoO2+LixC6===LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是( )
A.放电时,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6-xe-===xLi++C6
C.充电时,若转移1 mol e-,石墨(C6)电极将增重7x g
D.充电时,阳极的电极反应式为LiCoO2-xe-===Li1-xCoO2+xLi+
解析:选C A.原电池中阳离子由负极向正极迁移,正确;B.放电时,负极发生氧化反应,电极反应式为LixC6-xe-===xLi++C6,正确;C.充电时,若转移1 mol电子,石墨电极质量将增重7 g,错误;D.充电时阳极发生氧化反应,电极反应式为LiCoO2-xe-===Li1-xCoO2+xLi+,正确。
备考锦囊 4方面突破可充电电池
考点二 电解原理及应用
查看《课前自测诊断卷》考点二,有哪些题目做错,为课堂找到努力方向!
考点定位
重要保分考点
错因定位
1.不熟悉电解池的工作原理导致判断错误,不会判断电解池中电子、溶液中离子移动方向,两极发生的反应,如[诊断卷T6、T7(D)]。
2.对溶液中离子氧化性(或还原性)的说明顺序与两极离子放电顺序关系模糊不清而错写电极反应式,错判电极产物,如[诊断卷T5、T7(B)]。
3.不会利用电子守恒解答电解池中计算问题,如[诊断卷T15(3)]。
1.辨清电解原理及应用中的易错点(正确的打“√”,错误的打“×”)
(1)电解质溶液导电是化学变化,金属导电是物理变化(√)
(2)电解法精炼铜时,用纯铜作阳极(×)
(3)在镀件上镀铜时,电镀液中c(Cu2+)几乎不变(√)
(4)电解法精炼铜时,电解质溶液中各离子浓度基本不变(×)
(5)电解饱和食盐水时,电子的流向由负极→外电路→阴极→食盐水溶液→阳极→正极(×)
(6)电镀时只能用镀层金属作阴极,镀件金属作阳极(×)
(7)工业上可用电解MgCl2、AlCl3溶液的方法制取Mg和Al(×)
(8)若把Cu+H2SO4===CuSO4+H2↑设计成电解池,应用Cu作阳极,稀H2SO4作电解质溶液(√)
(9)电解精炼铜时,阳极泥可以作为提炼贵重金属的原料(√)
(10)阳离子交换膜(以电解NaCl溶液为例),只允许阳离子(Na+)通过,而阻止阴离子(Cl-、OH-)和分子(Cl2)通过(√)
2.练熟电解池中常考的电极反应式
(1)用惰性电极电解饱和食盐水:
________________________________________________________________________。
(2)用惰性电极电解CuSO4溶液:
________________________________________________________________________。
(3)电解精炼铜
阳极:Zn-2e-===Zn2+、Ni-2e-===Ni2+、
Fe-2e-===Fe2+、________________;
阴极:________________。
答案:(1)2NaCl+2H2O2NaOH+H2↑+Cl2↑
(2)2CuSO4+2H2O2Cu+O2↑+2H2SO4
(3)Cu-2e-===Cu2+ Cu2++2e-===Cu
3.记牢离子放电顺序及电极反应式的书写
(1)准确判断放电顺序,锁定放电离子
(2)灵活运用书写电解池中电极反应式的思维流程
考向一 电解原理的分析与判断
1.铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图所示,下列说法正确的是( )
A.阳极电极反应式为2Al-6e-+6OH-===Al2O3+3H2O
B.随着电解的进行,溶液的pH逐渐增大
C.当阴极生成气体3.36 L(标准状况)时,阳极增重2.4 g
D.电解过程中H+移向Al电极
解析:选C A项,电解质为硫酸,反应中无OH-,错误;B项,电解总反应:2Al+3H2OAl2O3+3H2↑,H2O减少,溶液pH逐渐减小,错误;C项,阴极反应式为2H++2e-===H2↑,生成H2的物质的量为=0.15 mol,转移电子为2×0.15 mol=0.3 mol,阳极反应式为2Al+3H2O-6e-===Al2O3+6H+,根据差量法计算得阳极增重2.4 g,正确;D项,电解过程中,阳离子移向阴极,所以H+移向石墨电极,错误。
2.(2016·北京高考)用石墨电极完成下列电解实验。
实验一
实验二
装置
现象
a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化
两个石墨电极附近有气泡产生;n处有气泡产生……
下列对实验现象的解释或推测不合理的是( )
A.a、d处:2H2O+2e-===H2↑+2OH-
B.b处:2Cl--2e-===Cl2↑
C.c处发生了反应:Fe-2e-===Fe2+
D.根据实验一的原理,实验二中m处能析出铜
解析:选B 根据a、d处试纸变蓝,可判断a、d两点都为电解池的阴极,发生的电极反应为2H2O+2e-===H2↑+2OH-,A选项正确;b处变红,局部褪色,说明b为电解池的阳极,2Cl--2e-===Cl2↑,氯气溶于水生成盐酸和次氯酸:Cl2+H2O===HCl+HClO,HCl溶液显酸性,HClO具有漂白性,B选项不正确;c处为阳极,铁失去电子生成亚铁离子,发生的电极反应为Fe-2e-===Fe2+,C选项正确;实验一中ac形成电解池,db形成电解池,所以实验二中也形成电解池,铜珠的左端为电解池的阳极,铜失电子生成铜离子,m、n是铜珠的右端,为电解池的阴极,开始时产生气体,后来铜离子移到m处,m处铜离子得到电子生成单质铜,故D选项正确。
备考锦囊 判断阴阳极的四种方法
(1)根据所连接的外加电源判断,与直流电源正极相连的为阳极,与直流电源负极相连的为阴极。
(2)根据电子流动方向判断,电子流动方向为电源负极流向阴极,阳极流向电源正极。
(3)根据电解池里电解质溶液中离子的移动方向判断,阳离子向阴极移动,阴离子向阳极移动。
(4)根据电解池两极产物判断,一般情况下:
①阴极上的现象是:析出金属(质量增加)或有无色气体(H2)放出;
②阳极上的现象是:有非金属单质生成,呈气态的有Cl2、O2或电极质量减小(活性电极作阳极)。
考向二 电解原理的应用
3.(2015·四川高考)用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式:
Cl-+2OH--2e-===ClO-+H2O
C.阴极的电极反应式:
2H2O+2e-===H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+===N2↑+2CO2↑+5Cl-+H2O
解析:选D A项,若铁作阳极,则铁失电子生成Fe2+,则CN-无法除去,故铁只能作阴极,正确;B项,阳极Cl-放电生成ClO-,Cl的化合价升高,故在阳极发生氧化反应,又已知该溶液呈碱性,正确;C项,阳离子在电解池的阴极得电子发生还原反应,在碱性条件下,H2O提供阳离子(H+),正确;D项,由于溶液是碱性条件,故除去CN-发生的反应为2CN-+5ClO-+H2O===N2↑+2CO2↑+5Cl-+2OH-,错误。
4.工业上可利用下图所示电解装置吸收和转化SO2(A、B均为惰性电极)。下列说法正确的是( )
A.A电极接电源的正极
B.A极区溶液的碱性逐渐增强
C.本装置中使用的是阴离子交换膜
D.B极的电极反应式为SO2+2e-+2H2O===SO+4H+
解析:选B A项,由SO生成S2O,发生还原反应,A应为负极,错误;B项,阴极的电极反应式为2SO+2e-+2H2O===S2O+4OH-,碱性增强,正确;C项,离子交换膜应使H+移动,应为阳离子交换膜,错误;D项,B为阳极,发生SO2+2H2O-2e-===SO+4H+,错误。
5.室温下,ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂。制备ClO2的新工艺是电解法。
(1)如图表示用石墨作电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极产生ClO2的电极反应:__________________________________;图中b电极为________(填“阳极”或“阴极”)。
(2)电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________ mol,阴极区pH________(填“变大”“变小”或“不变”)。
解析:(1)ClO2是电解饱和NaCl溶液的产物,故氯元素被氧化,图中左侧通入的是饱和NaCl溶液,故a为阳极,b为阴极,阳极Cl-失电子,发生氧化反应,生成ClO2。(2)阴极反应为2H2O-2e-===H2↑+2OH-,生成标准状况下112 mL(即0.005 mol)氢气的同时生成0.01 mol OH-, 为保持溶液中的电荷守恒,则通过阳离子交换膜的阳离子为0.01 mol,阴极区的pH变大。
答案:(1)Cl--5e-+2H2O===ClO2↑+4H+ 阴极
(2)0.01 变大
考向三 电化学的定量计算技巧
6.如图所示,A池用石墨电极电解pH=13氢氧化钠溶液(100 mL),B池c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止,A池a极产生的气体在标准状况下为2.24 L,则下列说法正确的是( )
A.d电极质量一定减少6.4 g
B.c电极质量一定增加6.4 g
C.A池pH不变
D.A池溶液质量减少3.6 g
解析:选B 由现象:
由原理得a:4H++2e-===2H2↑
b:4OH--4e-===2H2O+O2↑
c:2Cu2++4e-===2Cu
由数据:n(H2)=0.1 molH2~Cu
c电极析出铜6.4 g。
7.在1 L K2SO4和CuSO4的混合溶液中c(SO)=2.0 mol·L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标准状况)气体,则原溶液中c(K+)为( )
A.2.0 mol·L-1 B.1.5 mol·L-1
C.1.0 mol·L-1 D.0.50 mol·L-1
解析:选A 由于两极均产生气体,所以阳极是阴离子OH-放电得到O2,阴极是Cu2+和H+放电得到Cu和H2,由得失电子守恒可知:2n(O2)=n(Cu2+)+n(H2),而n(O2)=n(H2)=22.4 L/(22.4 L·mol-1)=1.0 mol,所以n(Cu2+)=n(O2)=1.0 mol,c(Cu2+)=1.0 mol·L-1,原溶液中存在电荷守恒:c(K+)+2c(Cu2+)=2c(SO),所以c(K+)=2×2.0 mol·L-1-2×1.0 mol·L-1=2.0 mol·L-1。
备考锦囊 突破电化学定量计算的三种方法
例如由关系式法通过4 mol e-为基准可构建电极产物之间的如下关系式:
考点三 金属的腐蚀与防护
查看《课前自测诊断卷》考点三,有哪些题目做错,为课堂找到努力方向!
考点定位
基础送分考点
错因定位
1.分不清金属电化学腐蚀的类型而导致反应原理的判断错误,如
[诊断卷T9(A)]不能区分析氢腐蚀和吸氧腐蚀,[诊断卷T10(C)]对金属腐蚀速率快慢的影响因素。
2.不能利用电化学原理对金属进行防护,如[诊断卷T8(D)]。
1.记牢金属腐蚀与防护的方法
(1)金属腐蚀快慢程度的判断方法
(2)金属电化学保护的两种方法
2.辨清钢铁腐蚀与防护中的易错点(正确的打“√”,错误的打“×”)
(1)钢铁发生析氢腐蚀时,H+得电子释放出H2,钢铁被腐蚀(√)
(2)钢铁发生吸氧腐蚀时,OH-失电子释放出O2,钢铁被腐蚀(×)
(3)船底镶嵌锌块,锌发生还原反应而被消耗,以保护船体(×)
(4)外加电源的正极连接在海水中的钢铁闸门上,可保护闸门(×)
3.辨清金属腐蚀与防护中的易错点(正确的打“√”,错误的打“×”)
(1)图1中,插入海水中的铁棒,越靠近底端腐蚀越严重(×)
(2)图2中,往烧杯中滴加几滴KSCN溶液,溶液变红色(×)
(3)图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀(√)
(4)图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极(×)
1.(2015·上海高考)研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )
A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为O2+2H2O+4e-―→4OH-
C.d为锌块,铁片不易被腐蚀
D.d为锌块,铁片上电极反应为2H++2e-―→H2↑
解析:选D 由于活动性:Fe>石墨,所以铁、石墨及海水构成原电池,Fe为负极,失去电子被氧化变为Fe2+进入溶液,溶解在海水中的氧气在正极石墨上得到电子被还原,比没有形成原电池时的速率快,正确。B.d为石墨,由于是中性电解质,所以发生的是吸氧腐蚀,石墨上氧气得到电子,发生还原反应,电极反应为O2+2H2O+4e-―→4OH-,正确。C.若d为锌块,则由于金属活动性:Zn>Fe,Zn为原电池的负极,Fe为正极,首先被腐蚀的
是Zn,铁得到保护,铁片不易被腐蚀,正确。D.d为锌块,由于电解质为中性环境,发生的是吸氧腐蚀,在铁片上电极反应为O2+2H2O+4e-―→4OH-,错误。
2.(2016·潍坊模拟)对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为________________________________________________________________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是________________。在此过程中,两个电极上质量的变化值:阴极________阳极(填“>”“<”或“=”)。
(3)利用如图所示的装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于________(填“M”或“N”)处。若X为锌,开关K置于M处,该电化学防护法称为______________。
解析:(1)阳极铝被氧化成Al2O3,反应过程中有水参加,故电极反应式为2Al+3H2O-6e-===Al2O3+6H+。(2)电镀时,为保证阴极上只有铜析出,就要确保电镀过程中溶液中有足够多的Cu2+,因此阳极就需要不断地溶解铜,以补充电镀液中的Cu2+。(3)铁被保护,可以作原电池的正极或电解池的阴极。故若X为碳棒,开关K应置于N处,Fe作阴极受到保护;若X为锌,开关K置于M处,铁作正极,称为牺牲阳极的阴极保护法。
答案:(1)2Al+3H2O-6e-===Al2O3+6H+ (2)能向电镀液中不断补充Cu2+,使电镀液中的Cu2+浓度保持恒定 = (3)N 牺牲阳极的阴极保护法
考点四 串联装置中的电化学问题
查看《课前自测诊断卷》考点四,有哪些题目做错,为课堂找到努力方向!
考点定位
难点拉分考点
错因定位
分不清串联装置中各装置的类型而对题目无处下手,特别是无外接直流电源的串联装置,更是无法判断出哪个装置是原电池,哪个是电解池,如[诊断卷T11(A、C)]、[诊断卷T12]判断出铁电极和碳电极的类型。
1.练一练:夯实串联装置中的基础点
(1)无外接直流电源的串联装置
①甲装置为________池,其中Zn为________极,电极反应式为____________________。
②乙装置为________池,其中Fe为________极,电极反应式为_____________________。
(2)有外接直流电源的串联装置
③甲装置为________池,其中Cu为________极,电极反应式为_____________________。
④乙装置为________池,其中Cu为________极,电极反应式为____________________。
答案:①原电 负 Zn-2e-===Zn2+
②电解 阴 2H++2e-===H2↑
③电解 阴 2H++2e-===H2↑
④电镀 阳 Cu-2e-===Cu2+
2.记一记:学会判断电池类型的方法
(1)无外接电源电池类型的判断方法
①根据装置图直接判断
非常直观明显的装置,如燃料电池、铅蓄电池等在电路中,则其他装置为电解池。如下图所示,A为原电池,B为电解池。
②根据电池中的电极材料和电解质溶液判断
原电池一般是两种材料不同的电极;而电解池则一般都是两个惰性电极。原电池中的电极材料和电解质溶液能发生自发氧化还原反应,电解池的电极材料一般不能和电解质溶液自发反应。如右图所示,B为原电池,A为电解池。
③根据电极反应现象判断
在某些装置中根据电极反应或反应现象可判断电极,并由此判断电池类型,如右图所示,若C极溶解,D极上析出Cu,B极附近溶液变红,A极上放出黄绿色气体,则可知乙是原电池,D是正极, C是负极;甲是电解池, A是阳极,B是阴极。B、D极发生还原反应,A、C极发生氧化反应。
(2)有外接电源电池类型的判断方法
有外接电源的各电池均为电解池,若电池阳极材料与电解质溶液中的阳离子相同,则该电池为电镀池。如:
则甲为电镀池,乙、丙均为电解池。
题型一 无外接电源的串联装置
1.(2014·广东高考)某同学组装了如图所示的电化学装置。电极Ⅰ为Al,其他电极均为Cu,则( )
A.电流方向:电极Ⅳ→Ⓐ→电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e-===Cu
解析:选A 首先应根据图示判断左边两池通过盐桥构成原电池,产生电流对右边硫酸铜溶液进行电解(相当于精炼铜)。电极Ⅰ为负极,电极Ⅱ为正极,所以电流方向:电极Ⅳ→Ⓐ→电极Ⅰ(电流方向与电子流动方向相反),A正确。电极Ⅰ上铝失电子发生氧化反应,B错。电极Ⅱ上有铜析出,C错。电极Ⅲ的电极反应:Cu-2e-===Cu2+,D错。
2.按照下图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):
(1)U形管内发生的现象为___________________________________________。
(2)写出有关反应的化学方程式___________________________________________。
(3)在a、b烧杯中发生的现象______________________________________________。
(4)如果小烧杯中有0.508 g碘析出,问大烧杯中负极减轻________ g。
解析:由图知,左边的装置为原电池,Zn为负极,Pt为正极,电解质溶液为硫酸溶液,总反应化学方程式为Zn+H2SO4===ZnSO4+H2↑,因此,右边的装置为电解池,根据装置的连接方式,电解池的左边为阳极,右边为阴极,电解质溶液为KCl溶液,阳极附近氯离子放电,生成氯气,所以a烧杯的淀粉KI溶液变蓝,化学反应方程式为2KI+Cl2===2KCl+I2,阴极附近氢离子放电产生氢气,同时生成氢氧根离子,因此酚酞溶液变红,b烧杯中有无色气泡生成,电解的总方程式为2KCl+2H2OH2↑+Cl2↑+2KOH;根据电子转移守恒,Zn~I2,根据生成的碘单质的质量,可求出锌消耗的质量。
答案:(1)左侧管内有黄绿色气体逸出,右侧管内有无色气体逸出,右侧溶液由无色变为红色
(2)Zn+H2SO4===ZnSO4+H2↑,
2KCl+2H2OH2↑+Cl2↑+2KOH,
2KI+Cl2===2KCl+I2
(3)a烧杯中的溶液变蓝,b烧杯中有无色气体生成,溶液无明显变化
(4)0.13
题型二 有外接电源的串联装置
3.如图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深。下列说法中不正确的是( )
A.电源的M极为正极
B.甲装置中溶液的pH减小
C.甲装置的两个电极上都有单质生成且物质的量之比为1∶1
D.欲用乙装置给铜镀银,U极应该是Ag,电镀液选择AgNO3溶液
解析:选C W极附近颜色逐渐加深,说明通电时氢氧化铁胶粒移向该电极,即 W连接电源的负极,则M为正极,N为负极,A正确;通电时,甲中X为阳极,电极反应为2H2O-4e-===O2↑+4H+,Y为阴极,电极反应为2Cu2++4e-===2Cu,总反应为2CuSO4+2H2O2Cu+2H2SO4+O2↑,甲装置中溶液的pH减小,B正确;n(O2)∶n(Cu)=1∶2,C错误;电镀时镀层金属作阳极,即U极是Ag,电镀液为AgNO3溶液,D正确。
4.CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-===2CuI↓+I2而得到。如图所示装置中,a、b都是惰性电极,通电一段时间后,在淀粉KI溶液中阳极周围变蓝色,则下列说法正确的是( )
A.若a极变红,则在Pt电极上:2I--2e-===I2,碘使淀粉变蓝
B.若b极变红,则在Pt电极上:4OH--4e-===2H2O+O2↑,O2将I-氧化为I2,碘使淀粉变蓝
C.若a极变红,则在Cu电极上:开始时Cu-2e-===Cu2+,一段时间后2Cu2++4I-===2CuI↓+I2,碘使淀粉变蓝
D.若b极变红,则在Cu极上:Cu-2e-===Cu2+,Cu2+显蓝色
解析:选C 电解NaCl溶液(滴入酚酞)时,阴极附近变红,若a极变红,则Cu电极为阳极,则Cu-2e-===Cu2+,2Cu2++4I-===2CuI↓+I2,碘使淀粉变蓝;若b极变红,Pt电极为阳极,发生2I--2e-===I2,碘使淀粉变蓝,C正确。
考点五 高考新动向——带交换膜的电化学装置
查看《课前自测诊断卷》考点五,有哪些题目做错,为课堂找到努力方向!
考点定位
难点拉分考点
错因定位
弄不明有膜电池的工作原理,理不清交换膜与阴、阳离子移动方向的关系而出错,如[诊断卷T13(B)]由交换膜和电源的正负,可推出H+从b极区向a极区移动。
考向一 使用阳离子(或质子)交换膜的电化学装置
1.(2015·全国卷Ⅰ)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2===6CO2+6H2O
解析:选A 图示所给出的是原电池装置。A.有氧气反应的一极为正极,发生还原反应,因为有质子通过,故正极电极反应式为O2+4e-+4H+===2H2O,C6H12O6在微生物的作用下发生氧化反应,电极反应式为C6H12O6-24e-+6H2O===6CO2+24H+,负极上有CO2产生,故A不正确。B.微生物电池是指在微生物作用下将化学能转化为电能的装置,所以微生物促进了反应中电子的转移,故B正确。C.质子是阳离子,阳离子由负极区移向正极区,故C正确。D.正极的电极反应式为6O2+24e-+24H+12H2O,负极的电极反应式为C6H12O6
-24e-+6H2O===6CO2+24H+,两式相加得电池总反应为C6H12O6+6O2===6CO2+6H2O,故D正确。
2.(2015·山东高考节选)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。利用如图所示装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为________溶液(填化学式),阳极电极反应式为____________________________,电解过程中Li+向________电极迁移(填“A”或“B”)。
解析:根据电解装置图,两电极区电解液分别为LiOH和LiCl溶液,B极区产生H2,电极反应式为2H++2e-===H2↑,剩余OH-与Li+结合生成LiOH,所以B极区电解液应为LiOH溶液,B电极为阴极,则A电极应为阳极。阳极区电解液应为LiCl溶液,电极反应式为2Cl--2e-===Cl2↑。根据电流方向,电解过程中Li+向B电极迁移。
答案:LiOH 2Cl--2e-===Cl2↑ B
备考锦囊
阳离子交换膜有很多微孔,孔道上有许多带负电荷的基团,阳离子可以自由通过孔道,而阴离子移动到孔道处,受到孔道带负电荷基团的排斥而不能进入孔道中,因而不能通过交换膜。第2题中使用阳离子交换膜,H2、OH-不能通过交换膜,保证Cl2和生成的H2、OH-不接触,同时Li+能通过,制得浓度更高的LiOH,而LiCl溶液浓度降低,须定时添加。而质子交换膜是阳离子交换膜的特例,仅允许质子(H+)通过,其余的均不能通过。第1题中负极区产生的H+,通过质子交换膜到达正极。
考向二 使用阴离子交换膜的电化学装置
3.(2016·襄阳模拟)高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )
A.镍是阳极,电极反应为4OH--4e-===O2↑+2H2O
B.电解时电流的方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
解析:选D 用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4),铁失电子生成FeO,则铁作阳极,镍作阴极,电极反应式为Fe+8OH--6e-===FeO+4H2O,A项错误;电解时,电流的方向与电子的运动方向相反,则电流的方向为:正极→Fe电极~Ni电极→负极,B项错误;若隔膜为阴离子交换膜,则OH-自左向右移动,C项错误;阳极反应为Fe+8OH--6e-===FeO+4H2O,阴极反应为6H++6e-===3H2↑,则电池的总反应为Fe+2NaOH+2H2O===Na2FeO4+3H2↑,电解过程消耗NaOH,所以撤去隔膜混合后,与原溶液比较pH降低,D项正确。
4.电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-===IO+5I-+3H2O,下列说法不正确的是( )
A.右侧发生的电极方程式:2H2O+2e-===H2↑+2OH-
B.电解结束时,右侧溶液中含有IO
C.电解槽内发生反应的总化学方程式:KI+3H2O===KIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
解析:选D 电解的电极反应:阳极2I--2e-===I2,使左侧溶液变蓝色;3I2+6OH-===IO+5I-+3H2O,则一段时间后,蓝色变浅;IO通过阴离子交换膜向右侧移动;阴极2H2O+2e-===H2↑+2OH-,右侧放出氢气。如果用阳离子交换膜代替阴离子交换膜:阳极2I--2e-===I2,多余K+通过阳离子交换膜迁移至阴极;阴极2H2O+2e-===H2↑+2OH-,保证两边溶液呈电中性,结果不会生成IO,总化学方程式当然不同。
备考锦囊
阴离子交换膜有很多微孔,孔道上有许多带正电荷的基团,阴离子可以自由通过孔道,而阳离子移动到孔道处,受到孔道带正电荷基团的排斥而不能进入孔道中,因而不能通过交换膜。题4中阴离子交换膜保证OH-、IO通过,从而发生上述现象。
考向三 阴、阳离子膜共同使用的电化学装置
5.电解硫酸钠溶液生产硫酸和烧碱的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,下列有关说法正确的是( )
(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)
A.a电极上发生的反应为2H++2e-===H2↑
B.产物丙为硫酸
C.d为阴离子交换膜
D.Na2SO4溶液浓度增大
解析:选B 电解硫酸钠溶液的实质是电解水,又同温同压下气体甲与气体乙的体积比约为1∶2,则甲为O2,乙为H2,故a电极上为H2O电离出的OH-放电,产生氧气,A项错误;a电极为阳极,阳极上H2O电离出的OH-放电,SO向阳极移动,因此产物丙为硫酸,B项正确;b为阴极,阴极上H2O电离出的H+放电,Na+向阴极移动,则d为阳离子交换膜,C项错误;Na2SO4溶液中Na+向阴极移动、SO向阳极移动,因此Na2SO4溶液的浓度减小,D项错误。
6.(2014·新课标Ⅰ节选)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式_______________________________________________。
②分析产品室可得到H3PO2的原因_______________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替。并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质。该杂质产生的原因是_____________________________。
解析:①阳极为水电离出的OH-放电,电极反应式为2H2O-4e-===O2↑+4H+。②阳极室中的H+穿过阳膜进入产品室,原料室中的H2PO穿过阴膜扩散至产品室,二者反应生成H3PO2。③在阳极区H2PO或H3PO2可能失电子发生氧化反应,即生成物中会混有PO。
答案:①2H2O-4e-===O2↑+4H+ ②阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO穿过阴膜扩散至产品室,二者反应生成H3PO2 ③PO H2PO或H3PO2被氧化
备考锦囊
交换膜在电化学工业中应用十分广泛,工业上用电解原理来制取产品时,使用离子交换膜具有占地面积小,能连续生产,生产能力大,产品质量高,能耗低等优点。题6中以次磷酸(H3PO2
)为载体,考查电解原理在物质制备中的应用,突出电渗析原理的新信息的获取、分析、理解,充分体现了“源于教材又不拘泥于教材”的指导思想,即不仅要知其然,还要知其所以然。
1.下列表述正确的是( )
A
B
C
D
盐桥中的Cl-移向CuSO4溶液
b极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝
粗铜的电极反应式为Cu2++2e-===Cu
正极反应式为O2+4e-+2H2O===4OH-
解析:选D 由于金属活动性:Zn>Cu,Zn极的电极反应式为Zn-2e-===Zn2+,Cl-移向ZnSO4溶液,A项错误;B项,该装置为电解池,b电极为阴极,电极反应式为Cu2++2e-===Cu,a电极产生Cl2,错误; C项,粗铜的电极反应式为Cu-2e-===Cu2+,错误; D项,该装置为原电池,钢铁发生吸氧腐蚀,正极反应式为O2+4e-+2H2O===4OH-,正确。
2.(2016·海南高考,有改动)某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法正确的是( )
A.Zn为电池的正极
B.正极反应式为2FeO+10H++6e-===Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时OH-向负极迁移
解析:选D A.根据化合价升降判断,Zn化合价只能上升,故为负极材料,K2FeO4为正极材料,错误;B.KOH溶液为电解质溶液,则正极电极反应式为2FeO+6e-+8H2O ===2Fe(OH)3+10OH-,错误;C.由电池总反应式3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH可得,电解质溶液浓度变大,错误;D.电池工作时阴离子OH-向负极迁移,正确。
3.金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍。下列叙述中正确的是(已知:氧化性Fe2+Fe2+>Zn2+,故阴极反应为Ni2++2e-===Ni,可见,阳极质量减少是因为Zn、Fe、Ni溶解,而阴极质量增加是因为析出Ni,B错误;电解后溶液中的阳离子除Fe2+和Zn2+外,还有Ni2+、H+,C错误。
4.(2016·潍坊统考)一定条件下,利用如图所示装置可实现有机物苯(C6H6)到环己烷(C6H12)的转化。下列叙述错误的是( )
A.导线中电子的移动方向为D→A
B.生成目标产物的电极反应式为C6H6+6H++6e-===C6H12
C.装置图右侧产生的气体是氧气
D.上述过程中电能转化为化学能
解析:选A 由题图可知,左侧发生苯转化为环己烷的反应,电极反应式为C6H6+6H++6e-===C6H12,B项不符合题意;左侧电极D上发生还原反应,电极D为阴极,则A为电源负极,导线中电子的移动方向为电源负极A→电解池阴极D,A项符合题意;右侧电极E上发生氧化反应2H2O-4e-===O2↑+4H+,产生的气体为氧气,C项不符合题意;题中装置为电解池,电能转化为化学能,D项不符合题意。
5.由我国科学家研发成功的铝锰电池是一种比能量很高的新型干电池,以氯化钠和稀氨水混合溶液为电解质,铝和二氧化锰-石墨为两极,其电池反应为Al+3MnO2+3H2O===3MnO(OH)+Al(OH)3。下列有关该电池放电时的说法不正确的是( )
A.二氧化锰-石墨为电池正极
B.负极反应式为Al-3e-+3NH3·H2O===Al(OH)3+3NH
C.OH-不断由负极向正极移动
D.每生成1 mol MnO(OH)转移1 mol 电子
解析:选C 由电池反应方程式知,铝为电池负极,二氧化锰-石墨为电池正极,铝失电子转化为Al(OH)3,A、B正确;阴离子移向负极,C错误;由反应中锰元素价态变化知D正确。
6.(2016·东北名校联考)如图是电化学催化还原二氧化碳制备一氧化碳的装置示意图,质子交换膜将电解池分隔为阴极室和阳极室。下列说法中正确的是( )
A.a是阴极
B.B极室的反应是CO2+2e-+2H+===CO+H2O
C.一段时间后,A极室中溶液的pH增大
D.电子由B极室流向A极室
解析:选B 由题意可知该装置是电解池,根据质子的流向知b是阴极,发生的电极反应为CO2+2e-+2H+===CO+H2O,A极室发生的电极反应为2H2O-4e-===4H++O2↑,总反应式是2CO2===2CO+O2,A错误,B正确;A极室中溶液的pH不变,C错误;电子不能在电解质溶液中流动,D错误。
7.(2016·全国乙卷)三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
下列叙述正确的是( )
A.通电后中间隔室的SO离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O-4e-===O2+4H+,负极区溶液pH降低
D.当电路中通过1 mol电子的电量时,会有0.5 mol的O2生成
解析:选B A项正极区发生的反应为2H2O-4e-===O2↑+4H+,由于生成H+,正极区溶液中阳离子增多,故中间隔室的SO向正极迁移,正极区溶液的pH减小。B项负极区发生的反应为2H2O+2e-===H2↑+2OH-,阴离子增多,中间隔室的Na+向负极迁移,故负极区产生NaOH,正极区产生H2SO4。C项由B项分析可知,负极区产生OH-,负极区溶液的pH升高。D项正极区发生的反应为2H2O-4e-===O2↑+4H+,当电路中通过1 mol电子的电量时,生成0.25 mol O2。
8.PbO2微生物燃料电池(MFC)是利用微生物将有机物中的化学能直接转化成电能的装置(如图),若利用微生物分解香蕉皮(生成的葡萄糖作反应物)使该电池工作,下列说法正确的是( )
A.a电极为正极,b电极为负极
B.b电极附近有PbO2,发生的电极反应为PbO2+2H2O+2e-===Pb2++4OH-
C.电池的总反应式为6CO2+12Pb2++18H2O===12PbO2+C6H12O6+24H+
D.该电池一般是在常温环境中工作,使得电池维护成本低,安全性强
解析:选D 根据图中H+的流向和电子的流向可推知a电极为负极,b电极为正极,A选项错误;PbO2在b电极得到电子,发生还原反应,溶液为酸性,电极反应式为PbO2+4H++2e-===Pb2++2H2O,B选项错误;香蕉皮经微生物分解后生成葡萄糖,负极反应为葡萄糖失电子生成二氧化碳,电极反应式为C6H12O6-24e-+6H2O===6CO2↑+24H+,所以总反应式为12PbO2+C6H12O6+24H+===6CO2↑+12Pb2++18H2O,C选项错误;温度过高,微生物会因变性而死亡,所以D选项正确。
9.(2016·宜昌模拟)(1)下列金属防腐的措施中,①水中的钢闸门连接电源的负极使用的是________________法;②地下钢管连接镁块使用的是________________法。
(2)NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图,石墨Ⅰ为电池的________极;该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为________________。
(3)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。回答下列问题:
①A极为电池________极,电极反应式为_______________________________________。
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L-1
的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为______(标准状况下)。
解析:(1)钢闸门连接电源的负极做阴极,此方法为外加电流的阴极保护法;若连接镁块,则让镁作原电池的负极,此方法为牺牲阳极的阴极保护法。(2)该燃料电池中,负极上通入NO2,石墨Ⅰ为负极,电极反应式为NO2+NO-e-===N2O5,正极上通入O2,石墨Ⅱ为正极,电极反应式为O2+2N2O5+4e-===4NO,所以NO向负极移动,即NO移向石墨Ⅰ。(3)①由阴离子移动方向可知B为负极,负极发生氧化反应,甲烷被氧化生成二氧化碳和水,电极反应式为CH4+4O2--8e-===CO2+2H2O,A极是正极,该电极上是氧气得电子的还原反应,电极反应式为O2+4e-===2O2-。②硫酸铜的物质的量=0.1 L×2 mol·L-1=0.2 mol,开始阶段发生反应:2Cu2++2H2O===2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O2H2↑+O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,设氢气为x mol,根据电子转移守恒,则:0.1 mol×2+2x=4x,解得x=0.1,根据电子转移守恒,可知消耗的甲烷物质的量==0.05 mol,故消耗甲烷的体积=0.05 mol ×22.4 L·mol-1=1.12 L。
答案:(1)外加电流的阴极保护 牺牲阳极的阴极保护 (2)负 NO2+NO-e-===N2O5
(3)①正 O2+4e-===2O2- ②1.12 L