- 239.00 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
选修三 《物质结构与性质》综合测试(5)
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。
分值:120分 考试时间为90分钟。
第I卷( 选择题 共60分 )
可能用到的相对原子原子质量:H─1 C─12 N─14 O─16 Na─23
Mg─24 Al─27 Cl─35.5
一.选择题(本题包括20小题,每小题3分,共60分。每小题只有一个选项符合题意。)
1.在物质结构研究的历史上,首先提出原子内有电子学说的是( )
A.道尔顿 B.卢瑟福 C.汤姆生 D.波尔
2.一个电子排布为1s22s22p63s23p1的元素最可能的价态是( )
A +1 B +2 C +3 D -1
3. 以下能级符号不正确的是 ( )
A.3s B.3p C .3d D.3f
4. 下列能跟氢原子形成最强极性键的原子是( )
A.F B.Cl C.Br D.I
5. 关于晶体的下列说法正确的是 ( )
A. 任何晶体中,若含有阳离子就一定有阴离子。
B. 原子晶体中只含有共价键。
C. 原子晶体的熔点一定比金属晶体的高。
D.离子晶体中只含有离子键,不含有共价键。
6.下列说法中,不符合ⅦA族元素性质特征的是( )
A.易形成-1价离子 B.从上到下原子半径逐渐减小
C.从上到下单质的氧化性逐渐减弱 D.从上到下氢化物的稳定性依次减弱
7. 下列晶体熔化时不需破坏化学键的是( )
A. 晶体硅 B .食盐 C .干冰 D .金属钾
8. 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是 ( )
A. 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变。
B. 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+。
C. 向反应后的溶液加入乙醇,溶液没有发生变化 。
D. 在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道。
9. 关于CO2说法正确的是 ( )
A. 碳原子采取sp杂化。 B. CO2是正四面体型结构。
C. 干冰是原子晶体。 D. CO2为极性分子。
10. 下列物质的立体结构与NH3相同的是( )
A. H2O B. H3O+ C. CH4 D. CO2
11.下列分子或离子中,含有孤对电子的是
A.NH4+ B.CCl4 C.SiH4 D.H3P
12.已知X.Y元素同周期,且电负性X>Y,下列说法错误的是( )
A . X与Y形成化合物是,X可以显负价,Y显正价
B .第一电离能可能Y小于X
C . 最高价含氧酸的酸性:X对应的酸性弱于于Y对应的
D .气态氢化物的稳定性:HmY小于HmX
13.实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°。由此可见,BeCl2属于( )
A.由极性键构成的极性分子 B.由极性键构成的非极性分子
C.由非极性键构成的极性分子 D.由非极性键构成的非极性分子
14.下列关于丙烯(CH3—CH =CH2)的说法正确的( )
A. 丙烯分子有7个δ键,1个∏键。
B. 丙烯分子中3个碳原子都是sp3杂化。
C. 丙烯分子存在非极性键。
D. 丙烯分子中3个碳原子在同一直线上。
15. 下列各组物质中,化学键类型相同,晶体类型也相同的是 ( )
A. CH4 和 H2O B. KCl 和 HCl
C. Cl2 和 KCl D. SiO2 和 CO2
16. 下列说法正确的是 ( )
A. HF、HCl、HBr、HI的熔点沸点依次升高。
B. H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。
C. 乙醇分子与水分子之间只存在范德华力。
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
17.水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是( )
A.玻璃态是水的一种特殊状态 B .水由液态变为玻璃态,体积膨胀
C.水由液态变为玻璃态,体积缩小 D. 玻璃态水是分子晶体
18.下列晶体中,其中任何一个原子都被相邻四个原子包围,以共价键形成正四面体,并向空间伸展成网状结构的是( )
A.四氯化碳 B.石墨 C.金刚石 D.水晶
19.下列化合物中含有手性碳原子的是( )
A.CF2 B. C.CH3CH2OH D.——COOH
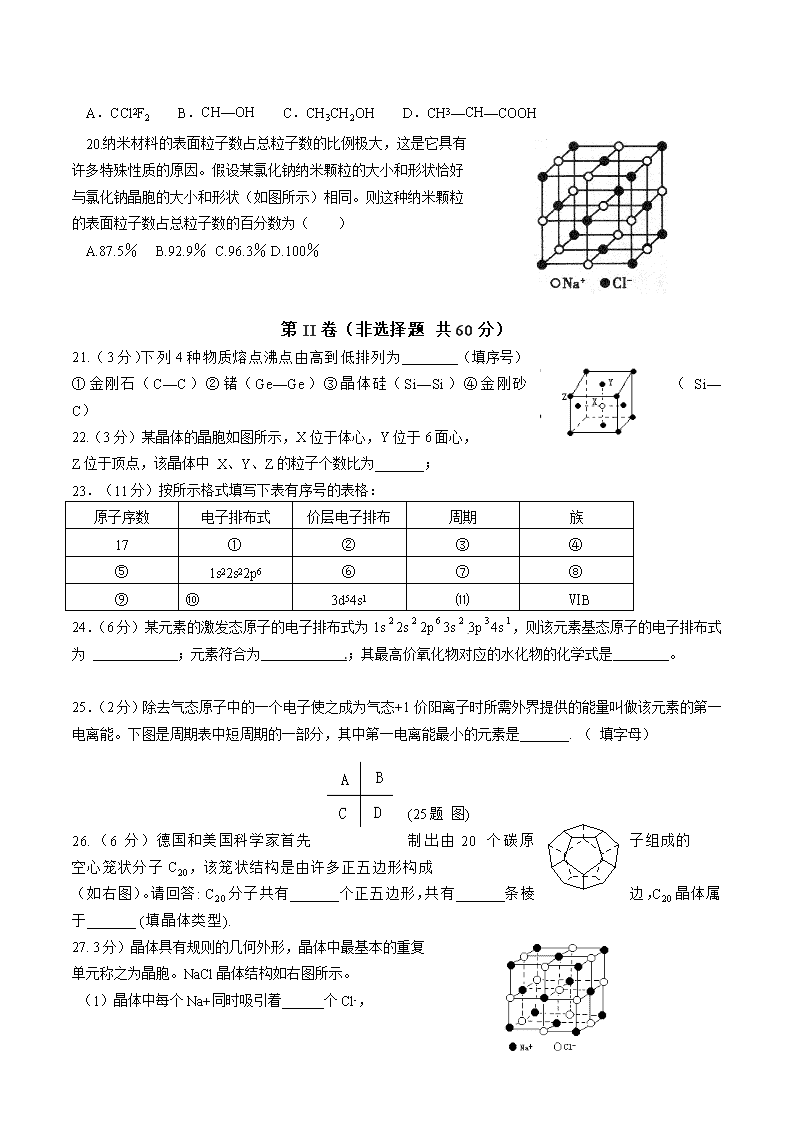
20.纳米材料的表面粒子数占总粒子数的比例极大,这是它具有
许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好
与氯化钠晶胞的大小和形状(如图所示)相同。则这种纳米颗粒
的表面粒子数占总粒子数的百分数为( )
A.87.5% B.92.9% C.96.3% D.100%
第II卷(非选择题 共60分)
21.(3分)下列4种物质熔点沸点由高到低排列为________(填序号)
①金刚石(C—C)②锗(Ge—Ge)③晶体硅(Si—Si)④金刚砂(Si—C)
22.(3分)某晶体的晶胞如图所示,X位于体心,Y位于6面心,
Z位于顶点,该晶体中 X、Y、Z的粒子个数比为_______;
23.(11分)按所示格式填写下表有序号的表格:
原子序数
电子排布式
价层电子排布
周期
族
17
①
②
③
④
⑤
1s22s22p6
⑥
⑦
⑧
⑨
⑩
3d54s1
⑾
ⅥB
24.(6分)某元素的激发态原子的电子排布式为1s2s2p3s3p4s,则该元素基态原子的电子排布式为 ;元素符合为 ;其最高价氧化物对应的水化物的化学式是 。
25.(2分)除去气态原子中的一个电子使之成为气态+1价阳离子时所需外界提供的能量叫做该元素的第一电离能。下图是周期表中短周期的一部分,其中第一电离能最小的元素是_______. ( 填字母)
(25题 图)
26.(6分)德国和美国科学家首先制出由20个碳原子组成的
空心笼状分子C20,该笼状结构是由许多正五边形构成
(如右图)。请回答: C20分子共有_______个正五边形,共有_______条棱边,C20晶体属于_______ (填晶体类型).
27. 3分)晶体具有规则的几何外形,晶体中最基本的重复
单元称之为晶胞。NaCl晶体结构如右图所示。
(1)晶体中每个Na+同时吸引着______个Cl-,
每个Cl-同时吸引着_______个Na+。
(2)晶体中在每个Cl-周围与它最接近且距离相等
的Cl-共有________个。
28.(6分)Co(NH3)5BrSO4可形成两种钴的配合物 ,已知两种配合物的分子式分别为[Co(NH3)5Br] SO4 和[Co (SO4) (NH3)5] Br, 在第一种配合物的溶液中加BaCl2 溶液时, 产生 现象 ;如果在第二种配合物的溶液中加入BaCl2溶液时,产生 现象,若加入 AgNO3溶液时,产生 现象。
附加题(共20分)
29.(10分)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
元素
Al
B
Be
C
Cl
F
Li
X的数值
1.5
2.0
1.5
2.5
2.8
4.0
1.0
元素
Mg
Na
O
P
S
Si
X的数值
1.2
0.9
3.5
2.1
2.5
1.7
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlCl3中的化学键类型是______。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系______________________________;简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系_____________________________________________。
(3)请你预测Br与I元素的X数值的大小关系________。
(4)某有机化合物分子中含有S—N键,你认为该共用电子对偏向于________原子(填元素符号)。
30. (10分)根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
元素代号
I1
I2
I3
I4
Q
2080
4000
6100
9400
R
500
4600
6900
9500
S
740
1500
7700
10500
T
580
1800
2700
11600
U
420
3100
4400
5900
(1)在周期表中,最可能处于同一族的是( )
A Q和R B S和T C T和U D R和T E R和U
(2)电解它们的熔融氯化物,阴极电极反应式最可能正确的是( )
A Q2++2e-→Q B R2++2e-→R C S3++3e-→S
D T3++3e-→T E U2++2e-→U
(3)它们的氯化物的化学式,最可能正确的是( )
A QCl2 B RCl C SCl3 D TCl E UCl4
(4)S元素最可能是( )
A S区元素 B 稀有气体元素 C p区元素
D 准金属 E d区元素
(5)下列元素中,化学性质和物理性质最像Q元素的是( )
A 硼(1s22s22p1) B 铍(1s22s2) C 锂(1s22s1)
D 氢(1s1) E 氦(1s2)
参考答案
一、选择题答案(每小题4分,共60分。每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
答案
C
C
D
A
B
B
C
B
A
B
题号
11
12
13
14
15
16
17
18
19
20
答案
D
C
B
C
A
B
A
C
D
C
21、①>④>③>② 22、 1:3:1
23、(1)1s22s22p63s23p5 (2)3s23p5 (3)3 (4)ⅦA(5)10 (6)2s22p6
(7)2 (8)0 (9)24(10)1s22s22p63s23p63d54s1 (11)4
24.1s22s22p63s23p4;S;H2SO4。
25.C;26.12.30;分子晶体。27.6;6;12
28.白色沉淀.无异常现象.淡黄色沉淀。
29. (1)共价键
(2)元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强)原子半径越小,X的数值越大
(3)Br大于I (4)N (10分)
30(1-5: ) E D B A E(10分)